Проба лоури для чего
Метод Лоури
Метод Лоури — один из колориметрических методов количественного определения белков в растворе. Предложен Лоури (Lowry) в 1951 году. [1] Является самой цитируемой научной статьей в мире (к январю 2004 году статья была процитирована более 275000 раз). [2]
Содержание
Принцип
Другие методы
Примечания
Ссылки
Полезное
Смотреть что такое «Метод Лоури» в других словарях:
Метод Бредфорда — Метод Бредфорда один из колориметрических методов количественного определения белков в растворе. Предложен биохимиком Мерионом Бредфорд (англ. en:Marion M. Bradford) в 1976 году.[1] Статья М. Бредфорд в журнале Anal Biochem,… … Википедия
Лоури метод — (нрк; О. Н. Lowry, род. в 1910 г., амер. фармаколог) см. Лаури метод … Большой медицинский словарь
Бредфорд метод — Метод Бредфорд один из колориметрических методов количественного определения белков в растворе. Предложен Мерион Бредфорд в 1976 году (Bradford M.M. (1976) Anal. Biochem. 72: 248 254.). Содержание 1 Принцип 2 Другие методы 3 Литература 4 С … Википедия
Биуретовый метод — Биуретовый метод один из колориметрических методов количественного определения белков в растворе. Разработан в 1949 году Горналлом, Бардавиллом и Дэвидом, ныне мало используется в биохимической лабораторной практике (за исключением… … Википедия
Лаури метод — (О. Н. Lowry, род. в 1910 г., амер. фармаколог; син. Лоури метод нрк) метод количественного определения белка, основанный на измерении концентрации окрашенных продуктов, образующихся в результате сочетания двух химических реакций: биуретовой… … Большой медицинский словарь
Белки — У этого термина существуют и другие значения, см. Белки (значения). Белки (протеины, полипептиды[1]) высокомолекулярные органические вещества, состоящие из соединённых в цепочку пептидной связью альфа аминокислот. В живых организмах… … Википедия
Протеин — Кристаллы различных белков, выращенные на космической станции «Мир» и во время полётов шаттлов НАСА. Высокоочищенные белки при низкой температуре образуют кристаллы, которые используют для получения модели данного белка. Белки (протеины,… … Википедия
Протеины — Кристаллы различных белков, выращенные на космической станции «Мир» и во время полётов шаттлов НАСА. Высокоочищенные белки при низкой температуре образуют кристаллы, которые используют для получения модели данного белка. Белки (протеины,… … Википедия
Смит, Уилл — В Википедии есть статьи о других людях с такой фамилией, см. Смит. Уилл Смит Will Smith … Википедия
Will Smith — Уилл Смит Will Smith Имя при рождении: Уиллард Кристофер Смит младший Дата рождения: 25 сентября 1968 (40 лет) … Википедия
Проба Реберга
Проба Реберга – это изучение урины пациента, в результате которого определяется качество работы почек. Процедура позволяет выявить фильтрационную скорость клубочков, оценить выделительные свойства органа мочеобразования.
Показания к сдаче
Сдавать пробу Реберга необходимо для выявления нарушений в работе мочевыделительной системы и обнаружения хронических патологий.
Проведение анализа показано при наличии косвенных негативных симптомов, связанных с работой почек:
Подобная симптоматика также во многом присуща последним срокам беременности, несахарному диабету, различным типам нефрита. В случае снижения клубочковой фильтрации до минимальных отметок рекомендуется повторное исследование с применением дополнительных диагностических методик.
Эффективность методики
С помощью пробы Реберга можно своевременно выявить следующие патологии:
Подготовительный этап
Перед сдачей урины доктор обязан подробно рассказать пациенту о необходимых подготовительных манипуляциях. Это важный момент, поскольку в случае неправильной подготовки результаты исследования будут искажены.
За 24 часа до процедуры и непосредственно в день сбора урины следует выполнять такой краткий список действий:
Перед сбором биоматериала не рекомендовано использовать ряд медикаментозных препаратов:
Эти препараты искажают итоговые результаты. Если отмена назначенных лекарственных средств не представляется возможной, то об этом следует сообщить доктору, чтобы он имел возможность скорректировать расшифровку результатов.
Перед забором урины обязательно следует подмывать половые органы. Запрещено проводить сдачу анализа женщинам во время менструации.
Как проводится обследование
Чтобы правильно собрать мочу для пробы Реберга, необходимо следовать такому алгоритму:
Процедура должна проводиться с семи до десяти утра. Ёмкость с образцом мочи должна сохраняться в прохладном месте, иначе биоматериал испортится. Чтобы отследить особенности изменения количества креатинина, проводится повторная проба.
При поэтапном правильном выполнении сбора мочи есть гарантия на получение правильного результата.
Касательно того, сколько будет стоить анализ, то здесь всё зависит от клиники. Средняя стоимость процедуры по Москве составляет 350 рублей.
Параллельно с забором урины рекомендуется сдать кровь из вены. Результаты этих анализов позволяют более детально разобраться в присутствующей у человека патологии.
Расшифровка результатов
Оценку результатов обязан проводить профессиональный уролог, поскольку расшифровка анализа урины ещё не указывает на присутствие конкретного заболевания. Клиренс креатинина отмечает присутствие нарушений в функционировании почечной и эндокринной систем. И только опытный врач в состоянии сопоставить рассчитанный результат после сдачи пробы с определенными клиническими проявлениями.
Нормальными показателями признаются следующие вычисленные значения клиренса креатинина (по установленному нормативу измерение производится в мл/мин).
От 12 месяцев до 30 лет
Если итоговый результат не попадает в рамки нормальных значений, то это вовсе не значит, что у человека присутствует болезнь. Прием лекарственных средств, рацион, включающий чрезмерное содержание мясных блюд, чрезмерные физические нагрузки – все это пример факторов, которые вызывают искажение результатов. Даже такой естественный процесс, как беременность, провоцирует искажения.
Если процент креатинина в биоматериале повышен, то это считается признаком таких заболеваний, как артериальная гипертония, нефротический синдром, диабет.

Различного рода отклонения от нормы напрямую указывают на наличие миеломы или гипофункциональности коры надпочечников. Поскольку несоответствие уровня креатинина нормативу указывает на массу различных патологий, расшифровкой результатов в обязательном порядке должен заниматься специалист, следуя установленной формуле расчетов.
Проба Реберга – это способ в короткие сроки получить информацию о качестве функционирования фильтрационных клубочков и как следствие, выявить присутствующие патологии. Сегодня это лабораторное исследование занимает лидирующее положение среди других аналогичных анализов, что объясняется относительно быстрыми сроками получения результатов.
Отмечено, что в случае наличия подозрений на почечную недостаточность, доктор не имеет права подбирать схему лечения без проведения пробы Реберга. Только имея на руках результаты сданных анализов, и изучив уровень отклонения присутствующих показателей от нормы, доктор ставит диагноз и подбирает оптимальные лекарственные средства и при необходимости отправляет пациента в стационар.
Использование метода Лоури для количественного определения белка в альбумине
Рубрика: 11. Прочие отрасли медицины и здравоохранения
Статья просмотрена: 6466 раз
Библиографическое описание:
Евсельева, Е. А. Использование метода Лоури для количественного определения белка в альбумине / Е. А. Евсельева, Е. В. Симонян, Н. А. Шумакова. — Текст : непосредственный // Медицина: вызовы сегодняшнего дня : материалы I Междунар. науч. конф. (г. Челябинск, июнь 2012 г.). — Челябинск : Два комсомольца, 2012. — С. 90-92. — URL: https://moluch.ru/conf/med/archive/52/2379/ (дата обращения: 18.12.2021).
Введение. Альбумин – природный белок, составная часть фракции крови человека, в состав которого входят все 20 незаменимых аминокислот. Растворы альбумина являются эффективным средством коррекции гипоальбуминемии различного генеза, восстановления коллоидно – онкотического давления, нарушенной центральной и периферической гемодинамики, а также как средство дезинтоксикационной терапии при дегидратации и «сгущении» крови.
Метод Лоури обладает высокой чувствительностью (10-60 мг/л), но интенсивность окраски пропорциональна не концентрации общего белка, а количеству тирозина и триптофана. Содержание этих аминокислот в различных белках различно. Так, в альбуминах и γ-глобулинах оно различается более чем на 20%. Поэтому метод Лоури широкого применения в медико-биологической практике не нашел, хотя при определении концентрации индивидуальных белков он – один из лучших.
Целью настоящего исследования является разработка способа количественного определения белка методом Лоури и валидационная оценка метода.
Объектом исследования был раствор альбумина 10%, производимый на Челябинской станции переливания крови [2]. В качестве стандартного образца использовали стандартный образец предприятия (СОП) альбумина с концентрацией 9,98%. Содержание белка в СОПе определяли по эталону методом Къельдаля. (Эталон стандартизирован и предоставлен Центральной лабораторией государственного контроля и изучения качества препаратов крови, кровезаменителей и консервирующих растворов).
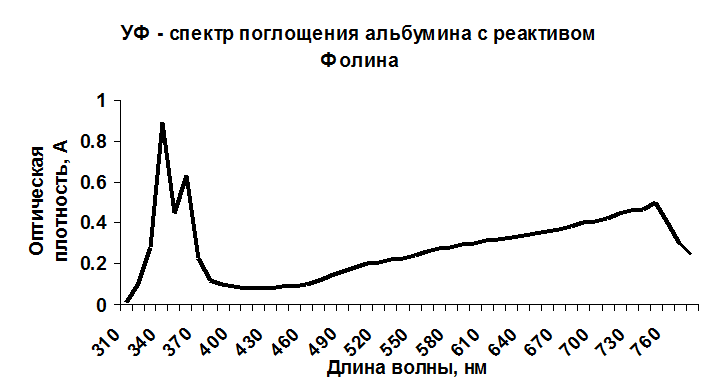
Определение проводили по методике ГФ XII издания без предварительного осаждения белка [3]. Было установлено, что продукт взаимодействия альбумина с реактивом Фолина характеризуется максимумами светопоглощения при 330±2, 345±2 и 750±2 нм (рис. 1).
При построении калибровочных графиков использовали раствор стандартного образца. Для этого в мерную колбу вместимостью 25 мл вносили, соответственно, 0,1, 0,2, 0,3, 0,4 … 1 мл раствора СОП альбумина, прибавляли по 5 мл реактива Фолина, доводили водой до метки, выдерживали 30 минут и измеряли оптическую плотность полученных растворов в максимумах светопоглощения. Было установлено, что в интервале концентраций 0,04 – 0,2% наблюдается линейная зависимость в максимумах светопоглощения при 345±2 и 750±2 нм.
Критерием приемлемости линейности является коэффициент корреляции, величина которого должна быть не ниже 0,99. Полученные данные полностью соответствуют данному критерию. Было установлено, что значения коэффициента корреляции наиболее достоверно при использовании в качестве аналитической длины волны 750 нм ( R 2 = 0,9921). Расчет количественного содержания белка и валидационную оценку метода проводили по стандартному образцу [1]. Результаты представлены в таблице 1.
Проба лоури для чего
Лабораторная работа №7
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ СОДЕРЖАНИЯ БЕЛКА МЕТОДОМ ЛОУРИ
Принцип метод. Метод основан на образовании окрашенных продуктов ароматических аминокислот с реактивом Фолина в сочетании с биуретовой реакцией на пептидные связи. Метод характеризуется высокой чувствительностью (10 — 100 мкг белка в пробе). Ha развитие окраски влияет большое количество веществ: компоненты буферных систем (трис-буфер в концентрации0,2 мМ, глицилглицин), восстановители (цистеин, дитиотреитол в концентрации 0,01 —0,4 мМ, аскорбиновая кислота), комплексоны (ЭДТА в концентрации0,5 мМ), детергенты (тритон X100 в концентрации 0,1 — 0,2 % вызывает выпадение осадка), сернокислый аммоний в концентрации 0,15 %, сахароза в концентрации 10 % и др. В связи с этим при построении калибровочного графика для определения белка по методу Лоури в растворитель для стандартного белка необходимо включать все компоненты, содержащиеся в анализируемых пробах. B некоторых случаях целесообразно предварительное осаждение белков из растворов, например трихлоруксусной кислотой, с последующим растворением их в щелочных растворах, или очистка белковых растворов от низкомолекуляриых компонентов путем диализа или гель-фильтрации на сефадексе G-25.
Интенсивность окраски комплекса, которая пропорциональна количеству белка в исследуемой пробе, измеряется спектрофотометрически.
Для исключения случайных ошибок, которые могут возникать в процессе измерения, рекомендуется не ограничиваться одним измерением (готовят 2 ряда пробирок)
При определении концентрации вещества в растворе следует соблюдать следующую последовательность в работе:
а) построение калибровочной кривой для данного вещества;
б) измерение оптической плотности исследуемого раствора и определение концентрации вещества в растворе по калибровочной кривой.
Реактивы:
Реактив №1: 2 %-й раствор Na2CO3 в 0,1 н. растворе NaOH.
Реактив №2: 0,5 %-й раствор CuSO4 * 5H2O в 1%-м цитрате натрия.
Реактив №3 готовится непосредственно перед работой: 15 мл реактива I + 0,3 мл реактива №2.
Реактив №4 Реактив Фолина — Чокальтеу: 10 гNa2Wo4*2H2O (перекристаллизованный) и 2,5 г Na2MoO4*2H20 помещают в круглодонную колбу на 200 — 250 мл, приливают 70 мл воды и хорошо перемешивают. K полученному раствору добавляют 5 мл 85 %-го раствора фосфорной кислоты и 10 мл концентрированной HCl (x.ч.). Колбу присоединяют к обратному холодильнику (на шлифе), ставят на сетку и кипятят в течение 10 ч. Затем в раствор добавляют 15 г Li2SO4, 5 мл воды и одну каплю брома. Раствор перемешивают и нагревают для удаления брома. После охлаждения доводят водой до 100 мл, фильтруют и разводят водой с таким расчетом, чтобы получился 1 н раствор кислоты (т.е. приблизительно вдвое). Кислотность определяют титрованием разведенного в 10 раз реактива 0,1 н. щелочью в присутствии фенолфталеина. Реактив может храниться в темной склянке длительное время.
Реактив №5: стандартный раствор белка, содержащий 0,25 мг в 1 мл раствора.
Реактив №6: раствор белка концентрации Х.
Оборудование: пробирки; кюветы, спектрофотометр.
Ход работы
Используя стандартный раствор белка и дистиллированную воду в 4 пробирках готовят растворы белка различной концентрации. Пятая проба не содержит белка и служит контролем на реактивы. В шестую пробирку помещают 0,4 мл р-ра белка неизвестной концентрации-Х (см. таблицу).
Объем стандартного раствора белка, мл
Объем дистиллированной воды, мл
Во все пробирки добавляем по 2 мл реактива №3, смесь тщательно перемешивают. Через 10 мин добавляют 0,2 мл реактива №4 Фолина — Чокальтеу. Реакционную смесь перемешивают и оставляют при комнатной температуре на 30 мин.
Интенсивность развившейся окраски измеряют спектрофотометрически (при длине волны 750 или 500 нм) Построение калибровочной кривой производят следующим образом. Измеряют оптические плотности каждого из этих растворов и строят график (калибровочную кривую), откладывая по горизонтальной оси (ось абсцисс) известные концентрации, а по вертикальной оси (ось ординат) —соответствующие им значения оптической плотности.
Пользуясь калибровочной кривой, определяют неизвестную концентрацию белка в исследуемом растворе, соответствующую измеренному значению оптической плотности.
B случае предварительного осаждения белка к исследуемому раствору добавляют CCl3COOH из такого расчета, чтобы конечная концентрация ее была равна 3 — 4 %. Раствор тщательно перемешивают и оставляют на 10—20 мин. Выпавший осадок белка отделяют центрифугированием и промывают 2%-ным раствором CCl3COOH. K осадку добавляют 1 — 2 мл 1 н. раствора щелочи и осторожно подогревают до растворения осадка белка. Раствор белка количественно переносят в мерную колбу на 25 — 50 мл, доводят водой до метки, тщательно перемешивают и проводят определение белка.
Спектрофотометрический метод
Метод основан на способности ароматических аминокислот (триптофана, тирозина и в меньшей степени фенилаланина) поглощать ультрафиолетовый свет с максимумом при 280 нм. Измеряя величину оптической плотности при этой длине волны, находят количество белка в растворе. Поскольку белки отличаются по содержанию ароматических аминокислот, их поглощение в ультрафиолетовой области спектра может сильно различаться. Условно считают, что при концентрации «усредненного» белка в растворе, равной 1 мг/мл, величина оптической плотности при 280 нм равна 1,0 (при толщине слоя жидкости в1 см).
Определению белка данным методом мешает присутствие нуклеиновых кислот и нуклеотидов.
Реактивы: растворы сывороточного альбумина, яичного альбумина концентрация белка 1 мг/мл.
Оборудование: пробирки; кюветы, спектрофотометр.
Ход работы
Измеряя оптическую плотность раствора при 260 нм (для учета поглощения соединений нуклеотидной природы) и 280 нм (в качестве кюветы сравнения используют кювету с дистиллированной водой), содержание белка рассчитывают с помощью номограммы: экспериментально полученные величины оптической плотности при 260 и 280 нм находят в соответствующих столбцах номограммы и соединяют их прямой линией; точка пересечения этой прямой со шкалой, на которой дана концентрация белка, определяет содержание белка в исследуемом растворе.
Содержание белка можно найти по формуле Калькара на основе данных определения оптической плотности при 280 и 260 нм:
Содержание белка =1,45 •λ 280—0,74 • λ 260 (мг/мл).
ЛАУРИ МЕТОД
ЛАУРИ МЕТОД (О. H. Lowry, амер. фармаколог, род. в 1910 г.) — метод количественного определения белка в растворах и биологических жидкостях; находит широкое применение благодаря более высокой чувствительности по сравнению с другими методами количественного определения белка. Л. м. в 10—20 раз чувствительнее метода определения белка по измерению его оптической плотности при 280 нм и в 100 раз чувствительнее биуретовой реакции (см.). Метод является общепризнанным и применяется во всех биохим, и клинико-биохим. лабораториях для определения концентрации отдельных белков, а также для контрольного анализа элюатов, содержащих смесь различных белков, при колоночной хроматографии.
Л. м. впервые был предложен Лаури и соавторами в 1951 г., с тех пор описано несколько его модификаций.
Метод основан на образовании окрашенных продуктов в результате сочетания двух реакций: биуретовой реакции на пептидную связь и реакции взаимодействия реактива Фолина—Чокалтеу с ароматическими аминокислотами, входящими в состав молекул белков (см.). Механизм образования таких окрашенных продуктов стал известен лишь к 1960 г. В ходе биуретовой реакции ионы меди и пептидные связи молекулы белка образуют внутрикомплексные соединения. Образование таких соединений облегчает транспорт электронов от наиболее хромогенных группировок молекулы белка (дипептидов, содержащих гистидин, аргинин и глутаминовую к-ту) к реактиву Фолина—Чокалтеу, в результате чего происходит восстановление этого реактива с образованием голубой окраски различных оттенков. При определении белка по Л. м. используют следующие реактивы:
A) 2 % р-р Na2CO3 в 0,1 н. р-ре NaOH;
Б) 0,5% р-р CuSO4-5H2O в 1% р-ре лимоннокислого или виннокислого натрия;
B) смесь 1 мл реактива Б с 50 мл реактива А; реактив Фолина—Чокалтеу: 20 г вольфрамовокислого натрия (Na2WO4-2H2O), 5 г молибденовокислого натрия (Na2MoO4•2H2O) растворяют в 140 мл воды, добавляют 10 мл 80% фосфорной к-ты и 20 мл концентрированной соляной к-ты. Смесь кипятят с обратным холодильником в течение 10 час., затем добавляют 30 г сернокислого лития, 10 мл воды и несколько капель брома. Общий объем смеси доводят водой до 200 мл и фильтруют. Реактив хранят в темной склянке;
Г) готовят непосредственно перед употреблением разбавлением реактива Фолина — Чокалтеу водой до конечной концентрации к-ты 1 н.
Ход определения: 0,4 мл белкового р-ра, содержащего от 5 до 40 мкг белка, смешивают с 2 мл свежеприготовленного реактива В и смесь оставляют стоять при комнатной температуре. Через 10 мин. к полученной смеси быстро добавляют 0,2 мл реактива Г и тщательно перемешивают пробу. Спустя 30—40 мин. измеряют величину экстинкции при 750 нм. Интенсивность развивающегося окрашивания не строго пропорциональна содержанию белка в пробе, в том случае если оно превышает 40 мкг. Поэтому рекомендуется строить калибровочную кривую в пределах от 5 до 40 мкг белка. Необходимо принимать во внимание, что разные белки дают разное окрашивание не только по интенсивности, но и по оттенку, поэтому калибровочную кривую надо строить по возможности с тем белком, содержание к-рого будет определяться в дальнейшем.
Нек-рым недостатком метода является трудоемкость приготовления реактива Фолина—Чокалтеу.
Библиография: Авдеев В.Г. Методы определения концентрации белка, Вопр. мед. хим., т. 23, № 4, с. 562, 1977, библиогр.; Бейер E. М. Некоторые данные о применимости метода Лоури в зависимости от различных условий определения белка, Лаборат, дело, № 10, с. 590, 1976: Lowry О. Н. а. о. Protein measurement with the folin reagent, J. biol. Chem., v. 193, p. 265, 1951.