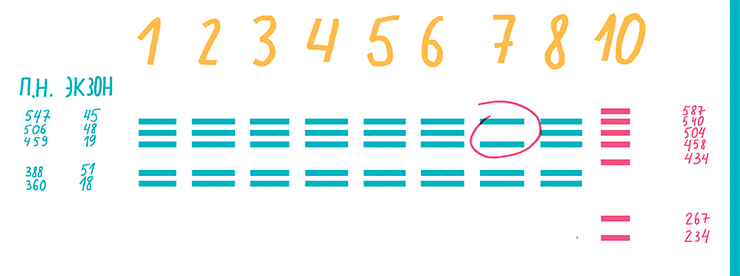Праймер днк для чего нужен
Что такое полимеразная цепная реакция и как она работает?
ДНК (дезоксирибонуклеиновая кислота) составляет основу бесчисленных исследований с участием живых организмов. Из кода ДНК мы можем определить генетическую основу заболеваний, разработать лекарства, провести судебно-медицинскую экспертизу, идентифицировать микробы и многое другое.
Самое главное, что нужно для такого исследования, — это большое количество исследуемого фрагмента ДНК. Однако ДНК, выделенной из клеток, тканей или любого другого биологического источника, часто бывает недостаточно для анализа. Таким образом, ученым нужно делать больше копий ДНК.
Именно здесь и проявляется решающая роль «полимеразной цепной реакции».
Что такое полимеразная цепная реакция?
ПЦР использует способность ферментов полимеразы создавать копии генетического материала в лабораторных условиях.
До появления ПЦР копии ДНК создавались путем выделения определенного фрагмента ДНК и вставки его в геном живых клеток. Живые клетки реплицировали вставленную ДНК, одновременно реплицируя свою собственную ДНК. Этот метод был трудоемким и длительным способом получения копий ДНК, достаточных для дальнейшего изучения.
Однако теперь это уже не так. Основная заслуга в этом принадлежит Кэри Маллису, который в 1983 году изобрел «полимеразную цепную реакцию» (ПЦР), положив начало «биотехнологической революции». Сегодня ПЦР является очень распространенной лабораторной техникой даже в небольших лабораториях и используется для создания копий ДНК на регулярной основе.
ПЦР может избирательно создавать копии интересующей ДНК посредством процесса, часто называемого «молекулярным фотокопированием». После синтеза нескольких копий ДНК с помощью ПЦР ДНК подвергается «амплификации».
Каковы компоненты реакции ПЦР?
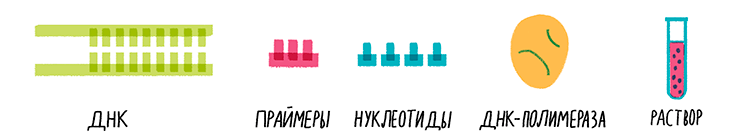
Ключевыми компонентами реакции ПЦР являются матричная ДНК, праймеры, нуклеотиды и термостойкая ДНК-полимераза. Давайте кратко узнаем о каждом из этих компонентов.
Для ПЦР можно использовать ДНК от простейших бактерий до самых сложных животных и растений. Однако вся ДНК (шаблонная ДНК) не проходит ПЦР; в ходе процесса будет амплифицирована только небольшая часть.
Нуклеотиды, используемые для реакции ПЦР, представляют собой смесь всех четырех азотистых оснований, обнаруженных в ДНК. Это аденин (A), тимин (T), гуанин (G) и цитозин (C).
ДНК-полимераза, используемая в ПЦР, представляет собой термостабильную ДНК-полимеразу (часто называемую полимеразой Taq), выделенную из термофильных организмов, способных выдерживать высокие температуры.
Каковы этапы реакции ПЦР?
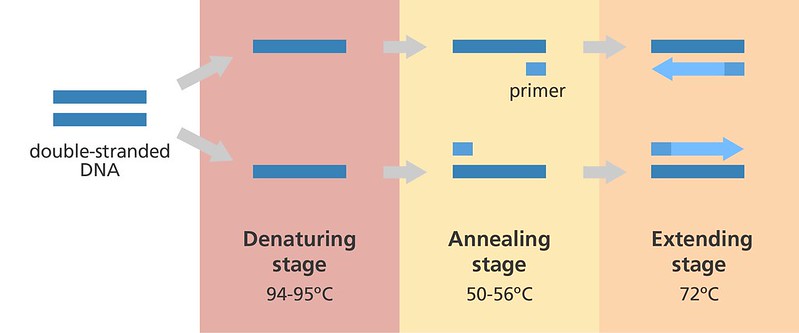
Активность полимеразы зависит от наличия одноцепочечной ДНК, с которой могут связываться праймеры. Этого можно добиться, нагрев образец ДНК при температуре 94-98 °C.
На следующем этапе праймеры связываются (отжигаются) с шаблонной ДНК в определенных местах. Прямой праймер связывается с началом шаблонной ДНК (одна нить двухцепочечной ДНК) на 3 п.н. нуклеотидной последовательности ATG (стартовый кодон). Обратный праймер связывается с концом комплементарной ДНК (второй нити двухцепочечной ДНК) на 3 п.н. нуклеотидных последовательностей TAG, TAA или TGA (стоп-кодоны). ДНК между стартовым и стоп-кодонами амплифицируется.
Успех этого этапа зависит от последовательности праймеров и температуры, выбранной для отжига, обычно 50-65 °C.
Последним и завершающим этапом является элонгация или терминация, которая происходит при 72 °C, оптимальной температуре для активности Taq-полимеразы. ДНК-полимераза распознает связанный с праймером участок ДНК и добавляет нуклеотиды, комплементарные нити шаблонной ДНК. Это происходит до тех пор, пока она не встретит второй праймер.
После успешной реакции терминации вместо одной спирали ДНК, использовавшейся на начальном этапе, образуются две спирали ДНК. В каждой из двух спиралей ДНК одна нить будет исходной нитью, полученной из образца ДНК. Другая нить будет комплементарной нитью, синтезированной ДНК-полимеразой в ходе ПЦР.
В чем заключается принцип амплификации ДНК с помощью ПЦР?
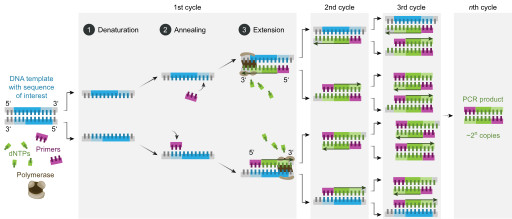
Этапы денатурации, отжига и полимеризации составляют один цикл ПЦР. Типичная реакция ПЦР может потребовать 25-35 циклов для оптимальной амплификации ДНК.
В конце одного цикла из одного шаблона ДНК образуются две молекулы ДНК. В конце двух циклов две ДНК образуют четыре молекулы ДНК, которые затем амплифицируются до восьми молекул ДНК в конце трех циклов. В конце n циклов будет 2n копий исходного шаблона ДНК.
После каждого цикла количество молекул ДНК, которые могут служить шаблонами для следующего цикла, увеличивается экспоненциально. Это увеличение числа шаблонов цикл за циклом является основой амплификации молекул ДНК в ПЦР.
Экспоненциальная амплификация молекул ДНК с помощью метода ПЦР
Каковы плюсы и минусы ПЦР?
Основные плюсы метода ПЦР заключаются в том, что он способен создавать миллионы и миллиарды копий ДНК всего за несколько часов. Этот метод быстр, относительно прост в освоении и может быть выполнен в базовых лабораторных условиях.
Основным недостатком является высокая чувствительность метода, поэтому образец, используемый для амплификации, должен быть свободен от загрязнений. Даже небольшие следы нежелательной ДНК могут амплифицироваться вместе с интересующей ДНК, что дает ложные результаты.
Другим недостатком является требование информации о последовательности ДНК для разработки праймеров. Кроме того, праймеры могут иногда отжигать не на тех участках ДНК. Такой неспецифический отжиг праймеров может привести к амплификации неправильного фрагмента ДНК.
В редких случаях ДНК-полимераза может включить неправильное основание, что приведет к изменению последовательности интересующей ДНК, что может повлиять на последующий процесс.
Для успешного проведения реакции ПЦР необходимо иметь чистый генетический материал, соответствующий набор праймеров и подходящую температуру отжига.
Где можно использовать эту технологию?
Он составляет основу большинства приложений, связанных с молекулярной биологией, клонированием генов, технологией рекомбинантной ДНК и мутагенезом.
Практическое развитие простой и универсальной техники ПЦР, предложенной Кэри Маллис, радикально изменило биологические исследования. Все, что нам нужно сделать, это смешать все компоненты ПЦР в соответствующих концентрациях в маленькой пробирке, загрузить ее в ПЦР-машину (термоциклер) и подождать несколько часов. После периода ожидания исследователи получат от миллионов до миллиарда копий интересующей вас ДНК. Разве это не удивительно?
Вот почему ПЦР всегда будет быстрым и надежным методом создания копий ДНК по сравнению с методами, использовавшимися до этого революционного открытия.
Полимеразная цепная реакция – руководство для начинающих
ПЦР — это метод современных лабораторий молекулярной биологии. Если вам нужно скопировать, упорядочить или количественно определить ДНК, вам необходимо знать ПЦР. Короче говоря, полимеразная цепная реакция — это биохимический метод, использующий термоциклирование и ферменты для быстрого и надежного копирования ДНК.
Эта статья дает краткий, базовый обзор ПЦР с несколькими советами, которые помогут вам избежать наиболее распространенных ошибок. Если вы новичок или имеете мало опыта в проведении ПЦР, то статья для вас. И даже если у вас есть опыт в ПЦР, стоит его немного освежить, и, возможно, получить один или два полезных совета.
Основные ингредиенты ПЦР:
Полимераза

Шаблон ДНК
Это ДНК, для которой вы разрабатываете свои праймеры. Это ДНК, которую ваша полимераза будет читать и копировать. Ваша шаблонная ДНК может быть геномной, плазмидной или кДНК. Чем более целостная и чистая ваша матричная ДНК, тем легче получить хорошие результаты ПЦР. Также имейте в виду, что идеальное количество ДНК будет зависеть от вашего источника, обычно 1 пг — 1 нг плазмидной ДНК или 1 нг — 1 мкг геномной ДНК на реакцию ПЦР.
Праймеры
Праймеры — это короткие фрагменты синтезированной ДНК, которые связываются с вашей шаблонной ДНК. Вам нужно будет разработать один «прямой» праймер и один «обратный». Прямой праймер обозначает начало вашей ПЦР. Последовательность этого праймера такая же, как у вашей ДНК-матрицы 5´-3´. Обратный праймер обозначает конец вашей ПЦР. Последовательность этого праймера является обратно комплементарной ДНК вашего шаблона. Обычно праймеры имеют длину 18-22 пары оснований. Однако важнее, чем их длина, является температура плавления ваших: она должна быть 54-60 ° С и максимально совпадать для обоих праймеров. Существует множество онлайн-калькуляторов, которые могут рассчитывать температуры отжига праймеров, и большинство компаний, которые синтезируют праймеры, предоставляют такие калькуляторы.
Нуклеотиды
Как мономеры ДНК, нуклеотиды необходимы для создания копий. В большинстве экспериментов вы будете использовать дезоксинуклеозидтрифосфаты (dNTP). Вы можете купить их отдельно или в виде смеси dGTP, dCTP, dATP и dTTP. Что бы вы ни покупали, имейте в виду, что нуклеотиды очень чувствительны к циклам замораживания и оттаивания. Поэтому лучше всегда создавать небольшие аликвоты ваших dNTP. Также убедитесь, что вы храните их правильно — не используйте морозильную камеру, которая проходит автоматические циклы размораживания.
Буфер
Большинство коммерческих полимераз поставляются с идеально подобранным буфером, который обеспечивает не только правильный рН, но и всегда содержит добавки, такие как магний, калий или ДМСО, которые помогают оптимизировать денатурирование, ренатурирование и полимеразную активность ДНК.
Термоциклирование

На этом этапе реакцию нагревают до 94-96°С в течение от 30 секунд до нескольких минут. Этот шаг обычно выполняется только один раз в самом начале реакции. Этот шаг важен для активации полимераз горячего старта, если вы используете такую полимеразу, и для денатурации вашей шаблонной ДНК.
На этом этапе смесь нагревают до 94-98°С в течение 15-30 секунд. Этот шаг денатурирует вашу ДНК и праймеры, что позволит им отжигать друг друга на следующем шаге.
На этом этапе температура вашей реакции быстро понижается до 50-64°C в течение 20-40 секунд. Температура на этом этапе должна быть достаточно низкой, чтобы ваши денатурированные праймеры могли образовывать пары оснований с вашей шаблонной ДНК. Но достаточно высокой, чтобы могли образовываться только самые стабильные (идеально спаренные) двухцепочечные структуры ДНК. Обычно эта идеальная температура отжига на несколько градусов ниже чем температура плавления вашей пары праймеров. Также на этом этапе ваша полимераза будет связываться с вашим комплексом ДНК праймер / матрица. Полимераза не начнет чтение, пока температура не повысится на следующем шаге.
На этом этапе реакционная смесь быстро нагревается до 72-80°C. В этот момент полимераза начинает чтение в направлении 5´-3´ и копировать ДНК шаблона в направлении 3´-5´. Более высокая температура на этом этапе уменьшает неспецифические взаимодействия ДНК праймера / матрицы, тем самым увеличивая специфичность реакции. Тем не менее, точная температура будет зависеть от предпочтения вашей полимеразы, поэтому перед экспериментом обязательно прочитайте инструкцию. Длина этого шага зависит от того, как долго будет длиться процесс копирования. Как правило, ДНК-полимераза может копировать 1000 пар оснований в минуту. Поэтому вам нужно выдержать смесь как минимум 1 минуту для копирования 1000 пар оснований. В конце инкубации будут созданы новые двухцепочечные фрагменты ДНК, состоящие как из матрицы, так и из новой ДНК.
Затем шаги 2-4 повторяют 15-40 раз
Чем больше циклов вы проведете, тем больше копий ДНК вы получите. Тем не менее, есть верхний предел. В какой-то момент доступные свободные нуклеотиды становятся ограничивающими, и преждевременно усеченные копии ДНК могут стать проблемой. Так что не жадничайте. Лучше получить меньше чистого продукта ПЦР, нежели большое количество сильно загрязненного.
Это необязательный, но часто рекомендуемый шаг. На этом этапе реакцию проводят при 70-74°С в течение нескольких минут. Обычно вы будете использовать ту же температуру, что и на шаге элонгации. Этот шаг позволяет полимеразам завершить считывание того участка, на котором они находятся в данный момент. Этот необязательный шаг может помочь уменьшить количество усеченных копий в конечном продукте.
Ваша реакция теперь завершена. Поскольку весь процесс может занять несколько часов, реакции ПЦР часто проводят в течение ночи. Рекомендуется запрограммировать ваш термоциклер на хранение продукта ПЦР при температуре 4°С до вашего возвращения. Советуем также прочесть статью о том, как провести ПЦР за 30 минут В это время вы можете проанализировать или использовать свой продукт, или перенести его в более подходящее долговременное хранилище, например, в холодильник.
Праймер (молекулярная биология)
Праймер — короткий фрагмент нуклеиновой кислоты или связана молекула, служит исходным пунктом репликации ДНК. Праймер нужен потому, что ни одна ДНК-полимераза (фермент, который катализирует репликацию ДНК) не может начать синтез новой молекулы ДНК с одноцепочечной матрице, поскольку нужна двухцепочечная участок для присоединения к ДНК, а также они способны только присоединять нуклеотид к уже имеющейся — ОН группы на 3 ‘конце другого нуклеотида.
Репликация ДНК
В естественной репликации ДНК, в качестве праймеров используются короткие цепочки РНК длиной около 12 нуклеотидов, синтезируются ферментомпраймазою. Праймазой может присоединять как рибонулеотиды, так и дезоксирибонуклеотидов, но синтезирует именно фрагмент РНК, поскольку рибонуклеотидов в ядре больше. Эти молекулы РНК позже изымаются и заменяются на ДНК ДНК-полимеразы.
Искусственные праймеры
Многие лабораторных методов биохимии и молекулярной биологии, привлекают использования ДНК-полимеразы, например секвенирования ДНК и полимеразная цепная реакция (ПЦР), требуют праймеров. Праймеры, используемые в этих методах, обычно короткие, химически синтезированные молекулы ДНК длиной 20-30 оснований.
Для ПЦР используют 2 праймеры, которые ограничивают с двух сторон последовательность, размножается. Для повышения специфичности реакции выбирают праймеры длиной 20-30 нуклеотидов, с содержанием Г-Ц пар около 50-60%. Г-Ц пары соединены между собой тремя водородными связями, поэтому они гарантируют лучший и более выборочный связь между праймером и матрицей. Для того, чтобы последовательность праймеров была уникальная и связывалась только с одной матрицей в смеси разных молекул ДНК (например, смесь всех ДНК человека), существуют специальные программы, которые с помощью баз последовательностей ДНК подбирают нужную последовательность нуклеотидов праймера.
Для клонирования последовательностей ДНК часто в последовательности праймеров вводят дополнительные нуклеотиды — сайты рестрикции, по которым режут ферменты рестриктазы. После приумножение нужного участка ДНК в ПЦР, полученные молекулы смешивают с ферментом, который разрезает их, образуя на концах так называемые «липкие концы». Такие конце позволяют легко вставить продукт ПЦР к искусственному ДНК-вектора.
12 методов в картинках: полимеразная цепная реакция
12 методов в картинках: полимеразная цепная реакция
Авторы
Редакторы
Полимеразная цепная реакция почти для каждого из нас стала обыденностью, даже если этот каждый никогда и слов таких не слышал. Медицинские центры наперебой предлагают диагностировать у вас все мыслимые болезни с помощью «ПЦР-анализа». Но задумывались ли вы о том, что это за анализ? как там всё работает? для чего еще применяют ПЦР? и есть ли какие-то альтернативные, менее дорогие, трудоёмкие и, может быть, более эффективные методы анализа? Нет? А мы вам всё равно об этом расскажем.
12 биологических методов в картинках
Генеральный партнер цикла — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Партнер этой статьи — Bio-Rad
Компания Bio-Rad Laboratories, Inc. USA («Био-Рад», США) является одним из мировых лидеров производства оборудования и реагентов для научных исследований. В рамках взаимодействия с научными, медицинскими, биотехнологическими и образовательными организациями «Био-Рад» предлагает современные технологии, оборудование и реагенты.
Одна из главных миссий «Биомолекулы» — докопаться до самых корней. Мы не просто рассказываем, какие новые факты обнаружили исследователи — мы говорим о том, как они их обнаружили, стараемся объяснить принципы биологических методик. Как вытащить ген из одного организма и вставить в другой? Как проследить в огромной клетке за судьбой нескольких крошечных молекул? Как возбудить одну крохотную группу нейронов в огромном мозге?
И вот мы решили рассказать о лабораторных методах более системно, собрать воедино в одной рубрике самые главные, самые современные биологические методики. Чтоб было интереснее и нагляднее, мы густо проиллюстрировали статьи и даже кое-где добавили анимации. Мы хотим, чтобы статьи новой рубрики были интересны и понятны даже случайному прохожему. И с другой стороны — чтобы они были так подробны, что даже профессионал мог бы обнаружить в них что-то новое. Мы собрали методики в 12 больших групп и собираемся сделать на их основе биометодический календарь. Ждите обновлений!
Полимеразная цепная реакция (ПЦР, PCR) — метод молекулярной биологии, позволяющий создать копии определенного фрагмента ДНК из исходного образца, повысив его содержание в пробе на несколько порядков.
Изобретение ПЦР полностью и безвозвратно изменило медицину, науку и нашу жизнь в целом. Появилась возможность быстро и эффективно диагностировать наследственные заболевания и инфекции, определять личность преступников по одному волоску и свободно манипулировать генами. Не будь этого уникального метода, человечество вряд ли оказалось бы на пороге эпохи генной терапии.
История метода
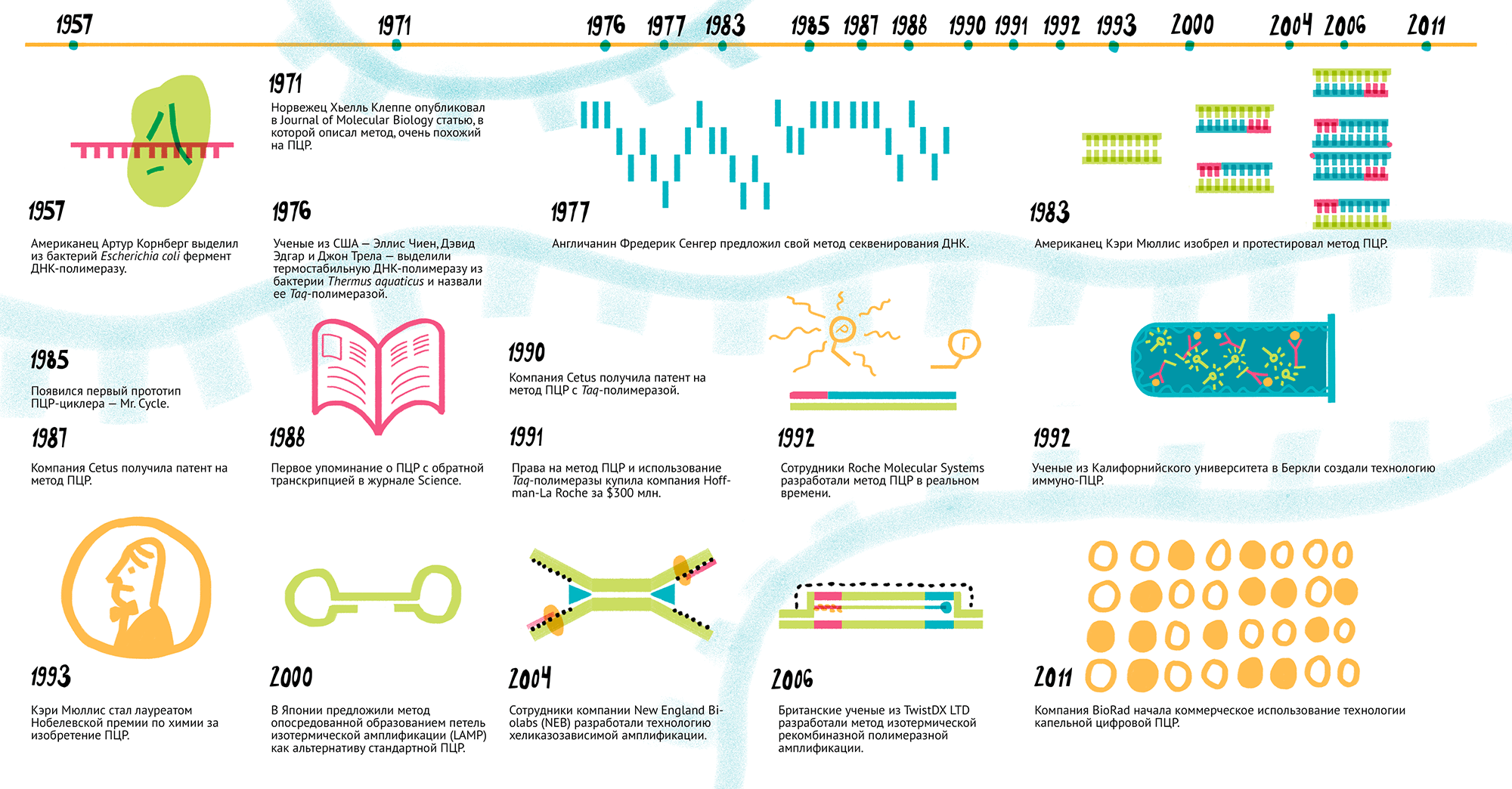
1957 г. Американец Артур Корнберг впервые выделил из бактерий Escherichia coli фермент, который назвал ДНК-полимеразой [1]. Статьи с описанием работы он отправил в Journal of Biological Chemistry, где их отвергли. из-за названия фермента: рецензенты считали, что нужно использовать более точный термин «полидезоксирибонуклеотидполимераза» и что вообще «ДНК» в названии указывает на «генетическую активность» (сущность, составляющую?) фермента, а раз ее нет, то и называть фермент так нельзя [2]. Однако в 1958 году в журнале сменился главный редактор, и статьи наконец увидели свет [3]. А уже в 1959 году Артура Корнберга удостоили Нобелевской премии по физиологии и медицине.
1971 г. Норвежский биохимик Хьелль Клеппе (рис. 2) опубликовал в Journal of Molecular Biology статью, в которой описал метод, очень похожий на ПЦР [4]. С 1968 по 1970 годы Клеппе работал постдоком в Университете Висконсина, в лаборатории Хара Гобинда Кораны — нобелевского лауреата 1968 года за расшифровку генетического кода. Именно в лаборатории знаменитого индийца чуть раньше разработали методики синтеза олигонуклеотидных праймеров — «затравок», необходимых для работы ДНК-полимеразы.
Рисунок 2. Хьелль Клеппе.
Статья, написанная Клеппе в соавторстве с Кораной и посвященная репарационной репликации с помощью ДНК-полимеразы, содержала такие строки: «Можно ожидать, что после охлаждения получатся две структуры, каждая из которых содержит полноразмерную матричную цепь, подобающим образом связанную с праймером. Для завершения процесса репаративной репликации нужно будет добавить ДНК-полимеразу. В результате получатся уже две молекулы исходного дуплекса. Цикл можно повторять, каждый раз добавляя свежую порцию фермента».
К сожалению, эта гипотеза так гипотезой и осталась. Может, Клеппе даже и проводил какие-то эксперименты, но результаты не публиковал.
1976 г. Ученые из США, Эллис Чиен, Дэвид Эдгар и Джон Трела, выделили термостабильную ДНК-полимеразу из бактерии Thermus aquaticus и назвали ее Taq-полимеразой [5]. Этот фермент сохранял активность даже при температурах выше 75 °С.
1977 г. Фредерик Сенгер, английский биохимик и лауреат Нобелевской премии 1958 года за работы по структуре белков [6], предложил метод секвенирования ДНК, сейчас известный как метод Сенгера [7], [8]. Этим он заработал еще одну нобелевскую медаль, в 1980-м, и стал единственным ученым в истории, получившим две «химических» премии [9].
1983 г. Руководитель лаборатории синтеза ДНК в Cetus Corporation (США) Кэри Мюллис (рис. 3) апрельской ночью ехал вдоль побережья из Сан-Франциско в Мендосино, в свой загородный дом. Долгой трехчасовой дорогой он обдумывал отнюдь не проведение выходных, а предстоящий эксперимент по секвенированию ДНК. И тут (по словам Мюллиса) его озарило: он ясно представил процесс амплификации (преумножения) генов, который позже получит название полимеразной цепной реакции.
До работы в Cetus Кэри Мюллис изучал химию в Технологическом институте Джорджии, затем биохимию в Калифорнийском университете в Беркли, а после работал постдоком в Калифорнийском университете Сан-Франциско по направлению «фармацевтическая химия». В 1979 году его пригласили в Cetus синтезировать праймеры для секвенирования, а уже через два года Мюллис возглавил лабораторию синтеза ДНК и автоматизировал производство олигонуклеотидов [10].
Рисунок 3. Кэри Мюллис.
В 1983 году Мюллис участвовал в проекте по изучению серповидноклеточной анемии. Чтобы проанализировать мутации, биологи проводили секвенирование по Сэнгеру, где используется один праймер для синтеза по одной из цепей ДНК. На серпантине по пути в Мендосино Мюллис предположил, что данные будут точнее, если использовать два праймера — для синтеза одновременно по двум цепям. Тогда можно будет сравнить получившиеся фрагменты и исключить неточности. И вот тут-то неожиданное прозрение заставило его вздрогнуть: если повторить цикл несколько раз, то можно получить множество копий нужного фрагмента строго определенной длины — она будет ограничена праймерами, от концов которых навстречу друг другу и будут строиться новые цепи ДНК [11]!
Вернувшись в понедельник в Cetus, Кэри Мюллис сразу направился в библиотеку, где попросил одного из сотрудников найти всю литературу о ДНК-полимеразе. В результате он не обнаружил ничего, касающегося амплификации. Это утверждение — самое слабое место во всей истории, так как в собранной библиотекарем стопке статей просто не могло не быть работы Хьелля Клеппе.
За следующие полгода Мюллис провел два эксперимента для проверки своей гипотезы, но безуспешно. Тогда он предположил, что отрицательный результат связан с большим размером ДНК-матрицы, используемой в опытах, и решил продолжить работу с маленьким вектором pBR322, в который вставил намножаемый ген. И 16 декабря 1983 года Мюллис впервые увидел вожделенные, хоть и слабые, полосы в геле для детекции. Однако другие сотрудники и руководство Cetus не разделили радости Мюллиса: их всё это попросту не интересовало [10].
1984 г. На ежегодной конференции корпорации Cetus в калифорнийском Монтерее Кэри Мюллис представил плакат, рассказывающий об амплификации гена β-глобина. К удивлению автора, и на этот раз его работу обошли вниманием [10].
Чуть позже Мюллису удалось кое-как убедить корпоративных боссов в важности его экспериментов: Cetus, как и многие начинающие компании, вкладывала ресурсы только в те проекты, что сулили прибыль в краткосрочной перспективе. Его освободили от обязанностей главы лаборатории и дали год на исследования ПЦР. И эти эксперименты завершились успешно [10].
1985 г. Мюллис и его группа разработчиков подали заявку на патент, который утвердили 28 июля 1987 года. В том же 1985-м в Cetus начали использовать для ПЦР термостабильную Taq-полимеразу, что значительно упростило работу: раньше перед каждым новым синтетическим циклом в смесь надо было добавлять новую порцию фермента, потому что он быстро выходил из строя от высоких температур. В декабре 1985 года журнал Science опубликовал первую статью Кэри Мюллиса о ПЦР [12].
Тогда же открылось совместное предприятие PerkinElmer Cetus Instruments (PECI), которое выпустило первый прототип ПЦР-циклера — Mr. Cycle (рис. 4). И только в 1987 году в продажу поступил первый общедоступный прибор, PCR-1000 Thermal Cycler.
Рисунок 4. Mr. Cycle — первый прототип ПЦР-амплификатора.
После ухода из Cetus он два года возглавлял молекулярно-биологический отдел в Xytronyx, а в 1992-м открыл компанию по продаже ювелирных изделий с амплифицированной ДНК знаменитостей — Элвиса Пресли, Мэрилин Монро и т.п. [14].
В 1993 году Кэри Мюллис стал лауреатом Нобелевской премии по химии за изобретение ПЦР. Его награждение — до сих пор больной вопрос для норвежского научного сообщества, где первооткрывателем метода считают Хьелля Клеппе.
Сейчас Мюллису 72 года, он работает научным сотрудником Научно-исследовательского института детской больницы Окленда и с 2011 года возглавляет предприятие Altermune LLC, занимающееся изучением иммунитета [14].
Кэри Мюллис нередко выступает на конференциях, рассказывает о своей жизни, работе и, конечно, своем открытии (см. видео 1). Он — прекрасный рассказчик, его всегда интересно слушать.
Видео 1. Выступление Кэри Мюллиса на конференции TED2002
В 1998 году вышла книга Кэри Мюллиса «Танец обнаженного разума» (Dancing naked in the mind field), где в обрамлении автобиографических историй ученый высказывает своё мнение о глобальном потеплении, СПИДе и других волнующих общество вопросах. Мюллис верит в астрологию и считает, что значительного изменения климата не происходит, между ВИЧ и СПИДом нет никакой связи, а все исследования, говорящие об обратном, — плоды заговора ученых-карьеристов с правительствами их стран.
1987 г. Компания Cetus подала патентную заявку на метод ПЦР с Taq-полимеразой, и ее одобрили в октябре 1990 года.
1989 г. Журнал Science объявил Taq-полимеразу молекулой года, а статья сотрудников Cetus о ПЦР с ее использованием [15] несколько лет поддерживала статус самой цитируемой биологической публикации [16].
В августе химический гигант DuPont подал против Cetus иск, в котором утверждал, что патенты на ПЦР получены неправомерно, поскольку этот процесс еще в 1970-х описал Хьелль Клеппе. В ответ на иск Ведомство по патентам и товарным знакам США (USPTO) решило переосвидетельствовать патенты. Но через год объявило, что они останутся действительными: комиссия нашла метод, описанный в работе Клеппе, слишком «неопределенным и сомнительным». К тому же там не упоминалась возможность экспоненциальной репликации — отличительной черты ПЦР. В суде представители DuPont так и не смогли доказать вторичность изобретения Мюллиса. 28 февраля 1991 года, после двух дней работы, суд вынес решение в пользу Cetus [10].
С тех пор Hoffman-La Roche и ее «дочка» Roche Molecular Systems развивают метод полимеразной цепной реакции: у них уже более 1000 связанных с ПЦР патентов и заявок.
Принцип метода
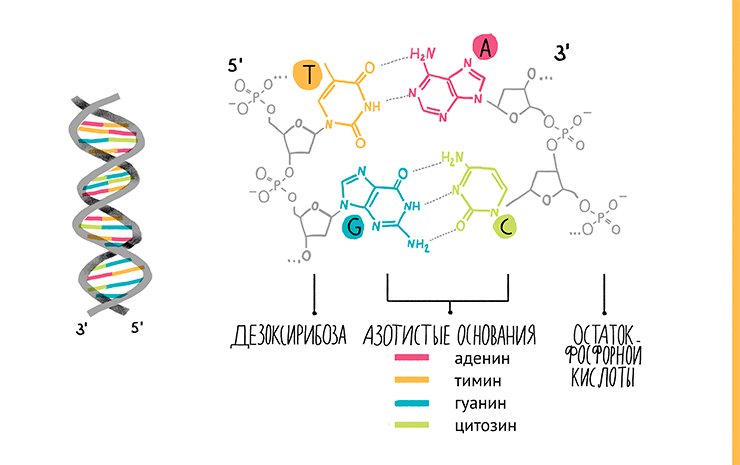
Все мы знаем, что ДНК — это двухцепочечная молекула, где каждая цепочка состоит из звеньев-нуклеотидов. Нуклеотиды составлены из трех молекул: остатка фосфорной кислоты, сахара и азотистого основания. Если сахар и фосфат одинаковы у всех нуклеотидов в ДНК (в РНК сахар другой), то азотистых оснований четыре (если не считать редкие модификации): аденин, тимин, цитозин и гуанин, обозначаемые А, Т, Ц и Г соответственно. В молекулах РНК тимин заменен урацилом. Нуклеотиды соединяются в цепочку, образуя связи между фосфатной группой одного нуклеотида и гидроксильной — другого. В результате на одном конце каждой цепи ДНК «висит» фосфатная группа (5ˊ-конец), а на другом — гидроксильная (3ˊ-конец). Две цепи нуклеотидов расположены в молекуле ДНК антипараллельно, то есть напротив 3ˊ-конца одной находится 5ˊ-конец другой. Чтобы молекула была стабильной, цепочки должны как-то взаимодействовать друг с другом. Это обеспечивают водородные связи, образующиеся между азотистыми основаниями противоположных цепей по принципу комплементарности: А соединяется только с Т (или У в РНК), а Г — с Ц (рис. 5, видео 2). И поэтому, имея одну цепь ДНК, в соответствии с этим правилом легко построить ее пару. Собственно, на этом и основана ПЦР.
Рисунок 5. Строение ДНК.
Видео 2. Строение ДНК.
Типичная реакционная смесь
Рисунок 6. Состав смеси для ПЦР.
Реагенты для ПЦР от «Диаэм»
Основная трудность при постановке ПЦР любой вариации — создать «правильный коктейль» из ингредиентов: выделенной ДНК, ферментов, трифосфатов и буфера в строго определенном оптимальном соотношении. Соблюдение правильного соотношения — большая проблема для лабораторий, где в сутки проводят несколько тысяч ПЦР: достаточно незначительно изменить концентрацию солей магния, и результаты ПЦР будут далеки от идеала.
Готовые смеси для ПЦР: «Экстрамиксы»
Чтобы упросить жизнь лаборантам, «Диаэм» выпускает готовые смеси — «Экстрамиксы» для ПЦР — как для классической вариации, так и для ПЦР с детекцией в режиме реального времени.
Материал предоставлен партнёром — компанией «Диаэм»
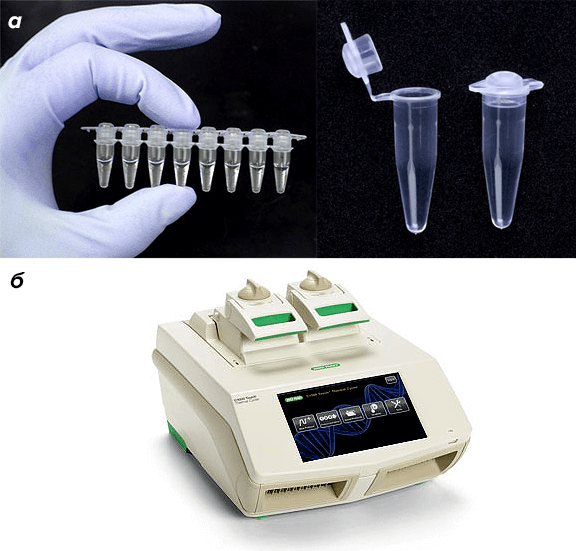
Все компоненты смешивают в нужном объеме деионизованной воды в специальных пробирках для ПЦР и помещают в амплификатор (или ПЦР-циклер) (рис. 7, видео 3).
Рисунок 7. Расходные материалы и оборудование для ПЦР. а — ПЦР-пробирки. б — Амплификатор C1000 Touch™ производства Bio-Rad.
Видео 3. Приготовление смеси для ПЦР.
Этапы реакции
Цель ПЦР — получить множество одинаковых двухцепочечных кусочков ДНК строго определенной длины (обычно не более 2–3 тысяч пар нуклеотидов, т.п.н.). Для этого проводят 20–30 циклов реакции. Каждый цикл состоит из трех этапов.
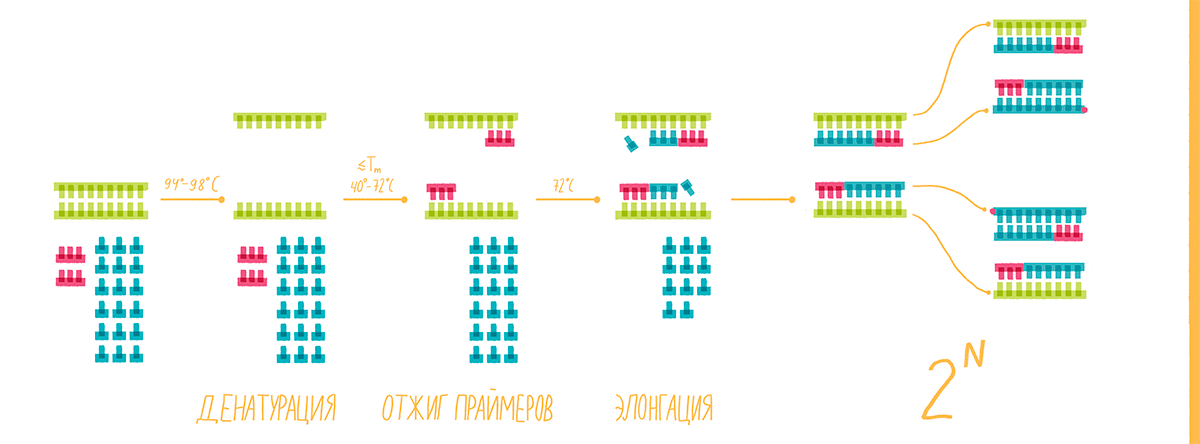
1. Денатурация
Чтобы полимераза могла работать, две цепи ДНК-матрицы нужно разъединить. Для этого реакционную смесь нагревают до 94–98 °С. В таких условиях разрушаются водородные связи между азотистыми основаниями параллельных цепей.
2. Отжиг праймеров
На этом этапе праймеры специфично присоединяются к освободившимся цепям ДНК-матрицы с разных сторон копируемого участка 3ˊ-концами друг к другу (рис. 8, видео 4). Чтобы праймеры могли комплементарно связаться (отжечься) только с нужными участками, при их конструировании необходимо учитывать такую важную характеристику, как температура плавления (Тm). Это расчетная температура, при которой половина праймеров присоединяется к целевому участку ДНК. Отжиг проводят при температуре на 1–5 °С ниже Tm, но не выше оптимальной температуры работы полимеразы, то есть в пределах 40–72 °С [17].
Рисунок 8. Полимеразная цепная реакция. На стадии денатурации цепи ДНК разъединяются, на следующем этапе (отжиг) к ним присоединяются праймеры, а далее полимераза начинает свою работу — синтез новых цепей ДНК (элонгация). И такой цикл повторяется многократно.
Чтобы увидеть рисунок в полном размере, нажмите на него.
Видео 4. Полимеразная цепная реакция.
В идеале праймеры должны соответствовать следующим критериям:
Еще лучше, если на 3ˊ-конце праймера будет гуанин или цитозин: они образуют с комплементарными основаниями три водородные связи (между А и Т образуются две), что делает комплекс праймер—матрица более стабильным.
В реальности редко получается соблюсти все условия из-за множества причин. Однако чем больше критериев соблюдено при создании праймеров, тем выше вероятность правильной их работы.
Чтобы разработать эффективные праймеры, необходимо знать последовательность ДНК у концов целевого участка, и, руководствуясь упомянутыми критериями, выбрать подходящие фрагменты, которым будут комплементарны будущие праймеры. Всё это удобно делать в специальных компьютерных программах — например, PrimerSelect: они и Тm рассчитают, и всякие спаривания изобразят, и вообще вынесут вердикт, удачная это пара праймеров или нет.
3. Элонгация, или синтез ДНК
Однажды ведущий ПЦР-специалист одного ветеринарного диагностического центра, показывая студентам постановку реакции, объяснила, что она потому называется полимеразной, потому что ее результаты наблюдают в полимерном геле. Возможно, есть и другие приверженцы этой гипотезы, однако сразу отметим, что она не верна. Полимеразная эта реакция от того, что в ее ходе фермент ДНК-полимераза последовательно выстраивает цепь ДНК (полимер) из нуклеотидов (мономеров), то есть полимеризует их. И делает она это на третьем этапе ПЦР.
Этот этап чаще проводят при температуре 72 °С — оптимальной для работы Taq-полимеразы. Фермент присоединяется к комплексам праймер—матрица и, выхватывая из раствора нуклеотиды, начинает по принципу комплементарности прилаживать их к 3ˊ-концу праймера (рис. 7). Удлинение, или элонгация, новой цепи ДНК идет с максимальной скоростью 50–60 нуклеотидов в секунду (то есть около 3000 в минуту). Однако при программировании ПЦР-циклера задают время с запасом: по минуте на каждую тысячу пар нуклеотидов.
Каждая вновь синтезированная цепочка ДНК становится, наравне со старой, матрицей для синтеза в следующем цикле. Таким образом, количество нужного продукта в процессе реакции возрастает экспоненциально. После прохождения всех циклов в реакционной смеси образуется столько специфических двухцепочечных продуктов, что их «массив» можно увидеть невооруженным глазом — проведя гель-электрофорез, о котором расскажем ниже.
К сожалению, экспоненциальная амплификация не может длиться вечно. Через 25–30 циклов количество функциональных молекул полимеразы в реакционной смеси истощается. Но чтобы добиться еще большего выхода продукта, содержимое пробирки можно разбавить, например, в 1000 раз и снова использовать для амплификации с уже новыми рабочими компонентами [18].
«Диаэм»: ДНК-амплификаторы на любой вкус
Амплификаторы нуклеиновых кислот с детекцией продуктов по конечной точке для качественной ПЦР и для наработки НК с целью последующего секвенирования: отечественные («ДНК-Технология») и зарубежные (Bio-Rad, Eppendorf, Thermo Fisher Scientific); с возможностью загрузки образцов как в индивидуальных пробирках и стрипах, так и в планшетах на 96 и 384 лунки; с возможностью установки температурного градиента и без; автономные и с подключением к ПК.
Материал предоставлен партнёром — компанией «Диаэм»
Визуализация продуктов ПЦР
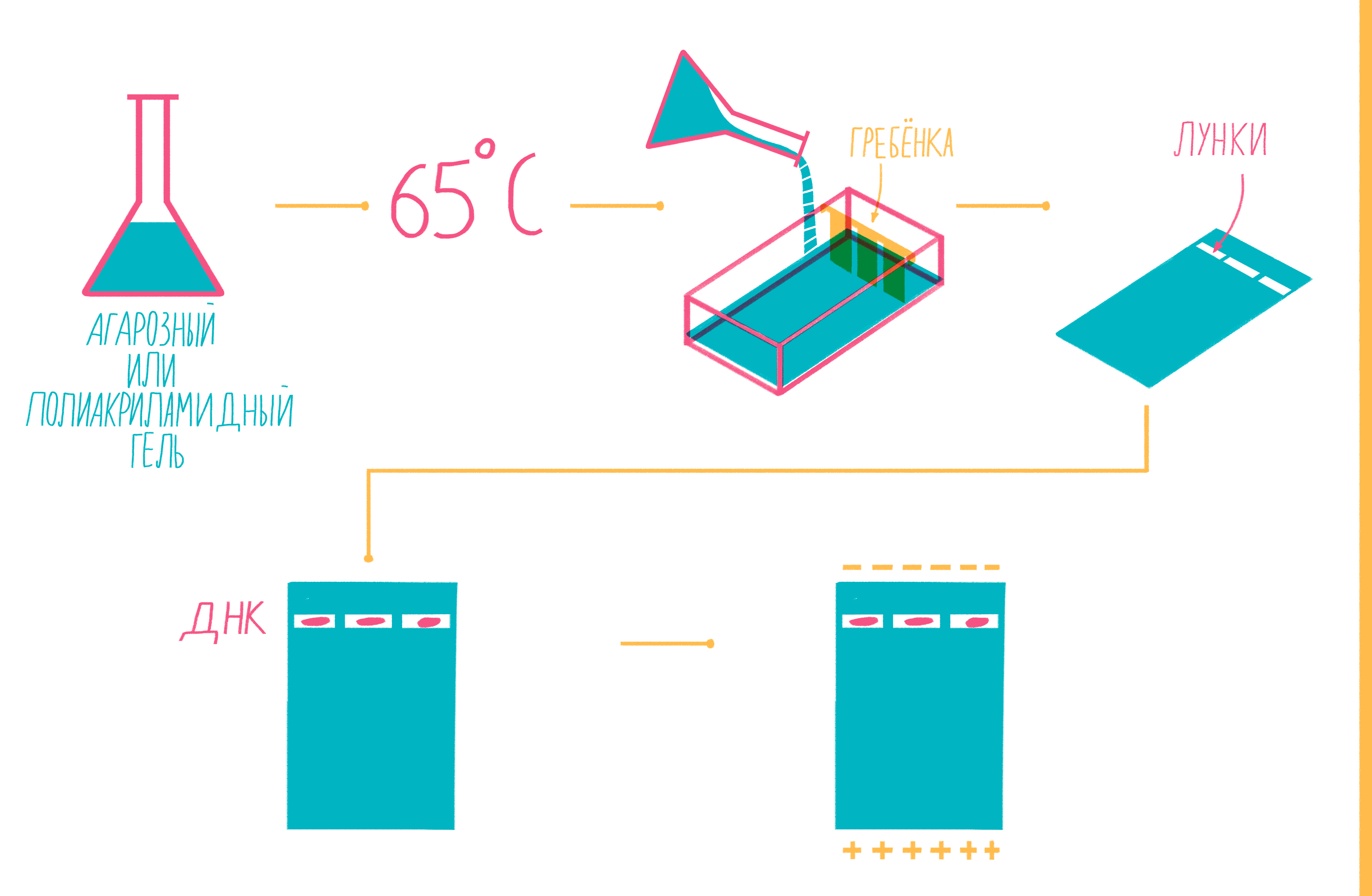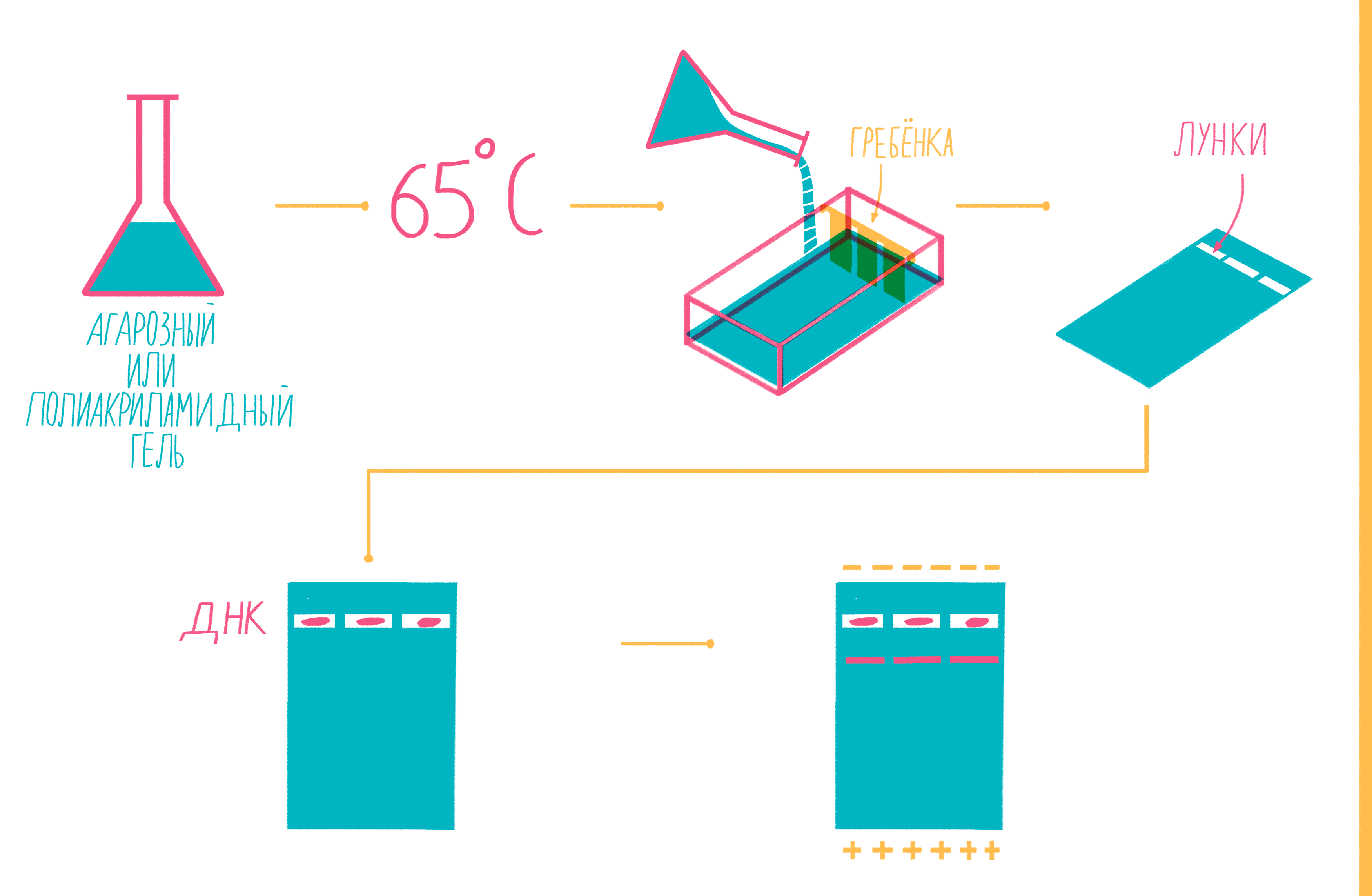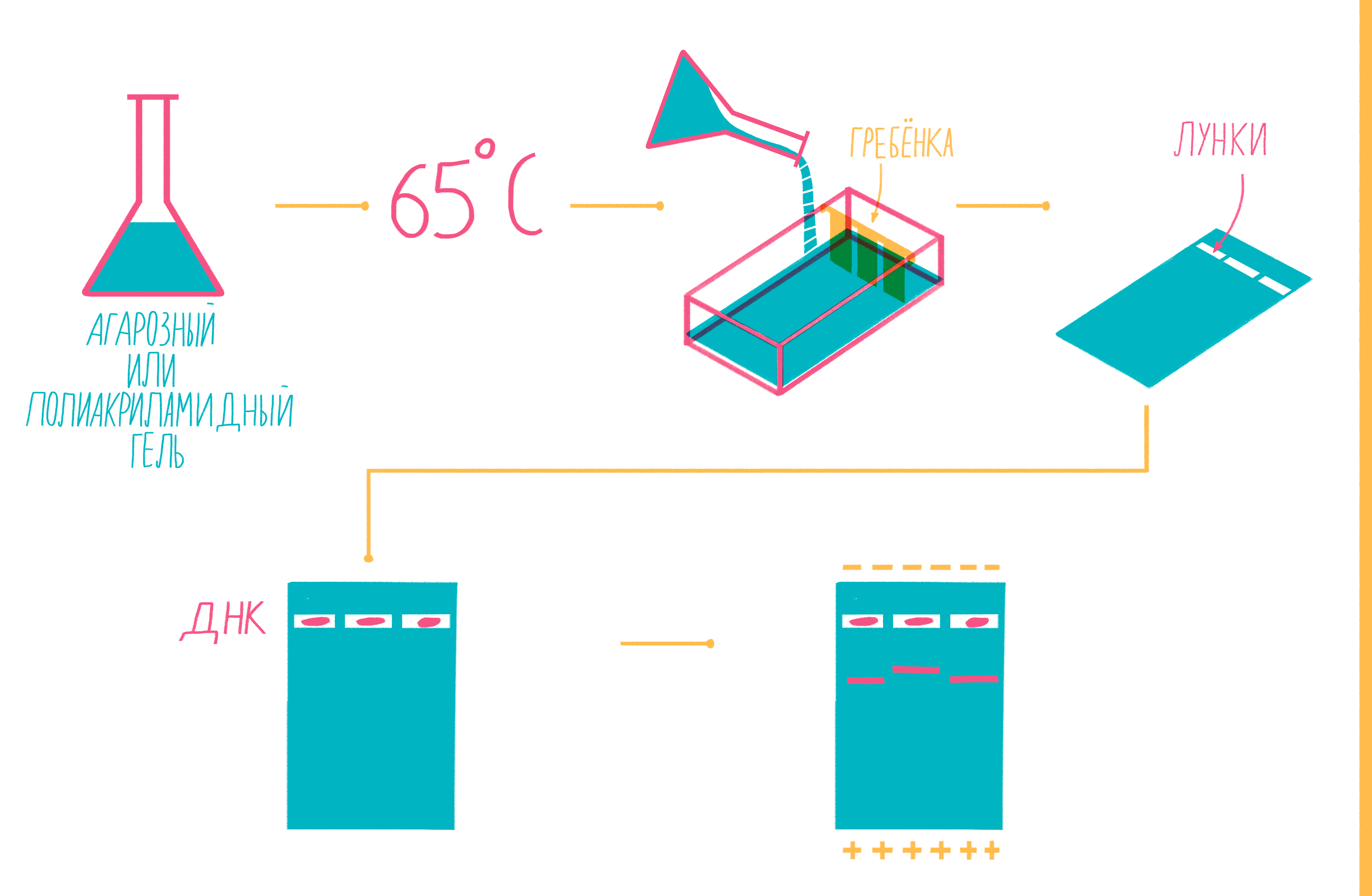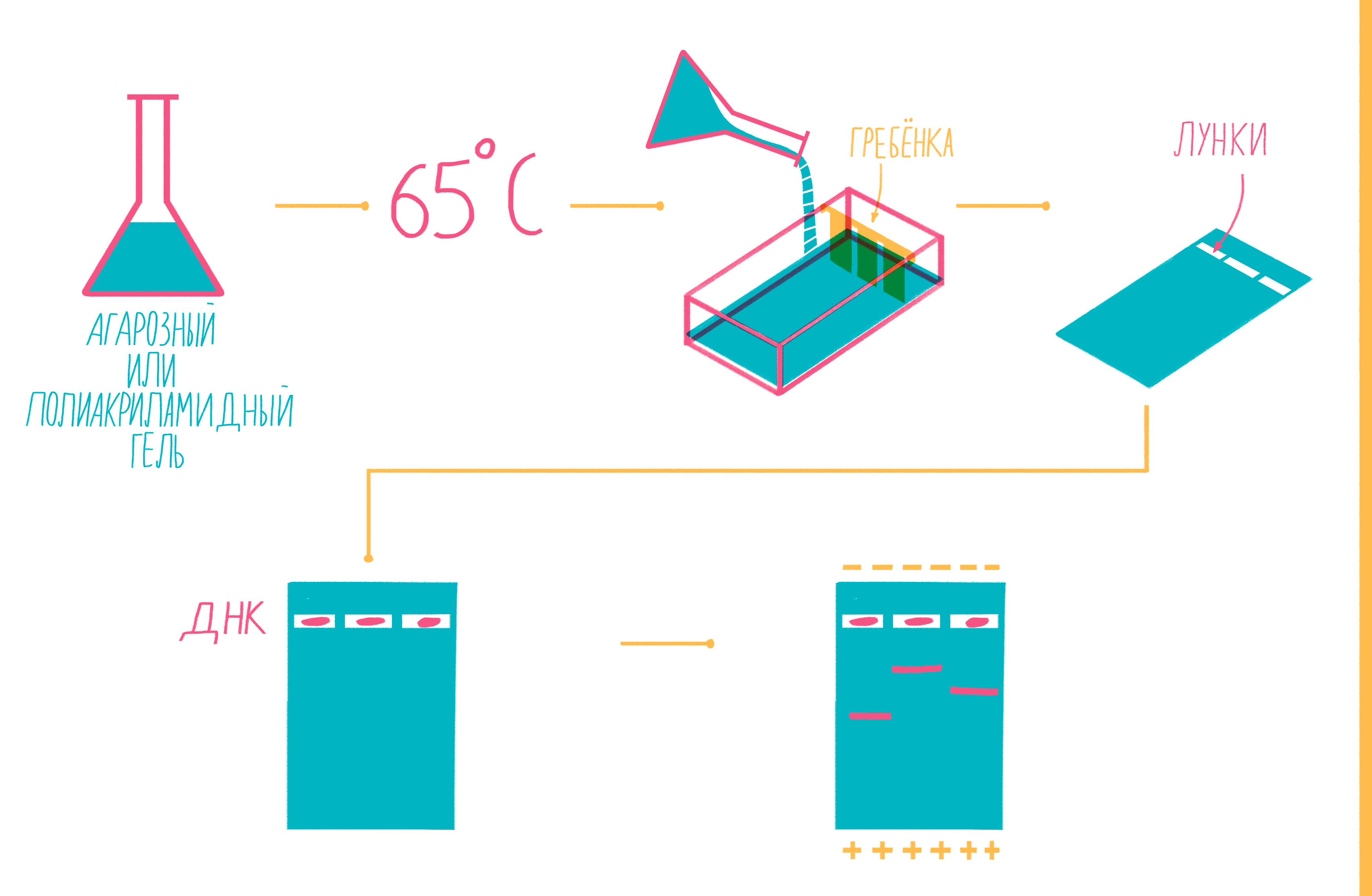
Чтобы увидеть, намножились ли нужные участки ДНК, после окончания ПЦР содержимое пробирок подвергают электрофорезу в агарозном или полиакриламидном геле с последующим окрашиванием — так молекулы ДНК разной длины разделяются пространственно и становятся видны невооруженным глазом [19]. Полиакриламидный гель намного плотнее, поэтому больше подходит для разделения очень коротких фрагментов (несколько десятков пар нуклеотидов), при этом можно увидеть разницу даже в один нуклеотид!
Расплавленный при 65 °С гель заливают в специальную форму (плашку) с установленной в ней гребенкой, формирующей лунки (рис. 9). Когда гель застывает, гребенку вынимают, ставят форму в камеру для электрофореза и заливают специальным буфером. Затем в лунки микропипеткой вносят раствор из ПЦР-пробирок, смешанный с краской — чаще бромфеноловым синим. Чтобы потом определять размеры амплифицированных фрагментов, в отдельную лунку вносят маркер молекулярных масс (ladder), содержащий набор кусочков ДНК известных размеров. Камеру подключают к источнику питания и наблюдают за бегущими от электродов волшебными пузырьками. Десятки минут или несколько часов, зависит от размера фрагментов ДНК, плотности геля и приложенного напряжения (видео 5).
Рисунок 9. Подготовка геля для горизонтального электрофореза.
Видео 5. Электрофорез в агарозном геле.
Благодаря отрицательно заряженному сахарофосфатному остову ДНК, фрагменты движутся в геле под действием электрического поля от отрицательного катода к положительному аноду. Более короткие молекулы делают это быстрее, чем длинные. Бромфеноловый синий нужен для того, чтобы следить за продвижением фронта проб в геле и не допустить их выхода за его пределы.
После окончания электрофореза гель вынимают из плашки и, чтобы увидеть расположение фрагментов, вымачивают в растворе флюоресцентного красителя, прочно связывающегося с ДНК. Иногда его вводят в гель еще до залития плашки. Если красителем служит бромистый этидий, внедряющийся между нуклеотидами ДНК, визуализацию проводят под ультрафиолетом (рис. 10).
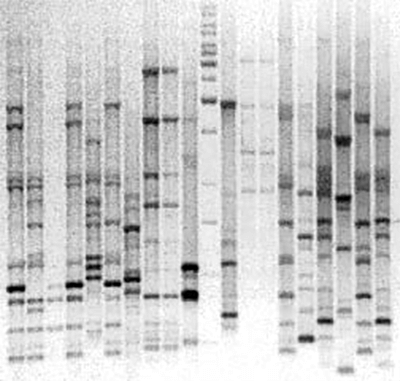
Рисунок 10. Амплифицированные участки ДНК в агарозном геле после электрофореза. Показаны результаты BOX-PCR — варианта rep-PCR (repetitive extragenic palindromic PCR), в котором с праймером BOX-A1R намножаются повторяющиеся внегенные палиндромы (BOX-мотивы) бактерий. Метод BOX-ПЦР — один из видов геномной дактилоскопии. Он обладает высокой разрешающей способностью, позволяя различать бактерии на уровне штаммов: картина распределения амплифицированных фрагментов в геле уникальна для каждого штамма. Вертикальные дорожки — отдельные пробы, соответствующие разным бактериальным штаммам; горизонтальные полоски на каждой дорожке — фрагменты ДНК разной длины.
фото автора статьи
Если экспериментатор преследовал цель просто понять, есть ли нужная последовательность нуклеотидов в ДНК-матрице, то после визуализации гель выбрасывают. Но нужные фрагменты несложно из геля выделить для дальнейшей работы: чтобы резать их на кусочки для сравнения с другими фрагментами, вставлять в плазмиды для дальнейшего изучения, секвенировать и т.д.
«Диаэм»: гель-документирующие системы и электрофорез
Для визуализации результата гель-электрофореза нуклеиновых кислот, окрашенных красителем, используют специальные устройства — трансиллюминаторы. При этом детекцию проводят как визуально, так и с помощью автоматизированных систем захвата и обработки изображения — гельдокументирующих систем.
Для повышения контрастности картинки, получаемой при детекции амплифицированных фрагментов в агарозном геле, компания Vilber разработала трансиллюминаторы с технологией Super-Bright. Эффективность данной технологии по сравнению с обычным УФ-трансиллюминатором хорошо видна на фото ниже. Специальный светофильтр полностью убирает видимый диапазон свечения ламп, что значительно повышает контрастность получаемой картинки, позволяя детектировать даже малые количества НК в геле.
Данная технология реализована на базе автономных трансиллюминаторов Vilber, а также в составе автоматических гель-документирующих систем E-Box, универсальных систем Fusion FX и высокочувствительных систем Infinity.
«Диаэм»: оборудование для классической ПЦР:
Материал предоставлен партнёром — компанией «Диаэм»
Типы ПЦР
Мы описали типичную качественную ПЦР, позволяющую узнать, есть нужная последовательность в анализируемом образце или нет. В качестве матрицы мы всегда упоминали ДНК, но бывают случаи, когда в распоряжении экспериментатора есть лишь РНК (при исследовании РНК-вирусов) или только она может дать необходимую информацию (при определении уровня экспрессии генов). Тогда используют ПЦР с обратной транскрипцией, или ОТ-ПЦР (RT-PCR; не путать с real-time PCR!).
Помимо качественной, существует количественная ПЦР — для определения количества исходной матрицы в образце. Это ПЦР в реальном времени, или real-time PCR. Ее тоже можно проводить в двух вариантах: с ДНК-матрицей и РНК-матрицей.
ПЦР с обратной транскрипцией
Полимеразная цепная реакция может идти исключительно на матрице ДНК, поэтому если у экспериментатора есть мРНК (матричная РНК, на основе которой строятся клеточные белки), то сначала ее надо как-то «переписать» в ДНК. Для этого применяют реакцию обратной транскрипции, в которой фермент обратная транскриптаза по матрице РНК строит комплементарную ДНК (кДНК) [20]. А потом с этой ДНК проводят обычную ПЦР, как описано выше (рис. 11).
Рисунок 11. Схема ОТ-ПЦР. К одноцепочечной РНК-матрице присоединяется праймер, и обратная транскриптаза синтезирует цепь ДНК, которая потом сама уже служит матрицей для синтеза ДНК в процессе обычной ПЦР.
Впервые ОТ-ПЦР упомянули в 1988 году в журнале Science, в статье о синтезе факторов роста макрофагами [21].
Эту реакцию обычно осуществляют с помощью двух ферментов — обратной транскриптазы и ДНК-полимеразы — либо в двух пробирках (в первой при 37 °С по матрице РНК синтезируют кДНК, затем во второй проводят стандартную ПЦР), либо в одной (все реагенты смешивают вместе, дают отстояться 1 час при 37 °С и помещают в циклер). У каждого из подходов есть свои недостатки и достоинства. В первом случае высока вероятность ошибок при пипетировании и загрязнения образца при переносе во вторую пробирку. Но при этом, однажды проведя обратную транскрипцию, полученную кДНК можно использовать в нескольких экспериментах с разными целями. Во втором случае в ПЦР участвует вся синтезированная кДНК, и повторить реакцию уже невозможно. Однако время проведения эксперимента существенно сокращается. Первый вариант применяют для исследования некоторого набора генов, а второй — при большом количестве образцов, но малом количестве изучаемых генов.
Но ОТ-ПЦР можно проводить и с одним ферментом — Tth-полимеразой. Эту термостабильную полимеразу выделили в 1985 году из бактерии Thermus thermophilus HB-8 [22]. Фермент обладает двойной активностью: в присутствии ионов магния — полимеразной, а в присутствии ионов марганца — обратнотранскриптазной. Причем обе реакции могут идти при 70 °С, что очень важно в случае ГЦ-богатых РНК, которые охотно образуют «шпильки»: высокая температура поддерживает матрицу в денатурированном состоянии, повышает специфичность отжига праймеров и позволяет эффективно копировать сложные молекулы [17].
Однако здесь есть и проблема: в присутствии марганца точность полимеразы сильно снижается, и кДНК содержит множество ошибок. Чтобы этого избежать, после реакции обратной транскрипции в пробирку вносят EDTA, которая образует с марганцем устойчивый комплекс, тем самым выводя его из реакции. Затем добавляют магний и проводят ПЦР [17].
ОТ-ПЦР незаменима при работе с вирусами, геном которых представлен молекулой РНК, в диагностике некоторых видов рака по специфическим транскриптам опухолевых клеток, а также в генной инженерии, если нужно экспрессировать эукариотический ген в бактериальных клетках.
ПЦР (и ОТ-ПЦР) в реальном времени
Этот метод еще называют qPCR (quantitative PCR, или количественная ПЦР), поскольку он позволяет не только обнаружить в пробе целевую нуклеотидную последовательность, но и измерить количество ее копий, а значит, и рассчитать, сколько же было исходной матрицы. Этой матрицей может быть как ДНК (qPCR), так и РНК (RT-qPCR). Понятно, что в последнем случае первой стадией будет обратная транскрипция.
ПЦР в реальном времени разработали в 1992 году в Калифорнии сотрудники Roche Molecular Systems [23]. Они добавили в смесь для ПЦР флуоресцентный краситель бромистый этидий (EtBr) и запустили реакцию под ультрафиолетовым светом, который заставлял EtBr светиться. Весь процесс, а следовательно, и усиление свечения при накоплении копий ДНК, исследователи записали на видеокамеру. Затем они смогли подсчитать исходное число копий целевого фрагмента в реакционной смеси.
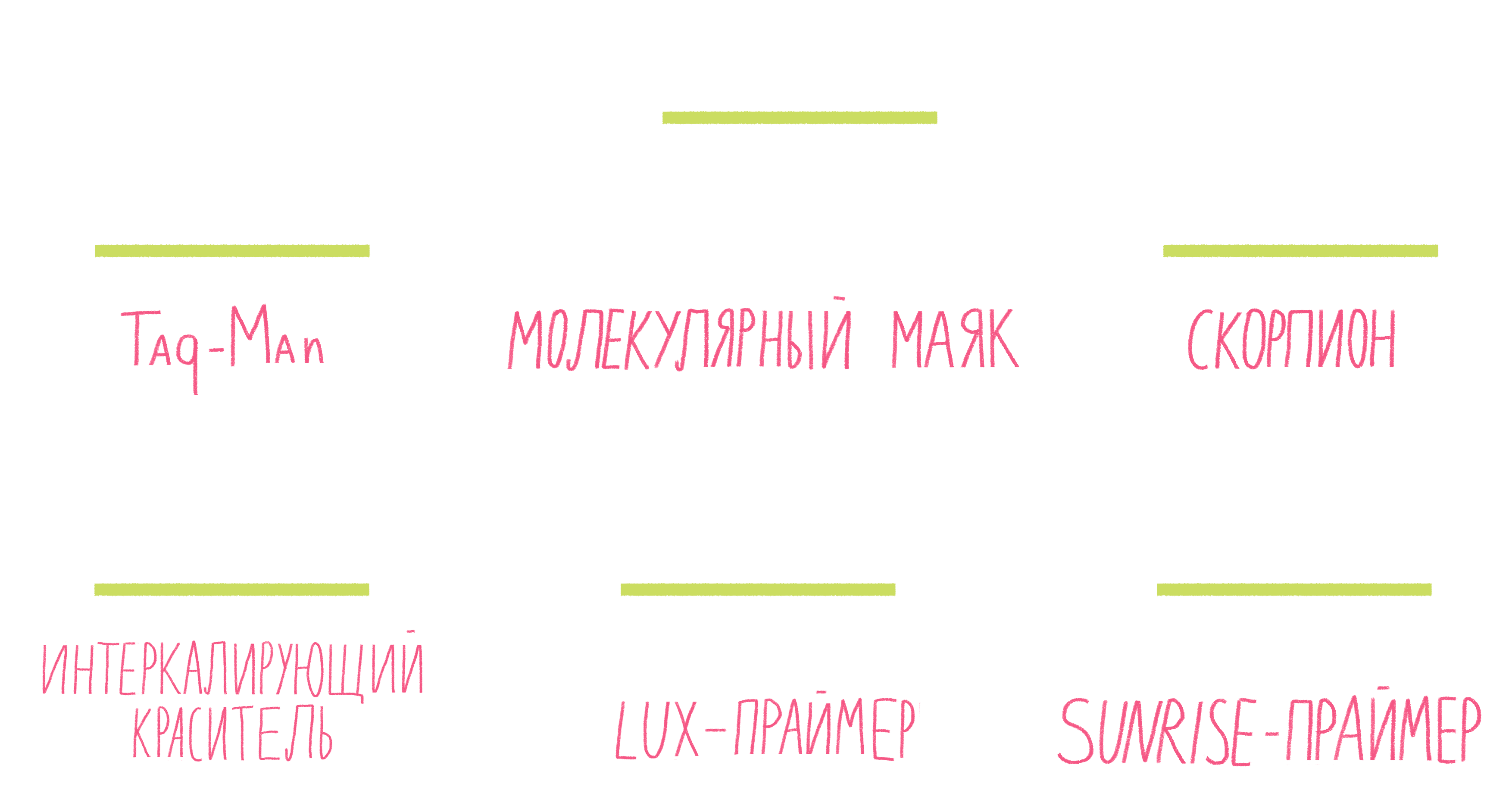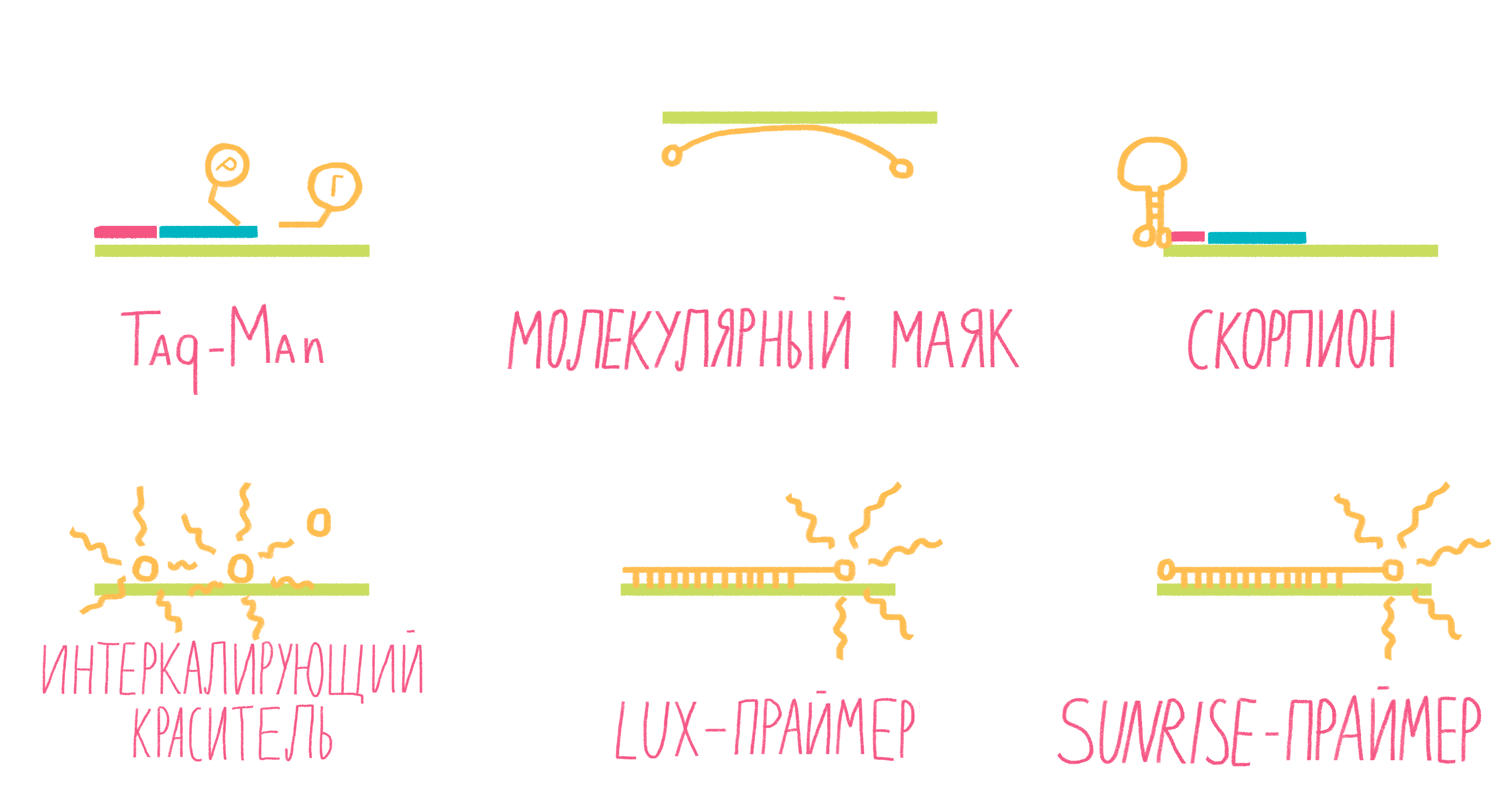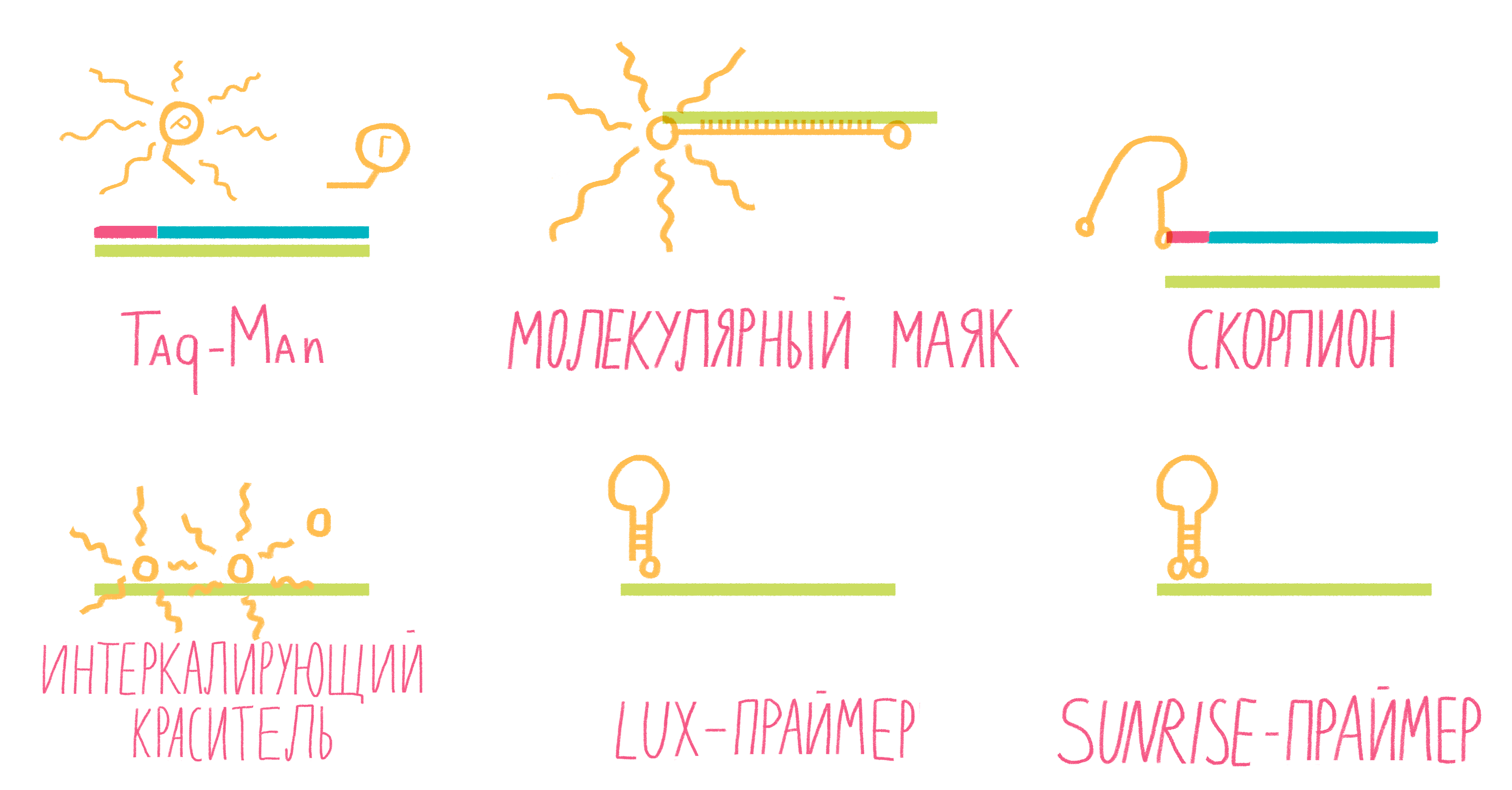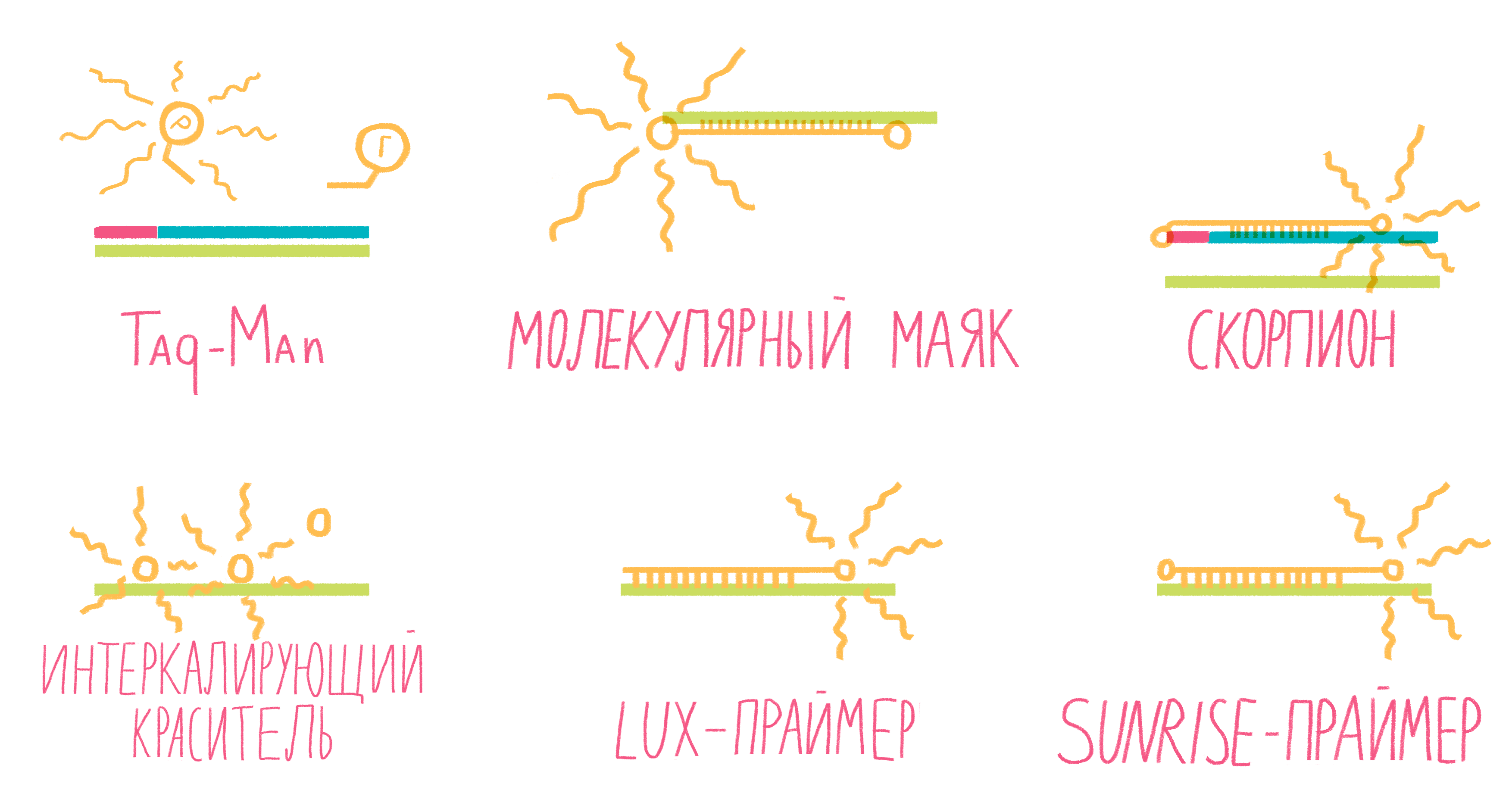
Метод real-time PCR не требует визуализации продуктов реакции с помощью гель-электрофореза — их накопление фиксируют в реальном времени оптические датчики, вмонтированные в амплификатор и настроенные на определенную длину волны, испускаемую флуоресцирующими метками (рис. 12). При этом используют два типа меток: интеркалирующие агенты («коллеги» EtBr) и зонды с флуорофорами [24].
Рисунок 12. Амплификатор для qPCR CFX384 Touch™ от Bio-Rad.
Самый популярный интеркалирующий агент — SYBR Green, флуорофор, резко увеличивающий флуоресценцию (в 1000 раз) после связывания с двухцепочечной ДНК (рис. 13). Таким образом, увеличение флуоресценции будет пропорционально увеличению количества ДНК в каждом цикле ПЦР. К сожалению, интеркалирующие агенты обладают низкой специфичностью: они могут связываться и с «побочными» продуктами реакции, и с димерами праймеров. Однако тщательный подбор праймеров и условий ПЦР минимизируют этот недостаток [24].
Рисунок 13. Некоторые виды меток для ПЦР в реальном времени.
Систем зондов с флуорофорами достаточно много (рис. 13). Подробно разберем лишь три самых распространенных.
Применяют ПЦР в реальном времени для анализа экспрессии генов, одиночных нуклеотидных полиморфизмов (SNP) и хромосомных аберраций, для обнаружения конкретных патогенов и, в последние годы, белков (иммуно-ПЦР в реальном времени) [26].
«Диаэм»: всё оборудование и реагенты для ПЦР на одном сайте
ДНК-амплификаторы для ПЦР в реальном времени для решения любых задач: от узкоспециализированных приборов для медицинских учреждений до универсальных широкопрофильных систем для лабораторий научного направления.
Амплификаторы НК с детекцией в режиме реального времени: отечественные («ДНК-Технология») и зарубежные (Bio-Rad, Eppendorf, Thermo Fisher Scientific); с возможностью загрузки образцов как в индивидуальных пробирках и стрипах, так и в планшетах на 96 и 384 лунки; имеющие от 3 до 6 каналов детекции; автономные, с подключением к ПК и интегрируемые в автоматизированные станции.
Материал предоставлен партнёром — компанией «Диаэм»
Иммуно-ПЦР в реальном времени
Рисунок 14. Схема иммуно-ПЦР в реальном времени.
ПЦР служит для качественного и количественного определения в пробе нуклеиновых кислот. Но во многих случаях необходимо детектировать ферменты, гормоны, токсины, антитела и другие молекулы. В большинстве случаев для этого используют метод ИФА (иммуноферментный анализ). Чувствительность метода позволяет определять даже несколько нанограммов антигена в пробе, однако отдельные молекулы ИФА выявить не в состоянии [27].
Чтобы устранить такой недостаток, ученые решили попробовать соединить ИФА и ПЦР. Технологию иммуно-ПЦР (иПЦР, IPCR) разработали сотрудники Калифорнийского университета в Беркли в 1992 году [28]. Сначала для визуализации результатов использовали гель-электрофорез, но сегодня в большинстве случаев применяют ПЦР в реальном времени.
Суть метода заключается в следующем. Пробы, где ищут нужную молекулу (гормон, токсин и т.п.), помещают в специальные пробирки, материал которых обладает высокой антигенсвязывающей способностью и термостойкостью. Далее к пробам добавляют специфические антитела с «пришитыми» к ним ДНК-метками длиной 150–300 п.н. (существует множество вариантов таких систем, но здесь разберем самый простой). Когда антитела присоединятся к искомым молекулам (антигенам), иммобилизованным на стенках пробирок, производят многократную промывку, чтобы удалить непрореагировавшие меченые антитела (рис. 14). Затем в эти же пробирки заливают смесь для qPCR (с интеркалирующим агентом или зондом), помещают их в циклер и проводят реакцию, во время которой амплифицируются ДНК-метки на антителах, связанных с антигенами. Так получают сведения не только о наличии антигенов в пробе, но и об их количестве [29], [30].
Иммуно-ПЦР по разрешающей способности превосходит ИФА на 2–5 порядков и выявляет антиген даже когда невозможно сконцентрировать пробу либо на ранних стадиях бактериальной или вирусной инфекции. Не менее полезно и то, что иПЦР позволяет одновременно обнаруживать много разных антигенов, так как к антителам «пришиты» разные ДНК, амплифицируемые с уникальными праймерами, для которых можно использовать зонды разных конструкций [27], [30].
Применяют иммуно-ПЦР для поиска в пробах вирусных антигенов (например, ВИЧ), опухолеассоциированных антигенов (например, фактора роста эндотелия сосудов), прионов, бактериальных белков, токсинов (в том числе и небелковых, например, диэтилфталата) и других веществ [31].
Direct PCR, или ПЦР без выделения ДНК
Интересный продукт для ПЦР — наборы для постановки прямой реакции полимеризации. Для такой ПЦР не требуется выделения ДНК, достаточно просто добавить образец в пробирку с реагентами, проинкубировать и провести реакцию полимеризации.
Созданы наборы для прямой ПЦР тканей растений, цельной крови и мягких тканей лабораторных животных. Это решение позволяет сэкономить время, которое требуется на выделение НК, снизить риск перекрестной контаминации, а также потерю НК на стадии выделения.
Direct PCR не идеальна для точного количественного анализа, но такие наборы широко используются как экспресс-метод качественного анализа в полевых мобильных лабораториях и для предварительного скрининга большого количества образцов.
«Диаэм» — всё что нужно для ПЦР:
Материал предоставлен партнёром — компанией «Диаэм»
Варианты проведения реакции
Сегодня существуют десятки вариантов проведения ПЦР для разных целей, для повышения специфичности и эффективности. Разберем лишь несколько наиболее популярных и интересных.
ПЦР с горячим стартом
Известно, что Taq-полимераза может проявлять небольшую активность при комнатной температуре и даже когда пробирка с реакционной смесью находится во льду. Поэтому фермент всегда добавляют в смесь непосредственно перед запуском реакции. Но если, например, проб много, то какие-то из них некоторое время будут стоять уже с полимеразой, пока экспериментатор внесет ее во все пробирки. В этом случае есть вероятность получения неспецифически амплифицированных фрагментов.
Чтобы избежать такой неприятности, используют ПЦР с горячим стартом (hot start PCR), где в смесь добавляют полимеразу в комплексе с антителами, блокирующими ее активность. На первой стадии ПЦР (при 95 °С) антитела денатурируют, полимераза освобождается и только тогда начинает работу.
Ступенчатая ПЦР
При оптимальной температуре отжига праймеры иногда могут связываться и с не идеально комплементарными им участками, а вот если эту температуру немного повысить (например, до 72 °С), то специфичность гибридизации праймеров с матрицей можно существенно увеличить. На этом и основана ступенчатая ПЦР (touchdown PCR): первые циклы проводят при повышенной температуре отжига, постепенно снижая ее до оптимальной в следующих циклах. В результате поначалу вероятность неспецифичной амплификации снижается до минимума, а далее уже размноженные копии нужного фрагмента будут успешно конкурировать за праймеры с не полностью комплементарными им участками ДНК-матрицы.
«Холодная» ПЦР
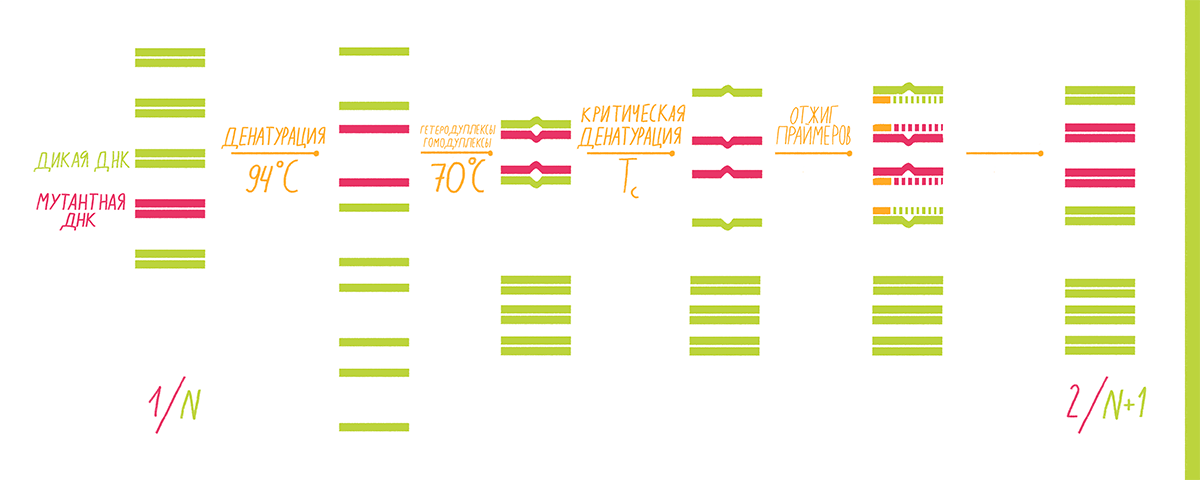
COLD-PCR (CO-amplification at Lower Denaturation temperature-PCR) используют, когда необходимо выявить, например, однонуклеотидную мутацию гена, но при этом проба содержит ДНК-матрицу как с мутантным геном, так и с геном «дикого типа». Такая смесь типична для биоптатов или образцов крови онкологических больных, и потому этот анализ востребован в медицине для ранней диагностики рака или его рецидивов, а также для назначения индивидуальной терапии на основе молекулярного профилирования. Если делать стандартную ПЦР, то амплифицируются и мутантные, и немутантные аллели интересующего гена, причем последних будет значительно больше, и выявить мутацию будет очень трудно.
Принцип «холодной» ПЦР основан на том, что замена даже одного нуклеотида в одной из цепей ДНК-фрагмента приводит к изменению его температуры плавления, то есть температуры, при которой две цепи ДНК отсоединяются друг от друга. Это изменение составляет обычно 0,2–1,5 °С для фрагментов длиной до 200 п.н. Такая пониженная температура называется критической температурой денатурации (Тс): при ней эффективность ПЦР резко падает из-за малого числа денатурированных матриц [32]. То есть при Тс матрицы «дикого типа» денатурировать уже не будут, но будут те, в которых одна из цепей содержит нуклеотидную замену, отчего их Tm снижается до значения Тс. Для получения таких коротких диагностических матриц интересующий фрагмент вначале выделяют из тотальной ДНК биоматериала с помощью стандартной ПЦР. Мутантные формы среди этих фрагментов ищут уже с помощью COLD-PCR, которая проходит в несколько этапов (рис. 15):
После окончания всех циклов реакции полученные копии интересующего фрагмента секвенируют, чтобы точно установить место и тип мутации.
Рисунок 15. Схема «холодной» ПЦР.
Чтобы увидеть рисунок в полном размере, нажмите на него.
ПЦР длинных фрагментов
Применяют, когда нужно амплифицировать очень длинные фрагменты — более 5 т.п.н. В long-range PCR часто используют две полимеразы: Taq и Pfu. Первая может за один проход синтезировать длинную цепь ДНК, но при этом «застревает», совершив ошибку, потому что не умеет вырезать только что вставленные нуклеотиды. Вторая полимераза менее процессивна, зато способна исправлять ошибки. Так они друг другу и помогают: Taq ошибается, а Pfu исправляет, давая возможность «подружке» закончить синтез.
Мультиплексная ПЦР
Бывают случаи, когда в одной пробе необходимо выявить сразу несколько последовательностей. Например, при инфекции несколькими патогенами, при диагностике комплекса заболеваний или при выявлении мутаций (рис. 16). И чтобы не проводить много реакций, экономят время и реактивы — применяют мультиплексную ПЦР (multiplex PCR), то есть ПЦР со множеством праймеров. Суть ее в том, что в одну пробирку с ДНК-матрицей добавляют целый набор праймеров для одновременной амплификации нескольких интересующих фрагментов [24], [33].
Рисунок 16. Результаты мультиплексной ПЦР ДНК пациента с миодистрофией Дюшенна. К дистрофии приводят различные мутации экзонов гена белка дистрофина. На дорожке 7 нет полосы, соответствующей экзону 48 (длиной 506 п.н.) этого гена.
Однако при этом надо соблюдать такие условия:
Это ПЦР случайных полиморфных фрагментов ДНК — Random Amplification of Polymorphic DNA. К RAPD прибегают, когда нужно различить сходные геномы: виды бактерий, сорта растений, породы собак и т.д. Используют небольшой праймер (до 10 н.), который может гибридизоваться со многими случайными участками генома. Если правильно подобрать последовательность праймера и условия реакции, то в геле после электрофореза пробы будут отличаться друг от друга количеством и (или) расположением полос.
При всей схожести метода с rep-PCR, описанной под рисунком 10, последнюю всё-таки считают независимой техникой, отличающейся от RAPD своими характеристиками [34]. Так, RAPD менее специфична и хуже воспроизводится: любая мутация в комплементарном праймеру участке матрицы приводит к тому, что короткий праймер не гибридизуется с ним, и соответствующей полосы в геле не будет. Удлинение праймеров в rep-PCR до 20–22 н. сильно повышает воспроизводимость результатов.
Асимметричная ПЦР
Асимметричную реакцию (asymmetric PCR) проводят при желании получить амплифицированную копию участка только одной из цепей ДНК — например, для последующей гибридизации. В таком случае в реакционной смеси концентрация одного праймера должна быть намного выше, чем другого, и тогда на выходе будут превалировать фрагменты нужной цепи.
Метилспецифичная ПЦР
Геномная ДНК живых организмов, как правило, метилирована: после синтеза ДНК к небольшому проценту цитозинов и аденинов фермент ДНК-метилтрансфераза присоединяет метильную группу. Цели метилирования разнообразны: от регуляции экспрессии отдельных генов до регуляции целых процессов, таких как старение или канцерогенез.
Это свойство геномной ДНК эксплуатирует метилспецифичная ПЦР (methylation-specific PCR). Такой вариант ПЦР применяют, чтобы понять, метилирован ли определенный участок ДНК по цитозину.
Перед постановкой реакции ДНК-матрицу обрабатывают бисульфитом. Он преобразует неметилированные цитозины в урацилы, которые распознаются праймерами и полимеразой как тимины, а метилированные цитозины не трогает. Затем проводят две реакции с разными праймерами: в одну пробирку вносят праймеры, специфичные к последовательности с цитозинами, а в другую — к последовательности с урацилами. Если амплификация прошла в первой пробирке, значит ДНК на этом участке метилирована, если во второй — не метилирована.
ПЦР со вложенной парой праймеров
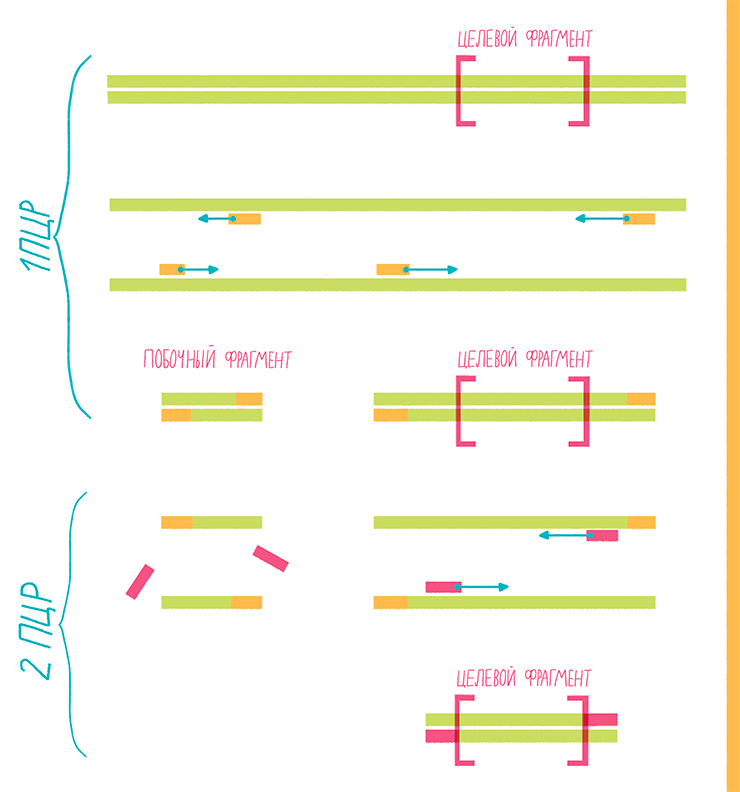
Она же — вложенная или гнездовая ПЦР (nested PCR). Полезна для уменьшения вероятности амплификации неспецифических фрагментов. Если, например, какие-то из праймеров «сядут» на незапланированные участки, после электрофореза в геле можно получить несколько полос — целевого фрагмента и побочных. Чтобы повысить специфичность реакции, используют два набора праймеров: первый — для амплификации более длинного фрагмента, второй — для амплификации внутреннего участка этого фрагмента (рис. 17). Несколько раундов ПЦР проводят с первым набором, а затем добавляют второй. Чтобы избежать продолжения амплификации с первыми праймерами, оба набора разрабатывают для отжига при разных температурах [24].
Рисунок 17. Схема вложенной ПЦР.
Инвертированная ПЦР
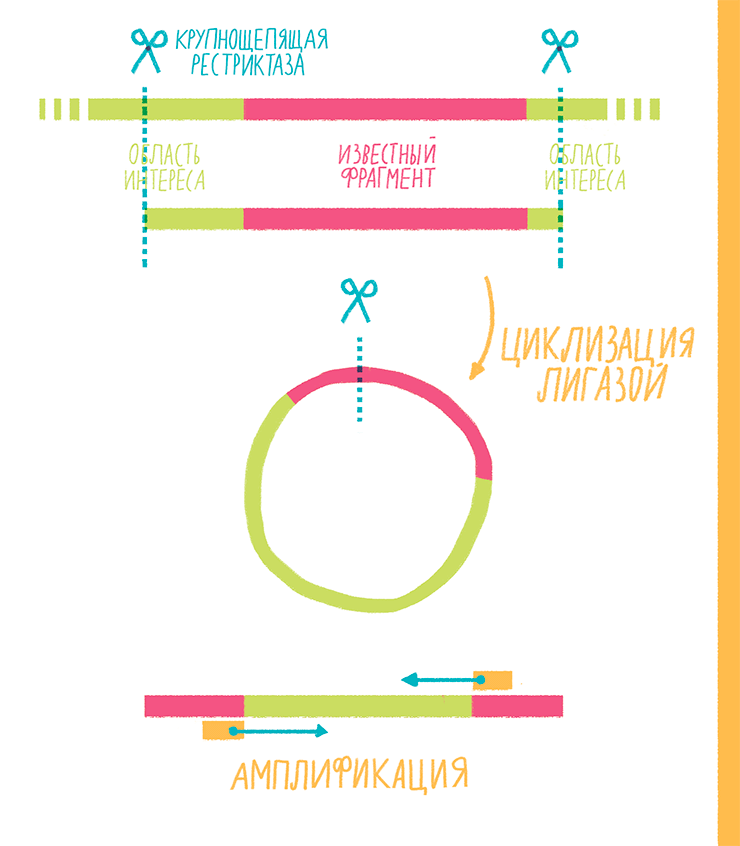
Этот вариант используют, когда известна последовательность (сиквенс) какого-то участка ДНК, но нужно амплифицировать вовсе не его, а то неизвестное, что его окружает. Например, необходимо узнать, в какое место генома встроился вирус с известным сиквенсом. Тогда-то и приходит на помощь инвертированная ПЦР (inverse PCR), которая состоит из нескольких этапов (рис. 18):
Рисунок 18. Схема инвертированной ПЦР.
ПЦР с перекрывающимися праймерами
Чаще всего для соединения двух фрагментов двухцепочечной ДНК используют метод рестрикции/лигирования, когда края этих фрагментов разрезают одинаковыми эндонуклеазами с образованием «липких» концов, а потом соединяют их с помощью лигазы. Однако с этой целью можно применять и метод ПЦР.
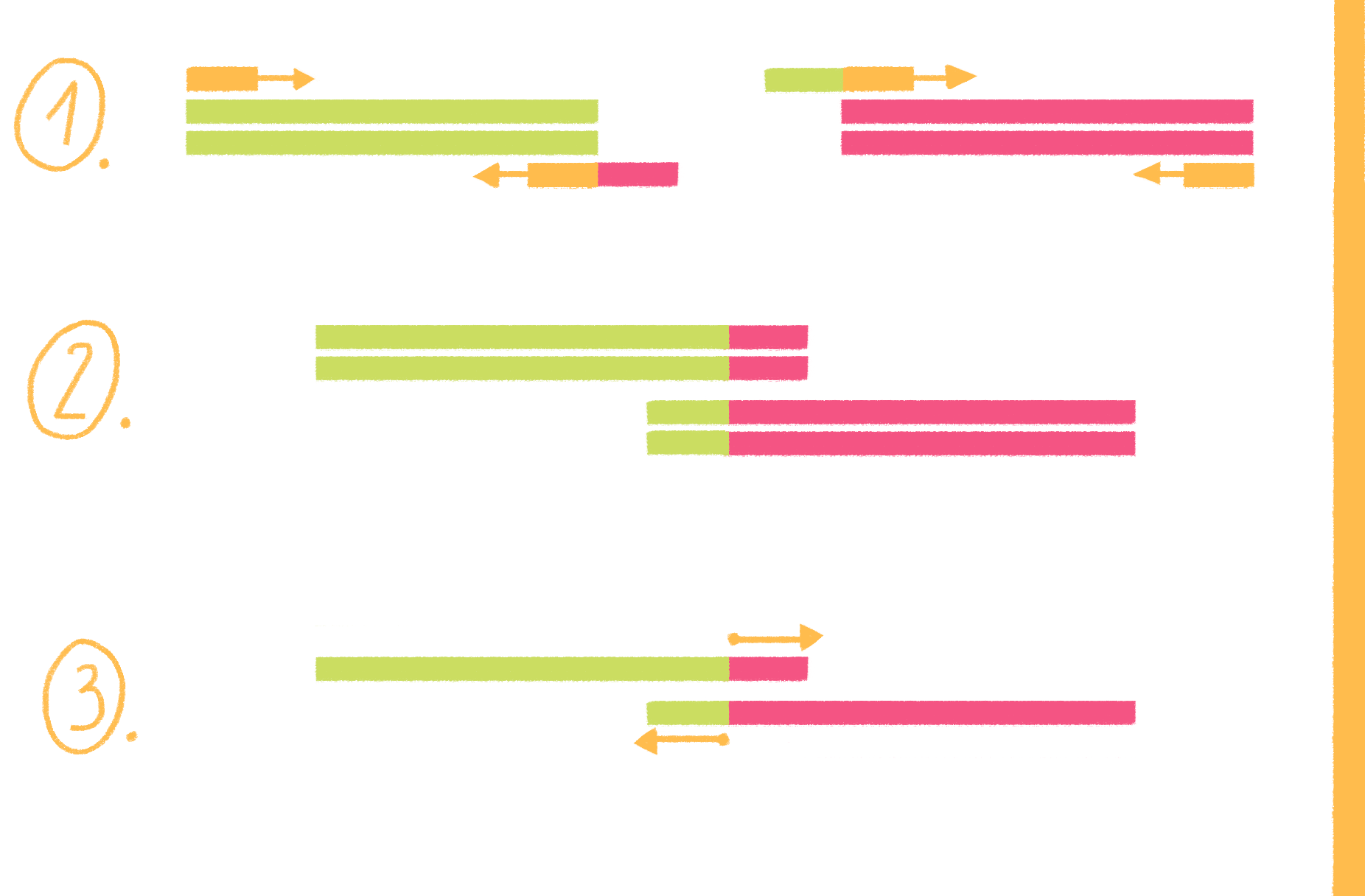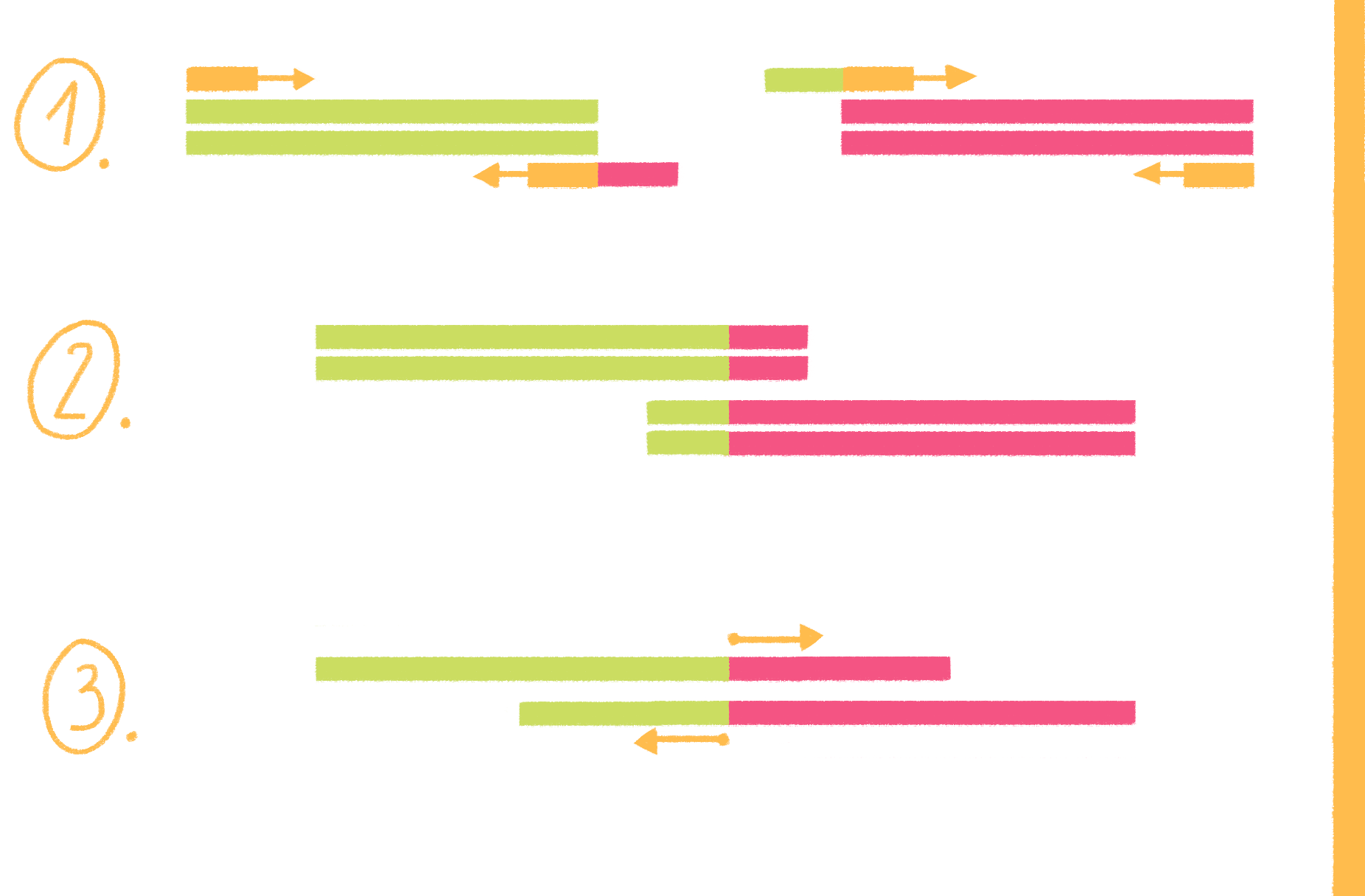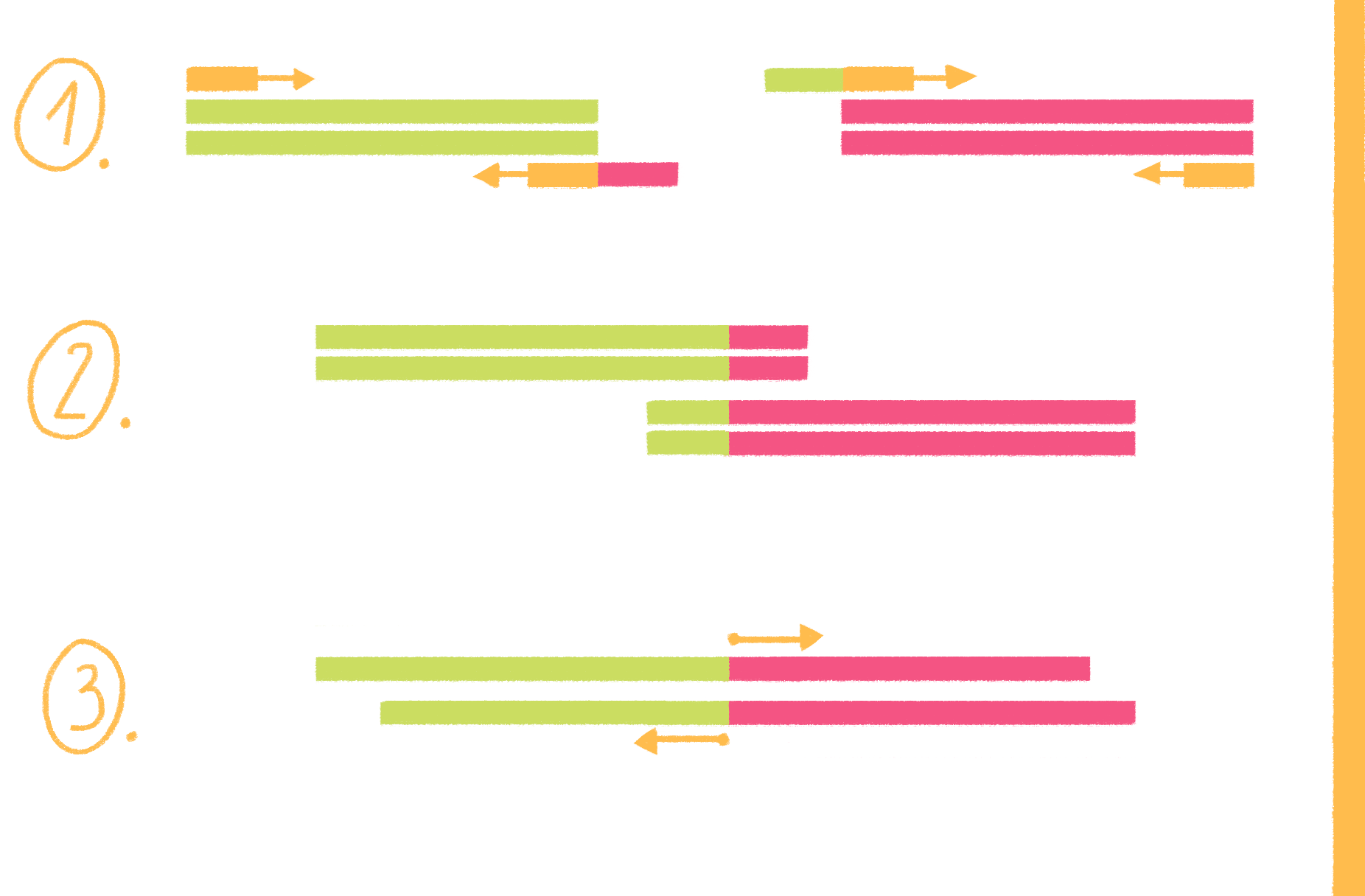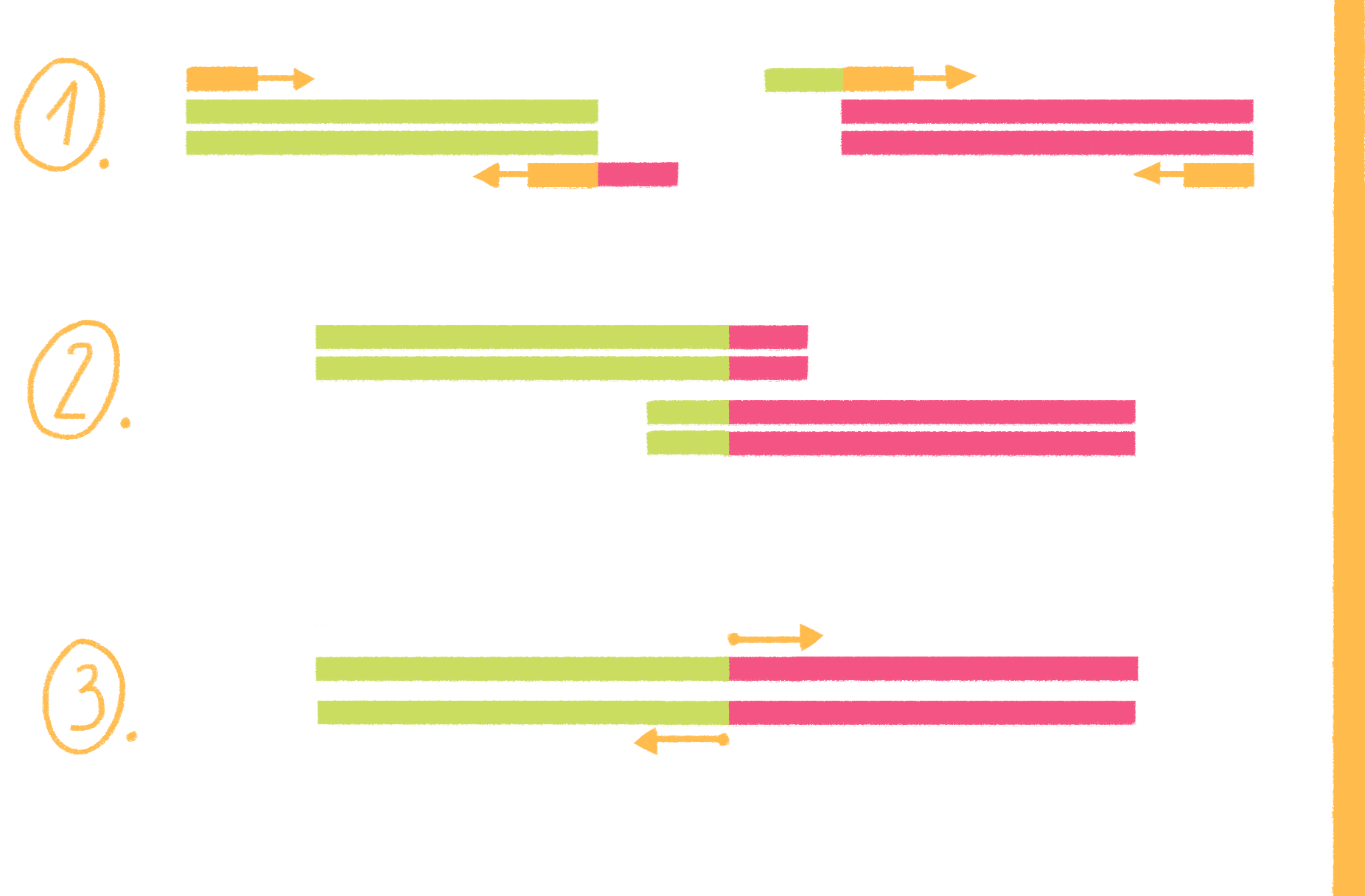
ПЦР с перекрывающимися праймерами, или продлением перекрывания (overlap extension PCR), выполняется в несколько этапов (рис. 19):
Этот же вариант ПЦР, но с небольшими модификациями, используют и для внесения мутаций, например, если из длинного фрагмента ДНК надо удалить какой-то участок.
Рисунок 19. Схема ПЦР с перекрывающимися праймерами.
Сборочная ПЦР
Этот вариант похож на предыдущий. Его используют для сборки синтетических молекул ДНК из отдельных фрагментов, например, чтобы получить синтетические гены или даже целые геномы.
В сборочной ПЦР (assembly PCR) используют одноцепочечные олигонуклеотиды длиной до 50 н., одна часть которых предназначена для образования одной цепи ДНК, а другая — для образования другой (рис. 20). Важно, чтобы эти олигонуклеотиды частично перекрывались концами (примерно на 20 нуклеотидов) с «соседями» на будущей противоположной цепи, поскольку они сами будут работать и праймерами, и матрицей. Во время первых 30 циклов ПЦР концы олигонуклеотидов удлиняются по матрице фрагментов противоположной цепи. К концу процесса каждый олигонуклеотид удлинится настолько, что превратится в отдельную цепочку будущей синтетической ДНК. Тогда в реакцию добавляют пару праймеров, комплементарных концам этой ДНК, и проводят дополнительные 23 цикла, получая на выходе множество копий синтетической ДНК.
Рисунок 20. Схема сборочной ПЦР.
Рисунок 21. Схема твердофазной ПЦР.
Твердофазная ПЦР
Ее применяют, например, для получения ДНК-микрочипов или при секвенировании на платформе Illumina. К твердой поверхности 5ˊ-концами пришивают праймеры, добавляют реакционную смесь и проводят твердофазную ПЦР (solid phase PCR, рис. 21). В первом цикле удлиняется некоторое количество праймеров, затем проводят промывку, чтобы удалить свободно плавающие в растворе ДНК-матрицы, добавляют новый раствор (но уже без матриц) и продолжают ПЦР. Одноцепочечные ДНК, торчащие над поверхностью, на этапе отжига изгибаются и гибридизуются с какими-то из соседних праймеров, становясь матрицами для удлинения этих праймеров. На этапе денатурации обе цепи расходятся, но всё равно остаются прикрепленными к поверхности, так как представляют собой продолжения праймеров [35].
In situ ПЦР
Это реакция, которую проводят непосредственно в клетках или тканях, например, для изучения внутриклеточного развития вирусов. Сначала клетки или ткань фиксируют на предметном стекле и обрабатывают протеазой, чтобы расщепить белки и освободить ДНК (или РНК, если собираются проводить ОТ-ПЦР). Затем прямо на стекло добавляют смесь для ПЦР и ставят препарат в амплификатор. Выявляют получившиеся фрагменты либо ДНК-гибридизацией, либо иммунологическими методами.
Капельная цифровая ПЦР
Цифровая ПЦР (digital PCR) — более точный и воспроизводимый метод количественного определения ДНК, чем ПЦР в реальном времени. Стандартная ПЦР проходит во всём объеме образца, а при цифровой пробу делят на большое количество маленьких субъединиц (компартментов) и проводят ПЦР в каждой из них отдельно. Методы разделения на компартменты в различных технологиях цифровой ПЦР отличаются друг от друга (используют масляную эмульсию, капилляры и т.д.), а реакцию проводят в планшетах с микролунками. Результаты визуализируют чаще всего с помощью системы TaqMan, но иногда применяют и интеркалирующие агенты, например, зеленую флуоресцирующую краску EvaGreen.
Метод цПЦР разработали австралийцы Алек Морли и Памела Сайкс в 1992 году, когда исследовали больных лейкемией [36]. В последующие годы разные исследовательские группы разрабатывали свои варианты, в том числе и варианты компартментализации. К сожалению, все они имели существенный недостаток — высокую трудоемкость: пробу надо было разделять на сотни (а то и тысячи) реакций объемом по нескольку микролитров каждая или проводить дополнительные реакции (например, иммобилизацию праймеров на магнитных шариках и гибридизацию продуктов ПЦР с флуоресцентными пробами, как в технологии BEAMing), а затем отдельно анализировать результаты.
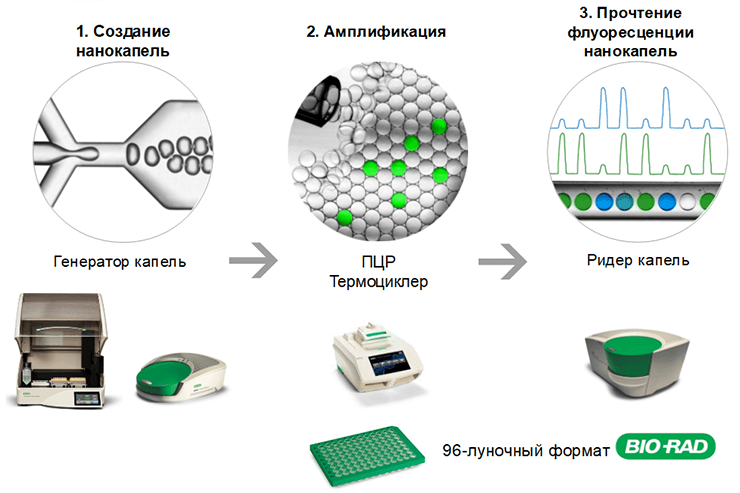
От этих проблем экспериментаторов избавила капельная цифровая ПЦР (кцПЦР), или по-английски droplet digital PCR (ddPCR). Общепризнанным лидером в этой области является система цифровой капельной ПЦР — QX200 производства компании Bio-Rad. Эту методику разработала компания QuantaLife, а в 2011 году Bio-Rad приобрела права на технологию [37]. На рынке существует еще несколько систем капельной цифровой ПЦР: QuantStudio 3D и QuantStudio 12K Flex (обе производства Thermo Fisher Scientific), Biomark HD (от Fluidigm), а также RainDrop Plus (от RainDance Technologies), недавно купленный компанией Bio-Rad, но QX200 явно доминирует — за последние несколько лет систему упоминали в более чем 600 публикациях.
В ddPCR из 20 мкл образца, в котором требуется определить количество исследуемой ДНК, создают водно-маслянную эмульсию. Реакционную смесь разделяют на приблизительно 20 000 капель-реакций объемом около 1 нл каждая с помощью автоматического генератора капель (рис. 22). При этом генетический материал распределяется по каплям случайным образом: в них попадают как ДНК-мишени, так и фоновая ДНК. Процесс распределения целевой ДНК по каплям чисто случайный и подчиняется закону распределения малых чисел Пуассона. Перед разделением образца на капли не обязательно разводить его до концентрации, чтобы в каждой капле было либо 0, либо 1 копия ДНК-мишени: при анализе результатов учитываются ситуации, когда в одной капле находится более одной копии мишени.
Рисунок 22. Схема цифровой ПЦР с использованием системы QX200™ от Bio-Rad.
Капли вносят в 96-луночный планшет для ПЦР и помещают в циклер. Реакция проходит независимо в каждой капле (подробное руководство по капельной цифровой ПЦР на английском языке доступно на сайте Bio-Rad: Droplet Digital TM PCR Applications Guide). В тех каплях, куда попала ДНК-мишень, образуется ПЦР-продукт, что приводит к увеличению уровня флуоресцентного сигнала от флуоресцентной метки: либо TaqMan-зондов, либо интеркалирующего красителя. После ПЦР в специальном устройстве (ридере) капли независимо друг от друга проверяют на наличие или отсутствие в них флуоресцентного сигнала (рис. 23). Количество капель с положительным и отрицательным сигналами подсчитывают для каждого образца, а программное обеспечение выдает концентрацию ДНК-мишени в виде числа копий в микролитре. Анализ продукта проходит в конечной точке после проведения ПЦР [38].
Рисунок 23. Автоматическая шприц-пипетка ридера капель извлекает капли из каждой лунки планшета для ПЦР.
В кцПЦР определение количества ДНК-мишени проводят не относительно, используя калибровочную кривую, как в случае с ПЦР в реальном времени, а прямым подсчетом капель с наличием или отсутствием в них ДНК-мишени. Это существенно увеличивает стабильность системы и ее устойчивость к ингибиторам ПЦР.
При наличии только двух флуоресцентных каналов (FAM и HEX/VIC) система позволяет запускать 4—5-плексные реакции за счет использования смеси зондов с одной нуклеотидной последовательностью, но меченных красителями FAM и HEX/VIC в различных пропорциях. Возможно также проводить 2—3-плексные реакции с интеркалирующим красителем EvaGreen, используя различную «емкость» разноразмерных ПЦР-продуктов для интеркалятора, что позволяет независимо подсчитать количество этих продуктов по разнице уровня их флуоресценции.
С помощью капельной цифровой ПЦР можно определять:
Метод активно используют в различных областях, но наиболее часто при:
Несмотря на сходство применения цифровой ПЦР и ПЦР в реальном времени, скорее всего, в будущем ddPCR будет постепенно вытеснять real-time PCR как основной ПЦР-метод количественного определения ДНК.
Альтернативы ПЦР
В этой главе опишем наиболее интересные и перспективные методы изотермической амплификации, которые могут составить конкуренцию стандартной ПЦР, если нужно узнать, есть ли в пробе та или иная последовательность. Эти методы особенно полезны для медицины и сельского хозяйства в полевых условиях, когда нужно обнаружить патогены в образцах растительного или животного происхождения. Если же перед экспериментатором стоят генно-инженерные цели, например, клонирование генов, то здесь, конечно, ПЦР вне конкуренции.
Опосредованная образованием петель изотермическая амплификация
Метод описали японские ученые в 2000 году [39]. LAMP (loop-mediated isothermal amplification) использует Bst-полимеразу из Geobacillus stearothermophilus, совмещающую полимеразную и хеликазную активности, что дает возможность исключить фазу денатурации и проводить реакцию при 60–65 °С. Подробно о методе написано в статье «Поиск иголки в стоге сена за 10 минут — подсвети себе LAMPой» [40].
LAMP, в отличие от обычной ПЦР, использует не два, а четыре или шесть праймеров, что увеличивает специфичность реакции, но в то же время повышает вероятность артефактов и эффекта множественности полос в электрофорезном геле. Однако это, по сути, не недостаток, так как метод рассчитан на детектирование результата невооруженным глазом («позитив»/«негатив») без электрофореза.
Хеликазозависимая амплификация
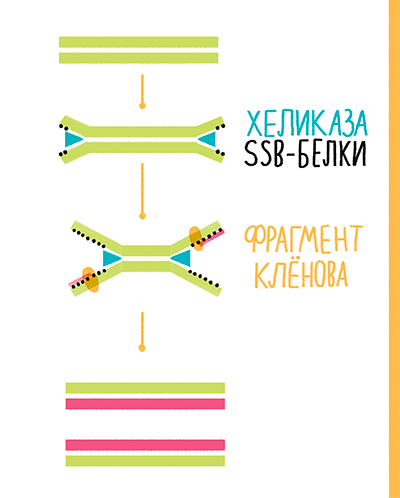
В 2004 году сотрудники компании New England Biolabs (NEB) предложили свою альтернативу полимеразной цепной реакции — хеликазозависимую амплификацию (helicase-dependent amplification, HDA). В реакции авторы предложили использовать хеликазу UvrD Escherichia coli, SSB-белки gp32 фага Т4 и фрагмент Клёнова exo− (рис. 24). Хеликаза раскручивает ДНК, SSB-белки стабилизируют цепи в разделенном состоянии, а фрагмент Клёнова синтезирует новую ДНК от 3ˊ-конца праймеров. Реакция проходит при 37 °С. Однако если перед ее постановкой провести денатурацию ДНК при 95 °С, эффективность повышается в 1,5–2 раза [41], [42]. Коммерческие наборы, выпускаемые сейчас NEB, вместо фрагмента Клёнова содержат Bst-полимеразу, а вместо UvrD E. coli — термостабильную хеликазу UvrD Thermoanaerobacter tengcongensis (Tte-UvrD), что позволяет проводить реакцию при 65 °С [43].
Рисунок 24. Схема хеликазозависимой амплификации.
К сожалению, у этого метода есть и недостатки. Для получения результатов, сравнимых с результатами стандартной ПЦР, всё-таки необходимо провести предварительную денатурацию образца. К тому же максимальный размер амплифицируемого фрагмента не превышает 120 п.н. Однако по некоторым данным, HDA улавливает в пробе меньшую концентрацию целевой ДНК, чем LAMP [44]. А если использовать хелимеразу (особым образом сшитые Tte-UvrD и Bst-полимеразу), созданную компанией BioHelix, то размер амплифицируемого фрагмента увеличивается до 1,5 т.п.н. [45].
Рекомбиназная полимеразная амплификация
В 2006 году британские ученые из биотехнологической компании TwistDX LTD разработали метод изотермической рекомбиназной полимеразной амплификации (РПА), который может составить сильную конкуренцию как обычной ПЦР, так и ПЦР в реальном времени [46].
Главное отличие РПА от обычной ПЦР в том, что реакция может проходить при комнатной температуре (25 °С), а оптимально — при 37–40 °С. В РПА используют большой фрагмент Bsu-полимеразы, SSB-белки gp32 фага Т4 и его же рекомбиназу uvsX. Часть молекул рекомбиназы связывают с одним праймером, часть — с другим. После внесения в реакционную смесь такие молекулы сканируют ДНК в поисках комплементарных праймеру участков и, найдя их, инициируют процесс расплетения двухцепочечной молекулы и присоединения праймера (рис. 25). Расплетенную ДНК стабилизируют SSB-белки, а полимераза начинает синтез. Процесс АТФ-зависимый, поскольку энергия нужна для освобождения 3ˊ-конца праймера от молекул рекомбиназы. Размер амплифицируемого фрагмента ограничивается тысячей пар нуклеотидов, а минимальная длина праймера должна быть 30 н. для повышения его специфичности [46].
Рисунок 25. Схема рекомбиназной полимеразной амплификации.
Процесс может длиться 15–30 минут, включая экстракцию образцов, что намного быстрее стандартной ПЦР [47]. Этот метод амплификации лишен значительных недостатков (кроме требования строгого соблюдения условий реакции) и может легко модифицироваться в РПА с обратной транскрипцией и РПА в реальном времени — как с интеркалирующими агентами, так и с флуоресцентными зондами.
Весной 2017 года американские ученые предложили на основе рекомбиназной полимеразной амплификации в сочетании с технологией CRISPR-Cas новый метод диагностики — SHERLOCK. О нем «Биомолекула» уже рассказывала в статье «SHERLOCK — молекулярный сыщик спешит на помощь!» [48].
Компания Bio-Rad — партнер этой публикации
Компания Bio-Rad Laboratories, Inc USA («Био-Рад», США) является одним из мировых лидеров производства оборудования и реагентов для научных исследований. В рамках взаимодействия с научными, медицинскими, биотехнологическими и образовательными организациями «Био-Рад» предлагает современные технологии, оборудование и реагенты.
Система для капельной цифровой ПЦР
Высокопроизводительные ПЦР-системы Bio-Rad — это новейшие технологические достижения, обеспечивающие непревзойденную точность и воспроизводимость геномных экспериментов. Линейка продуктов включает в себя термоциклеры, системы для ПЦР в реальном времени, реагенты для ПЦР и пластик, а также новую систему капельной цифровой ПЦР QX200 Droplet Digital PCR System для абсолютной количественной оценки ДНК-мишени в образце.
Геномные технологии (генная экспрессия и генная модуляция)
Протеомные технологии (структурная и функциональная протеомика)
Клеточные технологии
Материал предоставлен партнёром — компанией «Био-Рад»
Применение ПЦР
1. Клиническая медицина
2. Криминалистика и судебная медицина
3. Генная инженерия
4. Антропология, палеонтология
5. Сельское хозяйство
Полимеразная цепная реакция — один из самых мощных и дешевых лабораторных методов. Его появление привело к воистину революционным изменениям в науке и медицине. И если сейчас для генетических экспресс-анализов появляются альтернативные техники, не требующие сложной аппаратуры, то в генетической инженерии ПЦР по-прежнему просто незаменима. Пожалуй, самые ценные свойства этого метода — совместимость с другими техниками и невероятная пластичность: они позволяют биологам и врачам с минимальными усилиями решать совершенно разные задачи. А главное, метод пока не исчерпал свой потенциал: до сих пор появляются всё новые его варианты, и, возможно, нас еще не раз удивят остроумные и неожиданные протоколы экспериментов, основанных на ПЦР.
Календарь
На основе статей спецпроекта мы решили сделать календарь «12 методов биологии» на 2019 год. Эта статья представляет февраль.