Псевдомонас аэругиноза что это такое лечение
Псевдомонас аэругиноза что это такое лечение
К роду Pseudomonas относят возбудителей, обитающих в окружающей среде и при определённых условиях вызывающих инфекционный процесс у человека (оппортунистические инфекции). Наиболее патогенной бактерией считают Pseudomonas aeruginosa.
Патогенез инфекции вызванной Pseudomonas aeruginosa. Pseudomonas aeruginosa вырабатывает цитотоксины и протеазы (экзотоксины А и S, гемолизины и эластазу). Возбудитель, выделенный от пациентов с муковисцидозом, способен синтезировать полисахаридные альгинаты, что облегчает образование микроколоний, защищает их от опсонизации, фагоцитоза и воздействия антибиотиков. Факторы адгезии — альгинаты, пили и наружные мембранные белки.
Образование альгинатов сопровождается уменьшением подвижности возбудителя и снижением синтеза экзотоксинов, развитием реакций гиперчувствительности к антибиотикам, снижением синтеза липополисахарида.
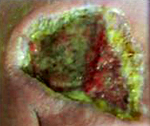
Клинические признаки инфекции вызванной Pseudomonas aeruginosa. Быстрее всего прогрессируют инфекционные поражения роговицы и наружный отит. Воротами инфекции могут быть ожоговые и раневые поверхности, при этом возможно развитие вторичной септицемии. Последняя — наиболее частая причина смерти пациентов с нейтропенией.
Некоторые штаммы вызывают деструкцию кожных покровов и гангренозную эктиму. В дальнейшем может развиться остеомиелит, септический артрит и менингит (особенно после нейрохирургических операций). Хронический муковисцидоз приводит к прогрессирующему ухудшению функции лёгких.
Лабораторная диагностика инфекции вызванной Pseudomonas aeruginosa:
• Культивирование на простых и селективных питательных средах (с цетавлоном, иргазином и налидиксовой кислотой) при 42 °С.
• Изучение биохимических свойств возбудителя.
• Серотипирование по полисахаридному (О) и жгутиковому (Н) антигену.
• Фаготипирование.
• Бактериоцинотипирование.
• Молекулярное типирование [гель-электрофорез в пульсирующем электрическом поле (PFGE)].
Лечение инфекции вызванной Pseudomonas aeruginosa. Для лечения применяют аминогликозиды, кар-бапенемы, уреидопенициллины, цефалоспорины широкого спектра действия или фторхинолоны. Некоторым штаммам возбудителя свойственна мультирезистентность.
Профилактика и контроль инфекции вызванной Pseudomonas aeruginosa. В настоящее время вакцинацию не считают эффективным методом профилактики синегнойных инфекций. Для предотвращения распространения мультирезистентных штаммов необходима изоляция инфицированных пациентов и уменьшение количества влажных предметов (тампоны, бельё и др.), способных быть источниками инфекции.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
ИНСТРУКЦИЯ
по медицинскому применению лекарственного препарата
Бактериофаг псевдомонас аэругиноза (синегнойный)
Торговое наименование препарата
Бактериофаг псевдомонас аэругиноза (синегнойный)
Лекарственная форма
раствор для приема внутрь, местного и наружного применения
Состав
Стерильный фильтрат фаголизатов бактерий Pseudomonas aeruginosa до 1 мл.
Описание
Препарат представляет собой прозрачную жидкость желтого цвета различной интенсивности.
Фармакотерапевтическая группа
Фармакодинамика:
Показания:
Лечение и профилактика заболеваний вызванных синегнойной палочкой (Pseudomonas aeruginosa) у взрослых и детей.
— заболевания уха горла носа дыхательных путей и легких (воспаления пазух носа среднего уха ангина фарингит ларингит трахеит бронхит пневмония плеврит);
— хирургические инфекции (нагноения ран ожоги абсцесс флегмона фурункулы карбункулы гидроаденит панариции парапроктит мастит бурсит остеомиелит);
— урогенитальные инфекции (уретрит цистит пиелонефрит кольпит эндометрит сальпингоофорит);
— энтеральные инфекции (гастроэнтероколит холецистит) дисбактериоз кишечника;
— генерализованные септические заболевания;
— гнойно-воспалительные заболевания новорожденных (омфалит пиодермия конъюнктивит гастроэнтероколит сепсис и др.);
— другие заболевания вызванные синегнойной палочкой.
При тяжелых проявлениях синегнойной инфекции препарат назначают в составе комплексной терапии.
С профилактической целью препарат используют для обработки послеоперационных и свежеинфицированных ран а также для профилактики внутрибольничных инфекций по эпидемическим показаниям.
Противопоказания:
Индивидуальная непереносимость гиперчувствительность к компонентам препарата.
Беременность и лактация:
Целесообразно применение препарата при наличии инфекций вызванных фагочувствительными штаммами синегнойной палочки (по рекомендации врача).
Способ применения и дозы:
Препарат используют для приема внутрь (через рот) ректального введения аппликаций орошений введения в полости ран вагины матки носа пазух носа и дренированные полости. Перед употреблением флакон с бактериофагом необходимо взболтать и просмотреть. Препарат должен быть прозрачным и не содержать осадка.
Рекомендуемые дозировки препарата.
Доза на 1 прием (мл)
от 1 года до 3 лет
Лечение гнойно-воспалительных заболеваний с локализованными поражениями должно проводиться одновременно как местно так и приемом препарата внутрь 2-3 раза в день за 1 ч до приема пищи с первого дня заболевания в течение 7-20 дней (по клиническим показаниям).
В случае если до применения бактериофага для лечения ран применялись химические антисептики рана должна быть тщательно промыта стерильным натрия хлорида раствором 09%.
В зависимости от характера очага инфекции бактериофаг применяют:
Применение бактериофага у детей (до 6 месяцев).
При сепсисе энтероколите новорожденных включая недоношенных детей бактериофаг применяют в виде высоких клизм (через газоотводную трубку или катетер) 2-3 раза в сутки в дозе 5-10 мл. При отсутствии рвоты и срыгивания возможно применение препарата через рот. В этом случае он смешивается с грудным молоком. Возможно сочетание ректального (в виде высоких клизм) и перорального (через рот) применения препарата. Курс лечения 5-15 дней. При рецидивирующем течении заболевания возможно проведение повторных курсов лечения. С целью профилактики сепсиса и энтероколита при внутриутробном инфицировании или опасности возникновения внутрибольничной инфекции у новорожденных детей бактериофаг применяют в виде клизм 2 раза в день в течение 5-7 дней.
При лечении омфалита пиодермии инфицированных ран препарат применяют в виде аппликаций ежедневно двукратно (марлевую салфетку смачивают бактериофагом и накладывают на пупочную ранку или на пораженный участок кожи).
Побочные эффекты:
Передозировка:
Симптомы передозировки меры по оказанию помощи при передозировке отсутствуют.
Взаимодействие:
Применение препарата возможно в сочетании с другими лекарственными средствами в том числе с антибиотиками.
Особые указания:
Важным условием эффективной фаготерапии является предварительное определение чувствительности возбудителя к бактериофагу и раннее применение препарата.
Не пригоден к применению препарат во флаконах с нарушенной целостностью или маркировкой при истекшем сроке годности при помутнении.
Вследствие содержания в препарате питательной среды в которой могут развиваться бактерии из окружающей среды вызывая помутнение препарата необходимо при вскрытии флакона соблюдать следующие правила:
— тщательно мыть руки;
— обработать колпачок спиртсодержащим раствором;
— снять колпачок не открывая пробки;
— не класть пробку внутренней поверхностью на стол или другие предметы;
— не оставлять флакон открытым;
— вскрытый флакон хранить только в холодильнике.
Вскрытие флакона и извлечение необходимого объема препарата может проводиться стерильным шприцем путем прокола пробки. Препарат из вскрытого флакона при соблюдении условий хранения вышеперечисленных правил и отсутствии помутнения может быть использован в течение всего срока годности.
Влияние на способность управлять трансп. ср. и мех.:
Форма выпуска/дозировка:
Раствор для приема внутрь местного и наружного применения.
Упаковка:
Условия хранения:
Хранение в соответствии с СП 3.3.2.1248-03 при температуре от 2 до 8 °С в недоступном для детей месте.
Транспортирование в соответствии с СП 3.3.2.1248-03 при температуре от 2 до 8 °С допускается транспортирование при температуре от 9 до 25 °С не более 1 месяца.
Срок годности:
Срок годности 2 года. Препарат с истекшим сроком годности применению не подлежит.
Условия отпуска
Производитель
Федеральное государственное унитарное предприятие «Научно-производственное объединение по медицинским иммунобиологическим препаратам «Микроген» Министерства здравоохранения Российской Федерации (ФГУП «НПО «Микроген» Минздрава России), 450014, Республика Башкортостан, г. Уфа, ул. Новороссийская, д. 105, Россия
Синегнойная инфекция
Синегнойная инфекция – это инфекционное заболевание, обусловленное инвазией синегнойной палочки. Является ведущей внутрибольничной инфекцией. Для хронических форм характерно поражение респираторного тракта с образованием «биологических пленок», для острого течения – бактериемия и поражение внутренних органов. Диагностика базируется на обнаружении возбудителя в биологических материалах больного. Лечение включает в себя этиотропную антибактериальную терапию, дезинтоксикационные средства, жаропонижающие и другие симптоматические препараты. В некоторых случаях показано хирургическое лечение.
МКБ-10
Общие сведения
Синегнойная инфекция впервые была описана в 1850 году французским хирургом Седилем. В 1882-м французскому военному фармацевту Жессару удалось выделить чистую культуру возбудителя, а в 1916 году стала известна эпидемиология данного заболевания. Болезнь распространена повсеместно, бактерий обнаруживают в почве, воде и на растениях. Четкая сезонность отсутствует. В стационарах излюбленной локализацией считается физиотерапевтическое и реанимационное оборудование. Группами риска являются недоношенные новорожденные, дети до 3-х месяцев, пожилые, пациенты отделений гемодиализа, химиотерапии, нейрохирургии и реанимации, больные с муковисцидозом и иммуносупрессией.
Причины
Возбудитель заболевания – синегнойная палочка (Pseudomonas aeruginosa) и её штаммы, представляет собой условно-патогенный микроорганизм, способный вызывать поражение только при отсутствии адекватного ответа иммунной системы. Источником инфекции служат больные люди и животные, бактерионосители, преимущественная локализация микроорганизма – кожа, кишечник. Заражение происходит воздушно-капельным и пищевым путем. Путь инфицирования при госпитальном заражении чаще контактный – через нестерильный инструментарий, руки медицинского персонала и предметы ухода за больными. Бактерия погибает при кипячении, во время автоклавирования, а также при воздействии 3% перекиси водорода и хлорсодержащих дезинфектантов.
Патогенез
При попадании микробов на поврежденную кожу или слизистую оболочку возникает массивная деструкция тканей, обусловленная воздействием экзотоксинов и продуцируемых бактериями веществ. В норме слизистая организма способна нивелировать воздействие синегнойной палочки ввиду мукоцилиарного клиренса и механического барьера. Привлечение нейтрофилов и активный фагоцитоз усиливают образование множества антибактериальных цитокинов, ферментов и свободных радикалов, служат активаторами системы комплемента и других звеньев гуморального иммунитета.
От 33 до 83% штаммов синегнойной палочки имеют эволюционно обусловленный механизм защиты от иммунной системы – образование биопленок, состоящих из скопления пораженных клеток и внеклеточного матрикса, включающего фибрин, секреторное отделяемое слизистых, альгинат, полисахариды и липиды. Известно, что бактерии лизируют нейтрофилы, усиливая рост собственных биопленок.
Классификация
Поражения, вызываемые синегнойной палочкой, можно условно разделить на местные и генерализованные (септические). Некоторые виды, в том числе инфекции ЦНС, сердца и средостения развиваются вследствие диссеминации возбудителя. В зависимости от топологии воспалительного очага различают следующие формы синегнойной инфекции:
Симптомы синегнойной инфекции
Инкубационный период патологии крайне вариабелен, может составлять от нескольких суток до десятилетий, поскольку микроорганизм является одним из условно-патогенных компонентов микрофлоры человека. Клинические проявления зависят от пораженного органа. У взрослых при инвазии пищеварительного тракта первыми симптомами являются лихорадка (не более 38,5° C), снижение аппетита, озноб, слабость, тошнота, реже рвота, вздутие и болезненность живота, частый кашицеобразный стул с кровью и слизью.
Маленькие дети при поражении ЖКТ становятся вялыми, сонливыми, отказываются от еды и питья, срыгивают, гастроэнтероколит протекает с высоким риском кишечного кровотечения. Синегнойная патология ЛОР-органов проявляется лихорадкой 37,5° C и выше, резкой болью в ухе, снижением слуха, желто-зеленым обильным отделяемым, иногда с примесью крови. Поражение дыхательного тракта протекает в форме пневмонии – с повышением температуры тела более 38° C, нарастающей одышкой, кашлем с обильной слизисто-гнойной мокротой.
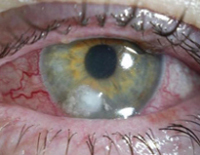
Псевдомонадная инфекция мочевыводящей системы характеризуется лихорадкой, болями в пояснице, частыми болезненными мочеиспусканиями, чувством неполного опорожнения мочевого пузыря, изменением цвета и запаха мочи. Глазные симптомы инвазии синегнойной палочки чаще выявляются в области одного глазного яблока, начинаются с появления рези, болей, чувства жжения, инородного тела, слезотечения, светобоязни и слизисто-гнойного обильного отделяемого. В дальнейшем может возникать снижение и помутнение зрения.
Поражение кожи проявляется высыпаниями в виде пятен и гнойничковых элементов по всему телу, включая сыпь на ладонях, подошвах и в носоглотке, увеличением лимфоузлов, постоянными головными болями (так называемая головная боль пловцов), зеленой окраской одной, реже двух ногтевых пластин, образованием болезненных уплотнений в подкожно-жировой клетчатке. Раневая инфекция возбудителя сопровождается появлением сине-зеленого гнойного отделяемого и гнойно-геморрагических корочек, увеличением зоны покраснения вокруг раны.
Осложнения
Мультисистемность и клиническое разнообразие симптомов синегнойной инфекции отражается на количестве осложнений данного состояния. К наиболее частым негативным последствиям относят генерализацию инфекционного процесса, инфекционно-токсический шок, у грудных детей – некротический колит. Высока вероятность абсцедирования и гангренозных изменений. Вялотекущее течение инфекции на слизистых уха, ротоглотки, носа, конъюнктивы и легких приводит к хронизации воспалительного процесса, формированию мезотимпанита, бронхоэктазов, ползучей язвы роговицы, частичной или полной глухоты, односторонней слепоты.
Диагностика
Диагноз выставляется на основании данных, полученных в ходе консультации инфекциониста. При возникновении обширных гнойных поражений обязательна консультация хирурга, по показаниям приглашаются другие профильные специалисты. Наиболее распространенными диагностическими методами подтверждения псевдомонадной этиологии болезни являются следующие инструментальные и лабораторные исследования:
Лечение синегнойной инфекции
Стационарное лечение рекомендуется пациентам с органными поражениями, среднетяжелым и тяжелым течением болезни. Больные с нозокомиальной синегнойной инфекцией продолжают лечение в том отделении, где находились до манифестации инфекционного процесса, с обязательным проведением всех противоэпидемических мероприятий и санацией аппаратуры. Постельный режим необходим до устойчивого купирования лихорадки в течение 3-5 дней, его продолжительность зависит от степени инвазии, наличия осложнений и декомпенсации сопутствующих болезней. Специальная диета не разработана, рекомендован прием пищи с достаточным количеством белка, адекватный питьевой режим.
Этиотропная терапия синегнойной инфекции осложняется наличием у микроорганизма природной резистентности к некоторым антибиотикам пенициллинового и тетрациклинового ряда, триметоприму, частично к цефалоспоринам, карбапенемам и аминогликозидам. Применение антибактериальных средств допускается в режиме монотерапии или комбинированного лечения с сочетанием нескольких групп препаратов, назначаемых местно и системно. Основными антибиотиками, используемыми для инактивации синегнойной инфекции, являются «защищенные» пенициллины, фторхинолоны, цефтазидим, цефепим, имипенем, полимиксин Е, гентамицин, амикацин.
Средствами борьбы с инфекцией считаются гипериммунная антисинегнойная донорская плазма и противосинегнойный гамма-глобулин, Перечисленные препараты применяются реже в связи с возможным развитием сывороточной болезни, показаны при вялотекущем воспалительном процессе. Симптоматическое лечение включает дезинтоксикационную терапию, противовоспалительные и жаропонижающие средства. Хирургическое вмешательство необходимо при локализованных и разлитых гнойных процессах, заключается во вскрытии и дренировании гнойников, реже – ампутации конечности. Допускается местное применение раствора перекиси водорода, мазей с антибиотиками.
Прогноз и профилактика
Прогноз всегда серьезный. Синегнойная палочка нередко составляет полимикробные ассоциации – с кандидами, стафилококками, клебсиеллами, что утяжеляет течение патологии. Летальность при органных поражениях составляет 18-61%, повышается в случае инвазии внутрибольничного штамма синегнойной палочки. Предикторами вероятного смертельного исхода являются способность возбудителя продуцировать экзотоксин U, мульти-антибиотикорезистентность и септический шок.
Специфическая профилактика (поливалентная вакцина) показана медицинским работникам, ожоговым больным, пациентам с открытыми переломами и глубокими ранами, лицам с иммунным дефицитом, людям старческого возраста. Неспецифические меры сводятся к строгому соблюдению правил обработки медицинских инструментов и оборудования, контролю контаминации синегнойной палочкой персонала. Важны общеукрепляющие методы – закаливание, нормальный сон, полноценная еда, прогулки, физическая активность, неукоснительное соблюдение личной гигиены и своевременная санация гнойных очагов.
Псевдомонас аэругиноза что это такое лечение
Согласно современным представлениям, Psudomonas aeruginosa (синегнойная палочка) является оппортунистическим патогеном, обитающим во влажных условиях окружающей среды, в т. ч. в почве, на поверхности водоемов и растений, включая употребляемые в пищу овощи [1]. Влажная среда является одним из основных резервуаров микроорганизма в лечебных учреждениях. P. aeruginosa выделяют из увлажнителей воздуха, респираторного оборудования, уретральных катетеров и других медицинских приборов и устройств. Зачастую он обитает в санузлах и на кухнях, а также в физиотерапевтических отделениях, где проводится лечение с применением водных процедур [1, 2].
P. aeruginosa относится к наиболее распространенным возбудителям нозокомиальных инфекций и значительно реже – внебольничных инфекций. Он редко вызывает заболевание у здоровых лиц. Фактором развития синегнойной инфекции является снижение защитных сил организма, особенно у пациентов с нейтропенией, муковисцидозом, ожогами, злокачественными новообразованиями, сахарным диабетом, иммуносупрессией, искусственными протезами и инородными телами, больных пожилого возраста, перенесших инструментальные, хирургические вмешательства и искусственную вентиляцию легких (ИВЛ), длительно госпитализированных и получающих антибиотикотерапию [2–4].
P. aeruginosa может поражать разные органы и ткани – легкие, сердце, мочеполовую систему и желудочно-кишечный тракт, кожу и мягкие ткани, центральную нервную систему и органы чувств. Наиболее распространенными синегнойными инфекциями являются пневмонии, инфекции мочевыводящих путей и кожи, а также бактериемия [2, 4].
Инфицирование обычно происходит из источников окружающей среды. Однако возможна и непосредственная передача инфекции от пациента к пациенту, особенно в условиях тесного контакта, например в центрах по лечению муковисцидоза и учреждениях санаторно-курортного типа [5, 6]. В редких случаях P. aeruginosa определяется на руках медицинского персонала, особенно пораженных грибковыми заболеваниями [7, 8].
Нозокомиальные инфекции, обусловленные P. aeruginosa, ассоциируются с высоким уровнем смертности, значительно превышающим таковой для инфекций, вызванных другими бактериальными патогенами [3]. Например, у пациентов с нозокомиальной пневмонией он составляет 30–75 % [4].
Нозокомиальные инфекции являются одной из наиболее актуальных проблем современной медицины. Они относятся к важным факторам заболеваемости и смертности населения и влекут за собой серьезные социальные и экономические проблемы. Так, в США ежегодно регистрируется более 2 млн нозокомиальных инфекций [9]. Cвязанные с ними финансовые расходы достигают 30 млрд долл. в год [11]. Стоимость каждого случая заболевания оценивается центрами по контролю и профилактике заболеваний (CDC) в среднем в 2100 долл. (от 680 для инфекций мочевыводящих путей до 5683 для респираторных инфекций) [12]. В России, согласно официальным данным, в 1997 г. зарегистрировано 56 тыс. случаев нозокомиальных инфекций, но предполагают, что их истинное количество составило примерно 2,5 млн [13].
Несмотря на противоречивость литературных данных, большинство авторов считают, что нозокомиальные инфекции чаще встречаются у взрослых пациентов, чем у детей [14]. Однако в целом дети, особенно новорожденные, отличаются повышенной восприимчивостью к ним [15]. Кроме того, существует ряд специфических факторов, способствующих возникновению и распространению нозокомиальных инфекций в педиатрии. К ним относятся более тесный и частый контакт детей и медицинских работников, обусловленный особенностями ухода за педиатрическими пациентами (например, кормление и пеленание), особенности анатомического строения и иммунного статуса детей, врожденные аномалии, способствующие нарушению анатомических барьеров, наличие дополнительных источников инфицирования, таких как мочеполовой тракт матери, повышенная чувствительность к некоторым патогенам (например, к вирусу Varicella zoster и парвовирусу) и социальные взаимодействия, которые увеличивают риск передачи инфекции (например, посещение игровых комнат) [16]. Одним из важных факторов развития нозокомиальных инфекций является предшествующая антибиотикотерапия [17–19]. При этом количество назначений антибиотиков, в т. ч. необоснованных, детям значительно превышает их число у взрослых [20].
Частота нозокомиальных инфекций в педиатрии колеблется в зависимости от возраста ребенка, типа и отделения стационара. Она зависит от исходного диагноза и наличия сопутствующих заболеваний. По данным зарубежных исследований, частота нозокомиальных инфекций у детей варьирует от 0,2 до 25 % [21–23]. В многоцентровом европейском исследовании она составила 2,5 % [24]. Наиболее часто нозокомиальные инфекции наблюдались у детей, находящихся в отделениях интенсивной терапии (23,5 %), гематологических отделениях (8,2 %) и отделениях новорожденных (7 %). Самая низкая частота нозокомиальных инфекций отмечена в педиатрических отделениях общего профиля (1 %).
Наиболее подвержены нозокомиальным инфекциям дети в возрасте до 23 месяцев [24]. В отделениях интенсивной терапии новорожденных в США частота нозокомиальных инфекций составляет 15–20 % [25, 26]. Она особенно высока у детей с низким весом при рождении, достигая у недоношенных с массой тела менее 1100 г 40–60 % [26].
Изучение 100 нозокомиальных инфекций в педиатрии (г. Торонто, Канада) показало, что стоимость нозокомиальной инфекции в расчете на 1 пациента составляет 12 тыс. долл. [27]. У 40 % детей нозокомиальная инфекция приводила к удлинению срока госпитализации и необходимости выполнения инвазивных процедур. Летальные исходы наблюдались у 11 % пациентов.
Локализация и типы возбудителей нозокомиальных инфекций у детей отличаются от таковых у взрослых [16]. Наиболее распространенными в педиатрии являются желудочно-кишечные (10–35 %) и респираторные инфекции (5–30 %), а также бактериемия (10–23 %) [14]. У взрослых пациентов лидирующее положение занимают инфекции мочевыводящих и дыхательных путей [31]. В этиологической структуре нозокомиальных заболеваний у детей значительное место принадлежит вирусам (22–27 %) [14], в то время как у взрослых нозокомиальные вирусные инфекции встречаются редко. Грамположительные бактерии обусловливают 31–50 % случаев нозокомиальных инфекций в педиатрии, грамотрицательные – 23–35 % [14].
Так же, как и у взрослых, одним из наиболее “проблемных” возбудителей в педиатрии является Pseudomonas aeruginosa. По данным одного из исследований, проведенного в педиатрическом отделении интенсивной терапии в Барселоне (Испания), этот микроорганизм обусловливал 24 % всех нозокомиальных инфекций и занимал второе место по частоте после коагулазонегативных стафилококков [32]. Результаты эпидемиологических исследований последних лет свидетельствуют о возрастании этиологического значения мультирезистентных штаммов P. aeruginosa как у взрослых пациентов, так и у детей [33–36].
Лечение синегнойной инфекции является достаточно сложной проблемой, что связано с рядом причин. Повреждение тканей, вызываемое P. aeruginosa, имеет сложный механизм и обусловлено продукцией цитотоксинов, эндотоксинов, гемолизинов и протеаз [3]. Выживанию и репликации P. aeruginosa в человеческих тканях и медицинских приборах способствует наличие биопленки, которая защищает микроорганизм от антител и фагоцитов хозяина и способствует приобретению антибиотикоустойчивости. Кроме того, P. aeruginosa имеет фимбрии и другие приспособления, облегчающие адгезию к эпителиальным клеткам дыхательных путей, что, в свою очередь, обусловливает высокую частоту колонизации, наблюдающуюся у госпитализированных пациентов. Выбор антибиотика также затрудняют различия между штаммами P. aeruginosa, наличие или отсутствие протективной мукоидной капсулы и способность возбудителя приобретать устойчивость в период лечения [3].
За последние 20 лет были достигнуты значительные успехи в борьбе с синегнойной инфекцией, что обусловлено, прежде всего, разработкой большого числа антибиотиков с мощной активностью in vitro в отношении P. aeruginosa. К их числу относятся цефалоспорины III и IV поколений, уреидопенициллины, монобактамы, карбапенемы и фторхинолоны. К сожалению, при монотерапии псевдомонадных инфекций, особенно вызванных мультирезистентными штаммами, не всегда удается достичь благоприятных исходов лечения. К недостаткам монотерапии относится и частое развитие резистентности у возбудителя.
Это послужило основанием для применения комбинаций антибиотиков. Общепринятой комбинацией во всем мире является сочетание бета-лактама с аминогликозидом. Основанием для применения данной комбинации при синегнойных инфекциях стало, прежде всего, наличие синергизма между этими группами препаратов, продемонстрированное in vitro [3]. В то же время результаты нескольких исследований у пациентов с бактериемией, вызванной грамотрицательными микроорганизмами, позволяют предположить, что комбинации антибиотиков, которые проявляли синергическое действие in vitro, оказывают и более выраженный терапевтический эффект, чем комбинация препаратов, не производящая такого действия.
Идея возможности комбинации аминогликозидов с бета-лактамными антибиотиками возникла в “эру карбенициллина”, когда была отмечена устойчивость к данному препарату у штаммов P. aeruginosa, выделяемых преимущественно из мочи [3]. В настоящее время эта идея приобрела статус догмы, хотя следует отметить, что число адекватно проведенных клинических исследований недостаточно для того, чтобы доказать или опровергнуть эту гипотезу [3]. Кроме того, помимо антибиотикотерапии исход лечения инфекций, вызванных P. aeruginosa, в значительной степени зависит и от защитных механизмов хозяина (например, наличия иммуносупрессии, нейтропении).
Начиная с 1960-х гг. P. aeruginosa является важным возбудителем нозокомиальной пневмонии у взрослых и детей. Риск развития пневмонии, вызванной P. aeruginosa, особенно высок у пациентов, подвергшихся ИВЛ, госпитализированных в отделения интенсивной терапии, страдающих раком с нейтропенией и у больных с иммунодефицитом [3, 37]. Риск инфицирования P. aeruginosa и другими мультирезистентными микроорганизмами наиболее высок у пациентов, перенесших ИВЛ, особенно при поздней вентилятороассоциированной пневмонии, развивающейся более чем через 3 дня после проведения процедуры.
Госпитализированные ВИЧ-инфицированные пациенты имеют повышенный риск псевдомонадной пневмонии по сравнению с другими иммунокомпрометированными больными, а ее развитие во внебольничных условиях у внешне здорового пациента требует немедленного тестирования на ВИЧ-инфекцию [38].
С начала 1980-х гг. постоянно растет частота пневмонии, вызванной P. aeruginosa. В настоящее время в США этот микроорганизм вышел на первое место среди всех этиологических факторов нозокомиальной пневмонии у взрослых [39].
Этиологическая структура нозокомиальных пневмоний в педиатрии отличается от таковой у взрослых. Чаще всего пневмония является следствием аспирации микроорганизмов, колонизирующих верхние дыхательные пути, поэтому в большинстве случаев заболевания органов дыхания у детей имеют вирусную этиологию. Среди бактериальных возбудителей преобладают грамотрицательные микроорганизмы (Escherichia coli, Klebsiella pneumoniae, Pseudomonas aeruginosa), которые ассоциируются с наиболее высоким уровнем летальности [40].
Монотерапия пневмонии, вызванной P. aeruginosa, как правило, не позволяет достичь удовлетворительных клинических и бактериологических результатов. Например, в проспективном рандомизированном двойном слепом исследовании у взрослых пациентов с нозокомиальной пневмонией, обусловленной P. aeruginosa, бактериологическая неудача при монотерапии ципрофлоксацином или имипенемом зарегистрирована примерно в 60 %, случаев [41]. Кроме того, на фоне монотерапии обоими препаратами отмечалось возникновение антибиотикорезистентности примерно у 40 % пациентов. Для лечения пневмоний в педиатрии фторхинолоны не рекомендованы в связи с риском артропатий.
Стандартным подходом для лечения пневмоний, вызванных P. aeruginosa, у взрослых и детей в настоящее время является назначение комбинации антипсевдомонадного бета-лактама и аминогликозида (рекомендуемые препараты и их дозы указаны в таблице). В проспективном обсервационном исследовании данная комбинация позволяла значительно увеличить выживаемость по сравнению с монотерапией [42]. Поскольку в России наблюдается высокий уровень устойчивости грамотрицательных возбудителей нозокомиальных инфекций к гентамицину [43, 44], среди аминогликозидов предпочтение следует отдавать амикацину.
Отличительной особенностью амикацина является значительно более высокая устойчивость к аминогликозид-модифицирующим ферментам, в связи с чем штаммы, резистентные к другим аминогликозидам, в большинстве случаев сохраняют к нему чувствительность. По данным американских авторов, за последние 10 лет не было отмечено значимого роста резистентности к амикацину даже при его интенсивном и эксклюзивном применении [45]. По результатам исследований, проводимых в разных областях России, амикацин также является одним из самых активных антибиотиков в отношении грамотрицательных бактерий [43, 44]. Кроме того, он лучше переносится, чем ряд других аминогликозидов. Экспериментальные данные позволяют предположить, что амикацин имеет меньшее сродство к почечным проксимальным канальцам по сравнению с большинством других аминогликозидов [45]. Ограничивает применение амикацина его более высокая цена по сравнению с гентамицином, однако стоимость лечения можно снизить, применяя его дженериковые препараты.
Комбинацию бета-лактамов с аминогликозидами также рекомендуют использовать в качестве начальной терапии при нозокомиальной пневмонии всем ослабленным детям с сопутствующими заболеваниями. У детей с иммунодефицитом для эмпирической терапии нозокомиальной пневмонии педиатры рекомендуют комбинацию цефалоспоринов III–IV поколений с нетилмицином или амикацином [46]. Этой же комбинации советуют отдавать предпочтение и при поздней вентилятороассоциированной пневмонии у детей [46].
Синегнойная инфекция играет большую роль у больных муковисцидозом. К концу второго десятилетия легкие большинства пациентов с этим заболеванием колонизированы P. aeruginosa [47]. “Агрессивная” антибиотикотерапия позволяет отсрочить развитие хронической синегнойной инфекции и удлинить продолжительность жизни пациентов [48, 49]. За последние 40 лет благодаря внедрению в медицинскую практику новых эффективных антибиотиков прогноз у данной категории больных значительно улучшился: если в 1960-х гг. средний возраст выживающих пациентов составлял 6 лет, то в настоящее время он превышает 30 лет [50]. В США частоту колонизации P. aeruginosa у детей и подростков с муковисцидозом удалось снизить с 60 до 30–40 % [51, 52].
На основании имеющихся в настоящее время данных клинических исследований в качестве терапии первой линии при обострениях, вызванных P. aeruginosa, рассматривается комбинация антипсевдомонадного бета-лактама с аминогликозидом [52]. В двойном слепом рандомизированном исследовании добавление тобрамицина к азлоциллину позволяло достичь более длительной ремиссии у детей с легочным обострением муковисцидоза [53]. В другом исследовании комбинации амикацина с азтреонамом, пиперациллином или тикарциллином оказывали ингибирующее действие даже на амикацин-резистентные штаммы P. aeruginosa, выделенные из слюны детей с муковисцидозом [54].
В настоящее время внутривенная антибиотикотерапия при муковисцидозе обычно проводится в стационарах в течение нескольких недель, что сопряжено со значительными финансовыми затратами [55]. Однако существует опыт ее применения в домашних условиях. Наряду со значительным снижением стоимости лечения такая терапия позволяет улучшить качество жизни пациента в период лечения [55, 56].
Для парентерального лечения в амбулаторных условиях наиболее удобны препараты, которые можно вводить 1 раз в день. В ряде клинических исследований показано, что однократное введение полной суточной дозы аминогликозида не уступает по эффективности при муковисцидозе его трехкратному введению [58]. Эффективность и безопасность однократной суточной дозы аминогликозидов у взрослых доказана в многочисленных клинических исследованиях и подтверждена результатами мета-анализа [59].
Недавно проведенный мета-анализ, включавший 24 клинических исследования, в т. ч. 3 исследования у больных муковисцидозом, продемонстрировал эффективность и безопасность однократной суточной дозы аминогликозидов у детей [60]. В 11 из этих исследований был использован гентамицин, в 9 – амикацин, в 2 – тобрамицин, в 2 – нетилмицин, в 1 – тобрамицин и в 1 – нетилмицин.
Также P. aeruginosa выделяется в среднем у 4 % пациентов с обострением хронического обструктивного заболевания легких, причем у больных с выраженной обструкцией дыхательных путей частота его выделения повышается до 8–13 % [61].
P. aeruginosa является достаточно частым этиологическим фактором инфекционного эндокардита, особенно у пациентов с искусственным клапаном или с внутрисосудистым инородным телом, со злокачественными новообразованиями, длительной нейтропенией, у получающих химиотерапию, а также у наркоманов, употребляющих наркотики внутривенно [62]. Исход лечения инфекционного эндокардита зависит от своевременности начала интенсивной терапии. Схемой выбора для большинства случаев этого заболевания остается комбинация аминогликозида с бета-лактамом [3]. Для эмпирической терапии некоторые авторы предлагают комбинацию из трех антибиотиков: бета-лактам + аминогликозид + гликопептид.
При мочеполовых инфекциях P. aeruginosa может выступать в качестве этиологического фактора у пациентов, перенесших инструментальные вмешательства, прежде всего катетеризацию, у больных с хроническим простатитом или почечными камнями, а также у получавших недавно антибиотики [3]. По данным многоцентрового исследования грамотрицательных возбудителей нозокомиальных инфекций, в отделениях интенсивной терапии и реанимации России на долю P. aeruginosa приходилось 18 % всех выделенных штаммов [63].
При отсутствии симптомов инфекции пациентам с постоянным катетером антибиотики не показаны. Антибактериальная терапия в этом случае может привести к замещению P. aeruginosa другим микроорганизмом, резистентным к препарату, или возникновению резистентного штамма P. aeruginosa [3]. Антибиотики системного действия следует назначать лишь больным с лихорадкой или признаками сепсиса. При уросепсисе рекомендуется 10-дневное назначение комбинации b-лактама с антисинегнойной активностью и аминогликозида [3]. У пациентов с пиелонефритом продолжительность лечения должна составлять 2–3 недели, с интраренальным или перинефрическим абсцессом – 4–6 недель [3].
Инфекции костно-суставной системы, вызванные P. aeruginosa, обычно имеют внебольничное происхождение и наблюдаются относительно редко. В частности, гематогенный остеомиелит после транзиторной бактериемии, обусловленной P. aeruginosa, может развиться у наркоманов, принимающих наркотики внутривенно [3]. У больных сахарным диабетом встречается суперфенкция язв стопы, возможно попадание P. aeruginosa в организм через колотые раны стопы.
Антибиотикотерапия при костных поражениях обычно сочетается с хирургическим лечением. В качестве препаратов первой линии традиционно рассматривается комбинация бета-лактама с антисинегнойной активностью и аминогликозида. При отсутствии сахарного диабета и сосудистых заболеваний достаточным по продолжительности является 4-недельный курс антибиотикотерапии [3].
Поражения кожи и мягких тканей, вызванные P. aeruginosa, были впервые описаны в конце XIX века как осложнения хирургических и боевых ран [64]. В прошлом веке самая высокая частота синегнойных кожных инфекций наблюдалась при проведении боевых действий в тропических и влажных зонах, особенно во Вьетнаме [64].
Сухая интактная кожа является мощным барьером для P. aeruginosa. Развитию синегнойной инфекции способствует термическое, химическое или электрическое поражение, особенно у пациентов, получающих сульфаниламиды [64]. Это обусловливает широкое распространение P. aeruginosa в ожоговых центрах.
P. aeruginosa может вызывать различные типы кожных инфекций, включая узелковые подкожные повреждения, фолликулит, целлюлит и пиодермию, поражение ногтей на пальцах ног (синдром зеленых ногтей), паронихии [64]. В зависимости от локализации и тяжести процесса для лечения применяют местные антибактериальные и антисептические средства или системные антибиотики. В ряде случаев консервативную терапию сочетают с хирургическим лечением.
Как уже отмечалось выше, синегнойная инфекция достаточно часто развивается у больных с тяжелыми ожогами, особенно поражающими большие поверхности тела с разрушением кожных структур и глубоким некрозом тканей. В эпидемиологическом исследовании в Турции, включавшем 610 детей в возрасте до 15 лет, поступавших в ожоговое отделение одной из больниц в течение 5 лет, у 207 (33,9 %) пациентов было диагностировано 279 нозокомиальных инфекций. P. aeruginosa оказался самым распространенным возбудителем и был выявлен в 181 случае [65].
Для профилактики инфекции в ожоговой ране часто назначают местные антибактериальные средства, например сульфасалазин серебра или нитрат серебра [64]. Антисинегнойной активностью также обладает мафенид. Его преимуществом перед сульфасалазином или нитратом серебра является способность проникать глубоко в ожоговый струп. Важной процедурой, предотвращающей распространение инфекции, является хирургическая обработка раны. При выраженных симптомах инфекции, в т. ч. бактериемии, показана интенсивная терапия инъекционными антибиотиками – комбинацией b-лактама и аминогликозида. Выбор конкретного препарата по возможности должен основываться на результатах теста на чувствительность, так как нозокомиальные штаммы возбудителя в ожоговых центрах часто бывают мультирезистентными. В этой связи среди аминогликозидов предпочтение следует отдавать амикацину. При этом следует помнить, что фармакокинетика антибиотиков у больных с обширными ожогами может подвергаться значительным изменениям, однако риск передозировки и связанной с нею токсичности у таких пациентов, как правило, меньше, чем риск недостаточной терапии [64].
Синегнойные инфекции мягких тканей особенно опасны у иммунокомпрометированных больных. Серьезным кожным проявлением инфекции, обусловленной P. aeruginosa, является гангренозная эктима [64]. Она часто ассоциируется с бактериемией и сепсисом. Кожные симптомы могут быть первым проявлением системной инфекции. У пациентов с нейтропенией и сахарным диабетом описан некротизирующий фасцилит [66]. Изначально инфекция может локализоваться на слизистой оболочке полости рта, откуда она распространяется в подкожные ткани и кровь. Быстрое прогрессирование до стадии гангрены требует незамедлительного хирургического вмешательства [66]. Также назначается комбинация антипсевдомонадных средств, часто проводится трансфузия лейкоцитов или колонийстимулирующих факторов. Уровень летальности при некротизирующих поражениях мягких тканей остается высоким даже при применении агрессивной терапии [64].
Инфекции желудочно-кишечного тракта, вызванные P. aeruginosa, преимущественно наблюдаются у иммунокомпрометированных лиц, особенно часто у детей до 6 месяцев и пациентов с гематологическими злокачественными заболеваниями и/или нейтропенией [3]. Язвенные поражения ротоглотки, миндалин и слизистой оболочки ротовой полости могут имитировать дифтерию. Распространение ульцеративных изменений в глубину с захватом мышечного и серозного слоев может приводить к перфорации, перитониту и бактериемии. У детей синегнойная инфекция желудочно-кишечного тракта достаточно часто проявляется диарейным синдромом. В возрасте до 6 месяцев задокументированы случаи некротизирующего энтероколита [3]. При всех гастроинтестинальных инфекциях, вызванных P. aeruginosa, следует назначать системные антибиотики. При некрозе кишечника, перфорации, обструкции и абсцессе антибиотикотерапию сочетают с хирургическим лечением [3].
P. aeruginosa является наиболее часто выделяемым микроорганизмом при наружном отите и встречается в настоящее время почти у 50 % пациентов [67]. Напротив, в 1950-х гг. самым частым возбудителем этого заболевания были стафилококки. Подобное изменение этиологической структуры может быть следствием частого назначения антибиотиков широкого спектра действия [64]. Также продемонстрировано наличие корреляции между присутствием P. aeruginosa в водоеме и развитием отита у купающихся [68]. В большинстве случаев наружного отита достаточно провести местную терапию. В двойном слепом исследовании показано, что антисептик алюминия ацетат, который инактивирует P. aeruginosa in vitro, по клинической эффективности не уступает гентамицину [69].
При злокачественном наружном отите, когда в процесс вовлекаются височная кость и основание черепа, требуется назначение системных антибиотиков, обычно комбинации антипсевдоионадных препаратов, которая вводится на протяжении 4–10 недель (в зависимости от тяжести процесса) [64]. К счастью, данная инфекция практически не встречается у детей. Основным предрасполагающим фактором ее развития является сочетание пожилого возраста и сахарного диабета. Внутривенная антипсевдомонадная терапия необходима и госпитализированным пациентам с хроническим гнойным средним отитом [70, 71].
Поражения глаз, вызываемые P. aeruginosa, могут носить молниеносный характер и приводить к быстрому разрушению внутриглазных структур, вызывая слепоту. Развитию инфекции, как правило, предшествуют травма роговицы, ношение контактных линз или серьезное системное заболевание [72]. Общепринятым методом лечения является применение высококонцентрированных препаратов аминогликозидов и цефалоспоринов для местного использования. Для достижения терапевтических концентраций в водянистой влаге антибиотики необходимо вводить часто – каждые 15–30 минут в течение первых 2 суток [64]. В наиболее тяжелых случаях сочетают местное и субконъюнктивальное введение антибиотиков.
Инъекционные антибиотики в сочетании с местным, субконъюнктивальным и внутриглазным введением антибактериальных средств показаны при синегнойном эндофтальмите, который отличается острым и молниеносным течением. К развитию эндофтальмита могут приводить язвы роговицы, проникающая травма, офтальмологические хирургические вмешательства или бактериемия.
В целом бактериемия, вызванная P. aeruginosa, встречается достаточно часто как у взрослых, так и у детей. В 10-летнем эпидемиологическом исследовании, проведенном в 1700-коечной больнице в Италии, частота бактериемии, обусловленной P. aeruginosa, составила в целом 0,94 на 1000 госпитализаций, а у больных, поступивших в отделения интенсивной терапии – 24,7 на 1000 [73]. Смертность составила 31 %.
Проспективное 6-летнее исследование, проведенное в одном из педиатрических центров Израиля, показало, что P. aeruginosa встречается в 20 % случаев грамотрицательной бактериемии [74]. Бактериемия, вызванная P. aeruginosa, сопряжена с самой высокой смертностью, которая, по результатам 10-летнего ретроспективного исследования в педиатрическом центре в Германии, составила 45 % [75].
Большинство авторов для лечения грамотрицательной бактериемии, особенно вызванной P. aeruginosa, рекомендуют комбинированную терапию, включающую бета-лактам с антисинегнойной активностью и аминогликозид [64, 74]. Анализ клинических исследований, проведенный в США, также показал, что при грамотрицательной бактериемии, вызванной P. aeruginosa, Klebsiella spp. и Enterobacter spp., комбинированная терапия превосходит по эффективности монотерапию [76].
У интубированных новорожденных, особенно с респираторными инфекциями и инфекциями ЦНС, P. aeruginosa является основным этиологическим фактором сепсиса [77]. Для лечения рекомендуется тикарциллин/клавуланат в дозе 100 мг/кг 3 раза в сутки. В странах с тропическим климатом P. aeruginosa может вызывать и внебольничный сепсис у ранее здоровых детей [78]. Как и при нозокомиальных инфекциях, для его терапии применяют комбинацию антипсевдомонадного бета-лактама и аминогликозида.
В редких случаях P. aeruginosa является причиной менингита. Смертность при данном заболевании высокая, особенно в случаях, когда инфекция возникает в результате бактериемии у иммунокомпрометированного хозяина, у пациентов с эндокардитом или злокачественным наружным отитом. Когда менингит развивается в результате нейрохирургических процедур, вероятность излечения выше [64].
Препаратом выбора в этих ситуациях является цефтазидим, что определяется его высокой активностью в отношении P. aeruginosa и хорошим проникновением через гематоэнцефалический барьер. Обычно для получения синергического эффекта и с целью профилактики резистентности к цефтазидиму его комбинируют с аминогликозидом. Поскольку аминогликозиды плохо проникают через гематоэнцефалический барьер, иногда наряду с внутривенным введением может понадобиться их интратекальное или интравентрикулярное введение [64]. Альтернативой цефтазидиму могут быть карбапенемы, однако имипенем в высоких дозах, которые необходимы для лечения инфекций ЦНС, может оказывать нейротоксический эффект, включая судороги, поэтому предпочтение следует отдавать меропенему.
Как уже указывалось выше, к главным факторам риска развития синегнойной инфекции относится нейтропения. По результатам анализа данных 44 клинических и 53 эпидемиологических исследований, у онкологических больных P. aeruginosa выделяется в 1–2,5 % случаев при первом эпизоде нейтропенической лихорадки и в 5–12 % случаев микробиологически задокументированной инфекции [79]. При этом не было показано значимых различий в частоте синегнойной инфекции между онкологическими пациентами с нейтропенией и без нее, между больными с солидными опухолями и гематологическими новообразованиями, между амбулаторными и госпитализированными пациентами.
Наиболее широко применяемой комбинацией является сочетание антипсевдомонадного цефалоспорина III поколения цефтазидима с амикацином. Однако трехкратное введение цефтазидима в день неудобно как для медицинского персонала, так и для пациентов. С целью упрощения режима терапии в клинических исследованиях у онкологических больных с нейтропенией были изучены другие антибиотики. Особое внимание с этой точки зрения привлекает цефтриаксон. Это объясняется наличием у препарата широкого спектра антибактериальной активности, хорошей переносимостью и благоприятных фармакокинетических свойств. Цефтриаксон имеет самый длительный период полувыведения (8,5 часов у взрослых и от 5 до 18 часов у детей) и практически полную биодоступность при внутримышечном введении, он очень хорошо проникает в ткани, в т. ч. через гематоэнцефалический барьер, выводится из организма с мочой и желчью, в связи с чем требует коррекции дозы только при одновременной почечной и печеночной недостаточности [81]. Концентрации цефтриаксона примерно в 60 тканях и жидкостях, включая легкие, сердце, желчные пути, печень, миндалины, среднее ухо и слизистую оболочку носа, кости, спинномозговую, плевральную и синовиальную жидкости, секрет предстательной железы, более чем на протяжении суток намного превышают минимальные подавляющие для большинства чувствительных микроорганизмов.
Эффективность эмпирического лечения нейтропенической лихорадки с применением однократных суточных доз цефтриаксона и амикацина была показана в ряде пилотных исследований [82–87]. Их результаты послужили основанием для проведения крупных многоцентровых исследований.
В рандомизированном многоцентровом исследовании IATCG-EORTC, включавшем 694 эпизодов инфекций, в т. ч. 205 микробиологически задокументированных, 170 из которых были бактериемиями, показана равная эффективность комбинаций цефтриаксона с аминогликозидом и цефтазидима с аминогликозидом: соответственно 68 против 70 % у пациентов высокого риска с гематологическими злокачественными заболеваниями, 83 против 89 % у больных низкого риска с солидными опухолями, 53 против 57 % при микробиологически задокументированных инфекциях, 50 против 51 % при бактериемии, 78 против 76 % при клинически задокументированных инфекциях, 79 против 85 % при лихорадке неизвестного происхождения [88]. Смертность была одинаковой в обеих группах и составила 11 %.
Аналогичные результаты были получены и рандомизированном многоцентровом исследовании у детей [89]. В оценку эффективности было включено 364 из 468 эпизодов (100 из которых были доказаны микробиологически) у 265 детей с нейтропенией. Эффективность комбинаций цефтриаксона с амикацином и цефтазидима с амикацином составила соответственно в целом по терапевтическому ответу 66 против 66 %, при микобиологически задокументированной инфекции – 53 против 41 %, при клинически задокументированной инфекции – 57 против 63 %, при лихорадке неизвестного происхождения – 79 против 79 %. Смертность составила 1,1 % (2 смерти) в группе цефтриаксона и 0,6 % (1 смерть) в группе цефтазидима. Стоимость лечения в сутки при применении цефтриаксона составила 162 долл., цефтазидима – 244 долл. Таким образом, при равной эффективности режим с использованием однократной дозы цефтриаксона в сутки оказался более экономичным. Более того, удобство применения комбинации цефтриаксона и амикацина позволяет рекомендовать ее для лечения нейтропенической лихорадки у ряда больных в амбулаторных условиях, что приводит как к значительному снижению расходов на лечение, так и улучшению качества жизни пациентов [90, 91]. Однако эффективность комбинации цефтриаксона с аминогликозидом при задокументированной синегнойной инфекции у больных с нейтропенией требует доказательств в адекватных клинических исследованиях.
У ВИЧ-инфицированных пациентов P. aeruginosa может вызывать инфекции различной локализации. Для их лечения применяют стандартную терапию комбинацией антипсевдомонадного бета-лактамного антибиотика и аминогликозида, однако и в этом случае у данной категории часто развиваются резистентность и рецидивы, даже когда проведенный курс лечения представляется успешным [92]. При рецидиве следует искать нераспознанный источник инфекции (синус, кости, абсцесс).
Таким образом, несмотря на успехи в антибактериальной терапии, достигнутые за последние десятилетия, P. aeruginosa остается одним из наиболее проблематичных возбудителей нозокомиальных и внебольничных инфекций. На сегодняшний день общепринятым лечением при большинстве локализаций инфекции считается комбинация антипсевдомонадного бета-лактама и аминогликозида. Продолжающиеся клинические исследования направлены на определение наиболее эффективных методов лечения синегнойной инфекции. В частности, ведется поиск препаратов, способных снизить патогенность возбудителя путем угнетения адгезии и продукции факторов вирулентности [93]. Одним из основных направлений новых разработок является предотвращение колонизации дыхательных путей. В этом отношении большие надежды связывают со специфической антисинегнойной вакциной [94].
Важной мерой профилактики нозокомиальных инфекций, вызванных P. aeruginosa, и распространения мультирезистентных штаммов является строгое соблюдение правил инфекционного контроля в медицинских учреждениях, в т. ч. надлежащая стерилизация оборудования, мытье рук после осмотра пациента, изоляция больных и предупреждение необоснованных назначений антибиотиков [2].