Прпо при беременности что это
Преждевременный разрыв околоплодной оболочки. Можно ли сохранить ребёнка?
» data-image-caption=»» data-medium-file=»https://i2.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2018/05/prezhdevremennyiy-razryiv-plodnoy-obolochki.jpg?fit=450%2C300&ssl=1″ data-large-file=»https://i2.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2018/05/prezhdevremennyiy-razryiv-plodnoy-obolochki.jpg?fit=825%2C550&ssl=1″ />
Преждевременный разрыв околоплодной оболочки диагностируется у каждой 10-й беременной. Это серьёзная патология, приводящая в 20% случаев к потере малыша. Однако своевременная госпитализация и регулярное посещение гинеколога позволят избежать плачевного результата, даже если разрыв произошёл в середине беременности, когда до родов ждать ещё очень долго.
преждевременный разрыв плодной оболочки
» data-image-caption=»» data-medium-file=»https://i2.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2018/05/prezhdevremennyiy-razryiv-plodnoy-obolochki.jpg?fit=450%2C300&ssl=1″ data-large-file=»https://i2.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2018/05/prezhdevremennyiy-razryiv-plodnoy-obolochki.jpg?fit=825%2C550&ssl=1″ loading=»lazy» src=»https://i2.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2018/05/prezhdevremennyiy-razryiv-plodnoy-obolochki-825×550.jpg?resize=790%2C527″ alt=»преждевременный разрыв плодной оболочки» width=»790″ height=»527″ srcset=»https://i2.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2018/05/prezhdevremennyiy-razryiv-plodnoy-obolochki.jpg?resize=825%2C550&ssl=1 825w, https://i2.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2018/05/prezhdevremennyiy-razryiv-plodnoy-obolochki.jpg?resize=450%2C300&ssl=1 450w, https://i2.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2018/05/prezhdevremennyiy-razryiv-plodnoy-obolochki.jpg?resize=768%2C512&ssl=1 768w, https://i2.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2018/05/prezhdevremennyiy-razryiv-plodnoy-obolochki.jpg?w=895&ssl=1 895w» sizes=»(max-width: 790px) 100vw, 790px» data-recalc-dims=»1″ />
В 44% случаев разрыв околоплодных оболочек не сопровождается излитием околоплодных вод, и в этом случае шансы сохранить жизнь ребёнку велики.
Кому грозит разрыв плодной оболочки
От преждевременного разрыва плодной оболочки не застрахована ни одна беременная женщина. Точная причина этого явления пока неизвестна, однако существуют предпосылки для возникновения патологии. В группу риска входят женщины с истмико-цервикальной недостаточностью, различными патологиями шейки матки (гиперплазия, эрозия), имеющие скрытые ТОРЧ-инфекции.
Оболочка плода служит для защиты от механических повреждений и от различных бактерий и вирусов. Она состоит из трёх слоёв:
Все три слоя обеспечивают абсолютную стерильность, поэтому даже микроскопическая трещинка будет способствовать проникновению болезнетворных инфекций из влагалища и шейки матки.
Можно ли вылечить патологию?
Если разрыв околоплодной оболочки произошел в тот период, когда аборт уже запрещён, а роды ещё не возможны, женщина проходит курс лечения, состоящий из трёх составляющих:
Диагностика излития околоплодных вод и прогноз жизнеспособности плода
Один из методов диагностики излития околоплодных вод — цитологическое исследование влагалищного секрета. В свежий мазок добавляют каплю 1% р-ра эозина. Далее препарат рассматривают под микроскопом: эпителиальные клетки влагалища, эритроциты и лейкоциты будут ярко окрашены, а клетки плода, содержащиеся в отошедших водах — бесцветны.
Задача гинекологов при сохранении беременности, осложнённой разрывом околоплодной оболочки — предотвратить преждевременные роды до достижения плодом жизнеспособности вне условий матки. Показатель к родоразрешению — определенный порог сурфактанта у плода. Это поверхностно активные тела, выстилающие лёгкие изнутри и препятствующие слипанию лёгочных стенок друг с другом.
У недоношенных детей сурфактант недоразвит, поэтому они не могут дышать сами и находятся под аппаратом вентиляции лёгких. Сурфактант состоит из липида сфингомиелина и жироподобного вещества лецитина. Соотношение лицетина к сфингомиелину 2:1 говорит о способности малыша дышать самостоятельно. Диспропорция между компонентами указывает на возможность респираторного дистресс-синдрома, при котором ребёнок не может самостоятельно дышать.
Прогноз жизнеспособности можно составить по следующим цифрам:
Выводы
Если наблюдающий беременность гинеколог говорит, что при разрыве околоплодной оболочки малыша можно спасти, то он имеет на это веские основания. Своевременные диагностика и медицинская помощь помогут доносить плод до его жизнеспособного состояния.
Исходы беременности при преждевременном разрыве плодных оболочек
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Одним из самых неблагоприятных осложнений, встречающихся при угрожающих преждевременных родах, является преждевременный разрыв плодных оболочек (ПРПО). ПРПО при доношенной беременности считается важнейшим фактором риска осложнений беременности, угрожающим здоровью плода и матери, определяет высокий уровень перинатальной и младенческой заболеваемости и смертности.
Цель исследования: изучить причинные факторы ПРПО и его влияние на здоровье женщин.
Материал и методы: материалом исследования явились истории родов 106 беременных, у которых роды осложнились ПРПО в сроках 37–39 нед. гестации, родоразрешенных в Бухарском областном перинатальном центре за период 2017–2019 гг. Изучены анамнестические данные соматического, акушерско-гинекологического статуса всех родильниц. При сборе анамнеза тщательно изучено течение настоящей и предыдущих беременностей, родов и послеродового периода. Также проанализированы лабораторные параметры, состояние вагинальной флоры, степень готовности родовых путей, другие особенности (кровотечение, врожденные пороки развития плода, антенатальная гибель плода, признаки хориоамнионита, неубедительное состояние плода), результаты ультразвукового исследования матки и плода.
Результаты исследования: средний возраст женщин составил 26,5 года. У всех женщин беременность протекала на фоне отягощенного анамнеза с сочетанием акушерских, гинекологических и соматических заболеваний. Среди пациенток с ПРПО 20,7% (22 женщины) имели низкое социально-экономическое положение; 11,3% (11 женщин) — вредные привычки (наркотическую и никотиновую зависимость), 20,7% (22 женщины) — профессиональные вредности и 30,2% (32 женщины) — отягощенную наследственность.
Выводы: ретроспективное изучение историй родов показало, что основным фактором, способствующим ПРПО, является отягощенный акушерский, гинекологический и соматический анамнез, что имело место во всех случаях. ПРПО как следствие патологического роста условно-патогенной цервико-вагинальной микрофлоры в 26,4% случаев явился причиной хориоамнионита, что способствовало значительному увеличению удельной частоты акушерской патологии.
Ключевые слова: беременность, хориоамнионит, амниотическая оболочка, преждевременный разрыв плодных оболочек, индукция родов, микрофлора влагалища.
Для цитирования: Тошева И.И., Ихтиярова Г.А. Исходы беременности при преждевременном разрыве плодных оболочек. РМЖ. Мать и дитя. 2020;3(1):16-19. DOI: 10.32364/2618-8430-2020-3-1-16-19.
Pregnancy outcomes in preterm premature rupture of the membranes
I.I. Tosheva, G.A. Ikhtiyarova
Abu Ali ibn Sina Bukhara State Medical Institute, Bukhara, Uzbekistan
Aim: to analyze causative factors, obstetrical, and perinatal outcomes in women with preterm premature rupture of the membranes (PPROM) and to develop delivery strategy.
Patients and Methods: medical records of 106 deliveries (in 2017–2019) in women with PPROM occurred at 37–39 weeks of gestation were analyzed. Anamnestic somatic and obstetrical gynecological data were assessed. The course of current and previous pregnancies, delivery, and postnatal period was described in detail. Laboratory tests, vaginal flora, and Bishop Score used to rate the readiness of the birth canal for labor and other factors (i.e., bleeding, birth defects, antenatal death, chorioamnionitis signs etc.) were evaluated as well. In addition, uterine and fetal ultrasound was performed.
Results: mean age of study women was 26.5 years. All women had obstetrical, gynecological, or somatic comorbidities. 22 women with PPROM (20.7%) were characterized by low socieconomic status. 11 women (11.3%) had bad habits, i.e., drug and alcohol addiction, 20.7% (22 women) occupational hazards, and 30.2% (32 women) compromised family history.
Conclusions: retrospective analysis of delivery records has demonstrated that compromised obstetrical, gynecological, and somatic history (which occurred in all women) was the key factor promoting PPROM. PPROM resulting from the pathological growth of cervical vaginal flora causes chorioamnionitis in 26.4% of cases thus accounting for significant increase in the prevalence of obstetrical disorders.
Keywords: pregnancy, chorioamnionitis, amnion, preterm premature rupture of the membranes, labor induction, vaginal microflora.
For citation: Tosheva I.I., Ikhtiyarova G.A. Pregnancy outcomes in preterm premature rupture of the membranes. Russian Journal of Woman and Child Health. 2020;3(1):–19. DOI: 10.32364/2618-8430-2020-3-1-16-19.
Актуальность
Одним из самых неблагоприятных осложнений, встречающихся при угрожающих преждевременных родах, является преждевременный разрыв плодных оболочек (ПРПО). ПРПО при доношенной беременности считается важнейшим фактором риска осложнений беременности, угрожающим здоровью плода и матери, определяет высокий уровень перинатальной и младенческой заболеваемости и смертности [1, 2]. Осложнение родов ПРПО является одной из важнейших проблем современного акушерства [3, 4], становясь причиной инициации родовой деятельности в 8–92% случаев в зависимости от срока беременности. Проблема осложненных родов является лидирующей в структуре перинатальной заболеваемости и смертности [5, 6].
Перинатальная заболеваемость в большинстве случаев обусловлена внутриутробными инфекциями, ПРПО, который отмечается в 24–36% случаев осложненных родов [7]. ПРПО тесно связан с перинатальной инфекцией, повышает в 10 раз риск неонатального сепсиса, высокой перинатальной и младенческой смертности, а также гнойно-септических осложнений у матери. Часто в анамнезе пациенток с ПРПО указывалось: на перенесенную вирусную инфекцию; истмико-цервикальную недостаточность; пороки развития матки; перерастяжение матки вследствие многоводия, многоплодия, макросомии плода; хирургические операции во время беременности, особенно на органах брюшной полости, или травмы. Отмечают также роль в генезе разрыва плодных оболочек во II триместре беременности таких факторов, как расовая или этническая принадлежность, доступность медицинской помощи. Факторы, способствующие ПРПО в различные сроки беременности, остаются не до конца изученными.
Цель исследования: изучить причинные факторы, а также акушерские и перинатальные исходы у пациенток с ПРПО.
Материал и методы
Исследовали истории родов 106 беременных, у которых роды осложнились ПРПО в сроках 37–39 нед. гестации, родоразрешенных в Бухарском областном перинатальном центре за период 2017–2019 гг. Средний возраст женщин составил 26,5 года. Изучены анамнестические данные соматического, акушерско-гинекологического статуса всех родильниц. При сборе анамнеза тщательно изучено течение настоящей и предыдущих беременностей, родов и послеродового периода. Также проанализированы лабораторные параметры (общий анализ крови, биохимический анализ крови), состояние вагинальной флоры, степень готовности родовых путей по шкале Бишоп по показаниям (кровотечение, врожденные пороки развития плода, антенатальная гибель плода, признаки хориоамнионита, неубедительное состояние плода), результаты ультразвукового исследования матки и плода.
Результаты исследования
У всех женщин беременность протекала на фоне отягощенного анамнеза с сочетанием акушерских, гинекологических и соматических заболеваний. Среди пациенток с ПРПО 20,7% (22 женщины) имели низкое социально-экономическое положение; 10,3% (11 женщин) — вредные привычки (наркотическую и никотиновую зависимость), 20,7% (22 женщины) — профессиональные вредности и 30,2% (32 женщины) — отягощенную наследственность.
В большинстве случаев выявлено сочетание нескольких патологий. В таблице 1 приведены данные акушерского анамнеза.
Из таблицы 1 видно, что среди пациенток превалировали повторнородящие (63 женщины), которые составили 59,4%. Почти каждая третья повторнородящая женщина (28,6%) в анамнезе указывала на искусственный аборт. Репродуктивные потери, такие как неразвивающаяся беременность и самопроизвольные выкидыши, имели место в обеих группах. Беременность завершилась преждевременно у 81 женщины, что составило 76,4%. У 25 женщин беременность пролонгирована до доношенного срока (23,6%).
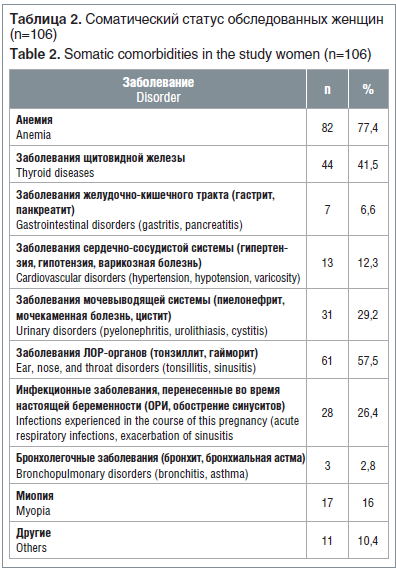
Изучение гинекологического анамнеза обследованных показало, что более чем у половины беременных — 76 (71,7%) — был осложненный анамнез. 27 женщин (25,5%) указывали на перенесенные заболевания гениталий: цервицит — 26 (24,5%), хронические воспалительные заболевания придатков и влагалища — 40 (37,7%). Инфекции, передающиеся половым путем (хламидийная, герпетическая, уреаплазменная), были диагностированы у 8 (7,5%). Ретенционные кисты яичников диагностированы у 3 женщин (2,8%). Диатермокоагуляция шейки матки по поводу эрозий проведена в 13,2% случаев (14 женщин). Различные гинекологические оперативные вмешательства в анамнезе были у 11 женщин, что составило 10,4%. Ниже приведены данные соматического статуса обследованных женщин (табл. 2).
У всех беременных с ПРПО был отягощенный соматический анамнез. В структуре экстрагенитальных заболеваний превалировали анемия, заболевания щитовидной железы и мочевыводящей системы, а также заболевания ЛОР-органов и желудочно-кишечного тракта.
Изменение микрофлоры влагалища и увеличение в ней количества патогенных микроорганизмов относятся к числу основных причин преждевременного излития околоплодных вод. Состояние микрофлоры влагалища и присутствие патогенных микроорганизмов оценивали путем анализа влагалищного секрета на флору. Забор мазка произведен со слизистой влагалища, шейки матки или мочеиспускательного канала.
Вторая степень чистоты была у 31 женщины (29,2%), содержимое влагалища имело кислую реакцию (рН 5,0–5,5) с влагалищными клетками и палочками Дедерлейна в меньшей степени, отмечалось множество анаэробных бактерий, эпителиальных клеток, встречались единичные лейкоциты.
Третья степень чистоты наблюдалась у 58 женщин (54,7%), у них влагалищный секрет имел слабощелочную реакцию (рН 6,0–6,5), палочки Дедерлейна были в небольшом количестве, доминировали анаэробные бактерии, в большом количестве — кокки и лейкоциты.
У 17 женщин (16%) диагностирована четвертая степень чистоты влагалищного мазка, секрет имел слабощелочную реакцию, палочки Дедерлейна отсутствовали, анаэробные бактерии и бациллы были в большинстве, встречались единичные трихомонады или другие возбудители инфекций, лейкоциты — в большом количестве.
В соответствии с Национальным стандартом ведения больных с ПРПО после отхождения околоплодных вод всем роженицам проводили антибактериальную терапию (эритромицин в таблетках по 500 мг через каждые 8 ч) с целью профилактики гнойно-септических осложнений у плода. Для профилактики синдрома дыхательных расстройств назначалась внутримышечная инъекция дексаметазона по 8 мг через каждые 8 ч № 3. При угрозе преждевременных родов назначалась токолитическая терапия — нифедипин по 10 мг через каждые 15 мин (до 5 таблеток).
При сроке беременности от 28 до 34 нед. приоритетной считалась выжидательная активная тактика, целью которой было не допустить развития клинически и гистологически значимого хориоамнионита. 28 (26,4%) роженицам проведена индукция родов в связи с присоединением признаков хориоамнионита или абсолютным противопоказанием к пролонгированию беременности (кровотечения, врожденные пороки развития плода, антенатальная гибель плода, неубедительное состояние плода).
Нижеследующие признаки считались параметрами увеличения риска развития хориоамнионита: рост лейкоцитоза более чем на 15–20% от исходного уровня, содержания нейтрофилов и, особенно, С-реактивного белка, наличие отрицательной динамики в функциональном состоянии системы «мать — плацента — плод» (уменьшение индекса амниотической жидкости, черепного индекса, отрицательная динамика при допплерометрии в среднемозговой артерии плода).
Перед началом родоиндукции проведено влагалищное исследование с целью оценки зрелости шейки матки по шкале Бишоп. У 40,6% обследованных беременных раскрытие, длина, консистенция, положение шейки матки и состояние предлежащей части плода оценивались менее чем в 5 баллов, что определялось как незрелая шейка, у 59,4% женщин была зрелая шейка. Тактика дальнейшего ведения беременных была выбрана согласно протоколу областного перинатального центра. У беременных с незрелой шейкой в сочетании с акушерскими осложнениями по протоколу проводилась индукция родов динопростоном 3 мг по 1 таблетке интравагинально после информированного согласия беременной и родственников (проводилась беседа о возможных осложнениях родовозбуждения). Во время индукции выполняли мониторинг сердцебиений плода и активности матки. Повторную оценку состояния родовых путей проводили через 8 ч для уточнения необходимости продолжения индукции. У беременных со зрелой шейкой применяли выжидательную тактику до развития регулярной родовой деятельности или консилиум врачей принимал решение о родостимуляции окситоцином. 67,8% беременных родоразрешены через естественные родовые пути. С началом регулярной родовой деятельности антибиотик вводили инъекционно. Учитывая высокую чувствительность к ампициллину бактерий влагалища и шейки матки, мы предпочитаем применять данный препарат у женщин с преждевременным отхождением околоплодных вод.
Характер родовой деятельности контролировали с помощью ведения партограмм. При ведении родов, осложненных ПРПО, проводили контроль гемодинамических показателей, температуры тела (каждые 4 ч), общий анализ крови (коагулограмма, С-реактивный белок, кровь на лейкоцитоз 1 раз в сутки, лейкоцитарный интоксикационный индекс; определяли группу крови и Rh-принадлежность), анализ мочи, анализ выделений из влагалища (мазок), УЗИ матки и плода, оценивали общее состояние роженицы.
При критических состояниях, угрожающих жизни женщины (преждевременная отслойка нормально расположенной плаценты, тяжелая преэклампсия, эклампсия, несостоятельность рубца), тяжелой акушерской патологии, незрелости шейки матки с присоединением хориоамнионита, отсутствии условий для срочного родоразрешения консилиум врачей рассматривал вопрос об оперативном родоразрешении.
Выводы
В процессе ретроспективного изучения историй родов обнаружено, что основным фактором, способствующим ПРПО, является отягощенный акушерский, гинекологический и соматический анамнез, что имело место во всех случаях. Наиболее частая фоновая патология — анемия, заболевания мочевыделительной системы и инфекции, перенесенные во время настоящей беременности.
Преждевременное излитие околоплодных вод как следствие патологического роста условно-патогенной цервиковагинальной микрофлоры в 26,4% случаев явилось причиной хориоамнионита, что способствовало значительному увеличению удельной частоты акушерских патологий.
Сведения об авторах:
Тошева Ирода Исроиловна — ассистент кафедры акушерства и гинекологии, ORCID iD 0000-0002-0987-314;
Ихтиярова Гулчехра Акмаловна — д.м.н., доцент, заведующая кафедрой акушерства и гинекологии, ORCID iD 0000-0002-1906-419X.
Бухарский государственный медицинский институт им. Абу Али ибн Сина. 200118, Узбекистан, г. Бухара, ул. А. Набиева, д. 142.
Контактная информация: Тошева Ирода Исроиловна, e-mail: iroda.tosheva@mail.ru. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 15.11.2019.
Iroda I. Tosheva — MD, Assistant of the Department of Obstetrics and Gynecology, ORCID iD 0000-0002-0987-7314;
Gulchekhra A. Ikhtiyarova — MD, PhD, Associate Professor, Head of the Department of Obstetrics and Gynecology, ORCID iD 0000-0002-1906-419X.
Abu Ali ibn Sina Bukhara State Medical Institute. 142, A. Nabiev str., Bukhara, 200118, Uzbekistan.
Contact information: Iroda I. Tosheva, e-mail: iroda.tosheva@mail.ru. Financial Disclosure: no authors have a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 15.11.2019.
Только для зарегистрированных пользователей
Преждевременный разрыв плодных оболочек
Общая информация
Краткое описание
Три основные причины неонатальной смертности связаны с ПДРПО: недоношенность, сепсис и гипоплазия легких [1,2]. Риск для матери связан, прежде всего, с хориоамнионитом.
Класс (уровень) I (A) – разработанные крупные, рандомизированные, контролируемы исследования, данные мета-анализа или системных обозрений, отличающиеся наиболее высоким уровнем достоверности.
Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
Автоматизация клиники: быстро и недорого!
Мне интересно! Свяжитесь со мной
Классификация
Диагностика
II. МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ И ЛЕЧЕНИЯ
• УЗИ малого таза и брюшной полости
• контроль ЧСС плода, КТГ по показаниям (мекониальные околоплодные воды, недоношенность, ЗВУР, вагинальные роды с рубцом на матке, преэклампсия, маловодие, диабет, многоплодная беременность, тазовое предлежание, отклоняющиеся от нормы результаты допплерометрии скорости кровотока в артерии, индукция родов, ЭПА)
При подозрении на ПРПО – осмотр в зеркалах [УД В] [1]. В некоторых случаях дополнительное подтверждение диагноза достигается при проведении УЗИ [УД С]. Если разрыв оболочек произошел достаточно давно, диагностика ПРПО может быть затруднена.
• может быть предложен тест (при его наличии) на фетальный фибронектин (чувствительность 94%) [5]
Дифференциальный диагноз
Лечение
Немедикаментозное лечение: не проводится.
Амниоинфузия – операция по введению раствора, по составу сходного с составом амниотической жидкости в амниотическую полость. Теоретически, плод может выиграть от амниоинфузии, так как это может помешать развитию гипоплазии легких и контрактуры суставов. Однако, преимущество повторяющихся трансабдоминальных амнионифузий для лечения ПРПО видится весьма скромными [8].
В связи с этим исследователями была предложена установка порт – системы, когда катетер устанавливается в амниотической полости. Специальная форма этого катетера предотвращает ее изгнание из матки. Используя эту систему, жидкость может непрерывно вводиться в матку. Порт система была успешно имплантирована у людей с ПРПО [9]. Основные результаты предыдущих исследований показали, что использование подкожно имплантированной AFR порт – системы для долгосрочной амниоинфузии в лечении PPROM является эффективным с целью пролонгирования беременности и в предотвращении гипоплазия легких [9, 10]. Подкожная имплантация порта предоставляет врачу возможность введения частых и долгосрочных вливаний, тем самым позволяя врачу заменить потерю жидкости из-за ПРПО и, как следствие, продлить срок гестации [10]. Эффект промывания путем непрерывного внутриамниотического вливания гипотонического солевого раствора также способен защитить пациента от развития синдрома амниотической инфекции.
Перинатальные исходы при преждевременном разрыве плодных оболочек
Рассмотрены этиология и перинатальные и постнатальные исходы при преждевременном разрыве плодных оболочек (ПРПО), акушерская тактика ведения недоношенной беременности, осложненной ПРПО, показания к досрочному прерыванию недоношенной беременности, осложнен
Etiology, and ante-natal and post-natal outcomes in premature breaking of waters (PBW) were considered, as well as obstetrical practice of managing incomplete pregnancy complicated with PBW, and indications for premature abortion of incomplete pregnancy complicated with PBW.
Преждевременным называется разрыв околоплодных оболочек до начала родовой деятельности независимо от срока беременности, клинически проявляющийся излитием околоплодных вод. Популяционная частота преждевременного разрыва плодных оболочек (ПРПО) составляет около 12% [1, 6], однако в структуре причин преждевременных родов эта патология достигает 35–60% [2].
Этиология
Данные эпидемиологических исследований свидетельствуют о многообразии этиологических факторов ПРПО. Выявлена взаимосвязь ПРПО с высоким паритетом, а также преждевременными родами, привычным невынашиванием и ПРПО в анамнезе [5]. Причиной разрыва оболочек могут быть приобретенные или врожденные формы дефицита коллагена (синдром Элерса–Данлоса), дисбаланс микроэлементов, в том числе дефицит меди, являющейся кофактором матриксных металлопротеиназ (ММП) и их ингибиторов, влияющих на свойства компонентов соединительнотканного матрикса плодных оболочек. Одним из факторов, способствующих повреждению плодных оболочек, является оксидантный стресс, связанный с продукцией реактивных кислородных радикалов нейтрофилами и макрофагами при их вовлечении в процесс микробной элиминации, которые вызывают локальную дегенерацию коллагена, истончение и разрыв оболочек путем активизации ММП, а хлорноватистая кислота непосредственно разрушает коллаген I типа, являющийся структурной основой плодных оболочек [11, 19].
Подтверждена роль отслойки плаценты как в индукции преждевременных родов, так и ПРПО, связанная с выбросом большого количества простагландинов, высокой утеротонической активностью тромбина [27] и наличием питательной среды для роста бактериальной микрофлоры.
На протяжении последних лет утвердилось обоснованное мнение о том, что ведущей причиной ПРПО является восходящее инфицирование околоплодных оболочек и микробная инвазия амниотической полости, частота которой в течение первых суток после ПРПО составляет от 37,9% до 58,5% [12]. Подтверждают восходящий путь передачи инфекции многочисленные исследования, указывающие на идентичность штаммов микроорганизмов, выделенных у плодов и в мочеполовых путях беременных [7, 12, 21]. Среди инфекционных агентов, которые служат непосредственной причиной восходящего воспалительного процесса, преобладают Еscherichia сoli, Staphilococcus aureus, Streptococcus faecalis, Streptococcus группы B, Bacteroides fragilis, Corinobacter, Campylobacter, Clebsiella pneumoniae [7]. Ряд авторов подчеркивают роль анаэробных бактерий в этиологии восходящего инфицирования, в частности Fusobacterium [22]. К часто встречающимся представителям микробных ассоциаций относятся Ureaplasma urealiticum, Mycoplasma hominis и Gardnerella vaginalis. Однако широкое распространение урогенитальных микоплазм, стертая клиническая картина и трудности диагностики затрудняют определение роли этих микроорганизмов в этиологии и патогенезе преждевременных родов и ПРПО [3]. Риск ПРПО значительно возрастает при наличии истмико-цервикальной недостаточности и пролапса плодного пузыря в связи с нарушением барьерной функции цервикального канала, а также укорочении шейки матки менее 2,5 см [14].
Степень повреждения околоплодных оболочек связана с видом патогена и его способностью активизировать ММП. Тесная взаимосвязь увеличения концентрации большинства ММП (ММП-1, 7, 8 и 9) и снижения тканевого специфического ингибитора металлопротеиназ (ТИММП-1) в околоплодных водах с внутриамниальной бактериальной инвазией и отслойкой плаценты не подвергается сомнению [11, 19]. Механизм бактериального действия на плодные оболочки опосредован, с одной стороны, стимулирующим влиянием микробных протеиназ и эндотоксинов на экспрессию ММП и выработку провоспалительных цитокинов (ИЛ-2, ИЛ-6, ИЛ-12, фактора некроза опухоли) с последующей локальной деградацией коллагена оболочек, а с другой стороны, повышением бактериальными фосфолипазами синтеза простагландинов с развитием гипертонуса миометрия и увеличения внутриматочного давления [19].
Таким образом, ведущую роль в этиологии и патогенезе ПРПО при недоношенной беременности играют факторы, стимулирующие апоптоз, разрушение фосфолипидов и деградацию коллагена соединительнотканного матрикса околоплодных оболочек, преимущественно связанные с действием инфекции.
Перинатальные и постнатальные исходы
Более 30% пери- и неонатальной заболеваемости и смертности при преждевременных родах связаны с беременностью, осложненной ПРПО [1, 3]. В структуре заболеваемости и смертности основное место занимают синдром дыхательных расстройств (СДР) (до 54%), внутриутробная инфекция и гипоксическое поражение головного мозга, в виде перивентрикулярной лейкомаляции (ПВЛ) головного мозга (до 30,2%) и внутрижелудочковых кровоизлияний (ВЖК) [1, 3, 31].
Синдром дыхательных расстройств
СДР новорожденных представляет совокупность патологических процессов, формирующихся в пренатальном и раннем неонатальном периодах и проявляющихся нарастанием симптомов дыхательной недостаточности на фоне угнетения жизненно важных функций организма. Основной причиной развития СДР является дефицит сурфактанта или его инактивация. К предрасполагающим факторам следует отнести внутриутробные инфекции (ВУИ) и перинатальную гипоксию. Степень тяжести и частота реализации СДР прогрессивно снижается с увеличением срока беременности и степени зрелости плода и составляет около 65% до 30 недель беременности, 35% — в 31–32 недели, 20% в 33–34 недели, 5% в 35–36 недель и менее 1% — в 37 недель и более [1, 15, 31].
Существует мнение, что интраамниальная инфекция, связанная с длительным безводным промежутком, способствует созреванию легких плода и снижает частоту респираторных нарушений [28]. В эксперименте на овцах показано, что интраамниальное введение эндотоксина E. coli достоверно в большей степени повышает концентрацию липидов и протеинов сурфактанта, при применении бетаметазона, и в 2–3 раза увеличивает воздушный объем легких [15]. Однако клинические исследования не подтвердили предположение о стимулирующем влиянии ПРПО на зрелость легочной ткани, и оно требует дальнейшего изучения [31].
Врожденная инфекция плода
Наиболее значимым фактором риска неблагоприятного пери- и постнатального исхода, усугубляющим течение пневмопатий и патологии центральной нервной системы, является ВУИ. Это понятие объединяет инфекционные процессы (пневмония, сепсис и др.), которые вызывают различные возбудители, проникшие к плоду от инфицированной матери. Для недоношенных детей, находящихся на длительном стационарном лечении, большую опасность представляют и нозокомиальные инфекции. Мертворождаемость и ранняя неонатальная смертность при ВУИ связана со степенью тяжести воспалительного процесса, зависящего от гестационного возраста плода, типа и вирулентности возбудителя, защитных факторов околоплодных вод и неспецифического иммунитета, и составляет по данным литературы 14,9–16,8% и 5,3–27,4% соотвественно [2, 33].
Преобладающей клинической формой неонатальной инфекции при ПРПО, составляющей от 42% до 80%, является пневмония, как правило, связанная с аспирацией инфицированными водами, часто сочетающаяся с признаками язвенно-некротического энтероколита. Прогрессирование очагов первичного воспаления в легких или кишечнике плода обусловливает возможность развития метастатического гнойного менингита, перитонита, а также внутриутробного сепсиса, частота которого при ПРПО до 32 недель колеблется от 3% до 28%. Основными факторами риска неонатального сепсиса являются гестационный срок и развитие хориоамнионита (ХА) [29, 33].
Влияние ВУИ на отдаленный исход не однозначно. Есть данные, указывающие на риск развития детского церебрального паралича, связанного с интраамниальной инфекцией и гестационным возрастом плода [10, 26]. В то же время ряд исследований не подтвердили достоверной связи между ВУИ и нарушением умственного и психомоторного развития детей [17, 22].
Постгипоксические поражения головного мозга
Основные гипоксические повреждения головного мозга недоношенных детей включают ПВЛ и ВЖК.
ПВЛ представляет собой коагуляционный некроз белого вещества, с последующей дегенерацией астроцитов с пролиферацией микроглии, вследствие гипоксемии и ишемии головного мозга. При экстремально низкой и очень низкой массе тела при рождении патологоанатомическая частота ПВЛ варьирует от 25% до 75%, а in vivo — от 5% до 15%. Осложения ПВЛ в виде деструкции афферентных волокон таламокортикальных и кортикокортикальных путей отрицательно влияют на формирование межнейрональных ассоциативных связей, процессы миелинизации белого вещества и могут стать причиной развития когнитивных нарушений [2, 26]. Прогностическим критерием развития ПВЛ и отдаленных неврологических нарушений является значительное повышение концентрации в околоплодных водах и пуповинной крови новорожденных провоспалительных цитокинов, в том числе ИЛ-6, что подтверждает гипотезу о цитокин-опосредованном повреждении мозга и косвенно свидетельствует о роли ВУИ в развитии ПВЛ [13, 26].
ВЖК составляют в структуре перинатальной смертности недоношенных новорожденных от 8,5% до 25% [2, 13]. К основным факторам риска их развития относят острую гипоксию плода и ХА [26]. Частота тяжелых степеней ВЖК снижается с увеличением гестационного возраста и при родоразрешении путем операции кесарева сечения. Некоторые исследования подтверждают роль глюкокортикоидной терапии в уменьшении риска развития ВЖК и ПВЛ [17, 20]. В то же время разработка достоверно эффективных методов профилактики ВЖК до настоящего времени остается в поле внимания научных исследований.
Инфекционные осложнения беременных, рожениц и родильниц при недоношенной беременности, осложненной ПРПО
Пролонгирование недоношенной беременности при ПРПО представляет значительный риск для матери, в первую очередь в связи с присоединением инфекционного процесса и развитием гнойно-септических осложнений (ГСО), в большинстве случаев ХА, послеродового эндомиометрита и, реже, — сепсиса. К факторам риска реализации ГСО следует отнести хирургические внутриматочные вмешательства, хроническую урогенитальную инфекцию, разрыв плодных оболочек на фоне пролабирования плодного пузыря, а также антенатальной гибели плода [1, 5].
Риск гнойно-септических инфекций (ГСИ) матери имеет достоверную связь с длительностью безводного промежутка и сроком гестации. Общая частота реализованного ХА при недоношенной беременности, осложненной ПРПО, составляет 13–74%, а при разрыве оболочек до 28 недель 28,8–33% [4, 7, 13]. Однако, по нашим данным, основанным на анализе течения 912 беременностей, осложненных ПРПО в сроке 22–34 недели, частота ХА до 31 недели беременности и продолжительности латентного периода более 2 суток — времени, необходимого для эффективной экспозиции глюкокортикоидов с целью профилактики СДР, — достоверно не меняется. В то же время при пролонгировании беременности после 31-й недели риск реализации ХА увеличивается. Таким образом, на наш взгляд, оптимальным подходом при ведении беременности, осложненной ПРПО, следует считать максимальное пролонгирование беременности до 31-й недели беременности, а при разрыве оболочек в более поздние сроки — только на период проведения глюкокортикоидной профилактики СДР. В то же время необходимо помнить, что вопрос о возможности длительного пролонгирования беременности при ПРПО должен решаться индивидуально с учетом возможностей акушерской и, в большей степени, неонатальной служб, а также факторов риска ГСИ у беременной.
К прогностическим критериям инфекционных осложнений и ХА относят маловодие и косвенные признаки воспаления плаценты [23]. По нашим данным, при нормальном объеме околоплодных вод с индексом амниотической жидкости более 8 см частота реализации ХА составляет 4,9%. В то же время при снижении индекса амниотической жидкости менее 5 см риск развития ХА возрастает в 2 раза.
Послеродовая заболеваемость родильниц проявляется эндометритом в 3,5–11,1% случаях [4]. Частота развития сепсиса по данным разных авторов достигает 1,7%, а материнская летальность, связанная с ведением недоношенной беременности, осложненной ПРПО, — 0,85% [4, 23].
Клинико-лабораторная диагностика и прогностические критерии хориоамнионита и системной воспалительной реакции
Раннее выявление признаков ХА представляет определенные трудности в связи с изменением реактивности организма во время беременности и склонности к формированию латентных форм воспалительных заболеваний. Типичными симптомами ХА являются лихорадка, тахикардия матери и плода, специфический запах околоплодных вод или патологические выделения из влагалища. К сожалению, гипертермия до 38 °С и выше часто является единственным индикатором развития ХА, а значения традиционных маркеров воспалительного процесса — количества лейкоцитов и сегментоядерных нейтрофилов — при беременности имеют широкую вариабельность, зависимы от медикаментов, в том числе стероидов и антибиотиков и, по данным некоторых исследований, имеют невысокое диагностическое значение [4, 30]. Из рутинных клинико-лабораторных критериев ХА высокую диагностическую ценность имеют гипертермия более 37,5 °С, лейкоцитоз более 17 × 10 9 /л и палочкоядерный сдвиг лейкоцитарной формулы до 10% и более. Развитие указанных симптомов необходимо использовать в качестве показаний для родоразрешения со стороны матери при пролонгировании недоношенной беременности, осложненной ПРПО [2, 4, 6].
Наибольшие трудности представляет ранняя диагностика септических состояний. За последние годы достигнут большой прогресс в изучении и использовании белков плазмы крови, принимающих участие в так называемом острофазном ответе — совокупности системных и местных реакций организма на тканевое повреждение, вызванное различными причинами (травма, инфекция, воспаление, злокачественное новообразование и пр.). В качестве прогностического критерия инфекции при ПРПО широко используется определение концентрации С-реактивного белка (СРБ), повышение которого в сыворотке крови более 800 нг/мл является индикатором интраамниальной инфекции и тесно коррелирует с фуниситом, гистологически и клинически выраженным ХА с чувствительностью 92% и специфичностью 96% [9]. Кроме того, концентрация СРБ в околоплодных водах может косвенно отражать состояние плода, так как он продуцируется гепатоцитами и не проникает через плаценту. В то же время ряд авторов считают СРБ малоспецифичным, а повышение его концентрации возможным при физиологическом течении беременности [30].
Среди биомаркеров сепсиса наиболее высокой диагностической точностью обладает прокальцитонин (ПКТ) — предшественник гормона кальцитонина, вырабатываемый несколькими типами клеток различных органов под влиянием бактериальных эндотоксинов и провоспалительных цитокинов. При системном инфекционном поражении его уровень возрастает в течение 6–12 часов и может служить ранним диагностическим критерием сепсиса и системной воспалительной реакции. Вирусные инфекции, местные инфекции, аллергические состояния, аутоиммунные заболевания и реакции отторжения трансплантата обычно не приводят к повышению концентрации ПКТ, а его высокие уровни свидетельствуют о бактериальной инфекции с системной воспалительной реакции [4, 25]. По нашим данным, средние уровни ПКТ при нормальном течении беременности и реализованном ХА составляют 0,29 и 0,72 нг/мл (p
В. Н. Кузьмин, доктор медицинских наук, професcор
ГБОУ ВО МГМСУ им. А. И. Евдокимова, Москва
Перинатальные исходы при преждевременном разрыве плодных оболочек/ В. Н. Кузьмин
Для цитирования: Лечащий врач № 3/2018; Номера страниц в выпуске: 34-38
Теги: недоношенная беременность, осложнения, акушерская тактика