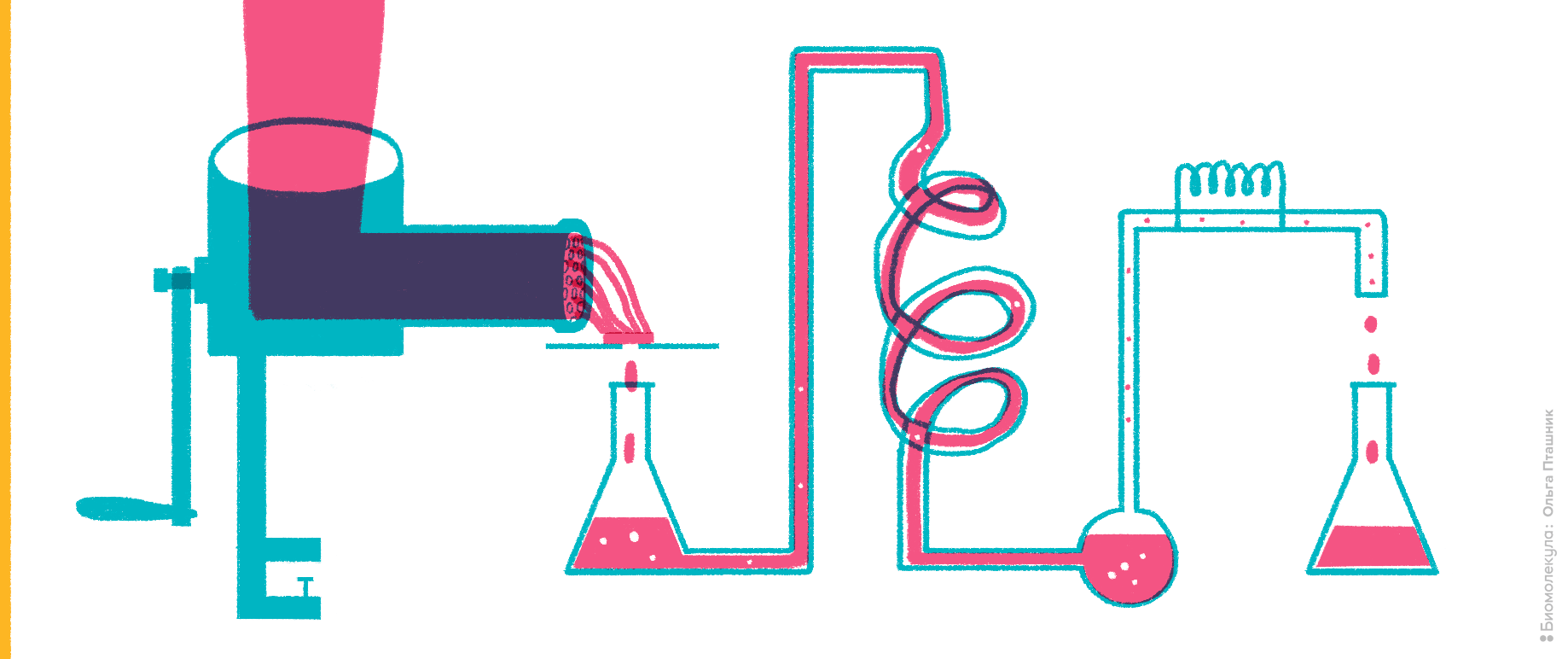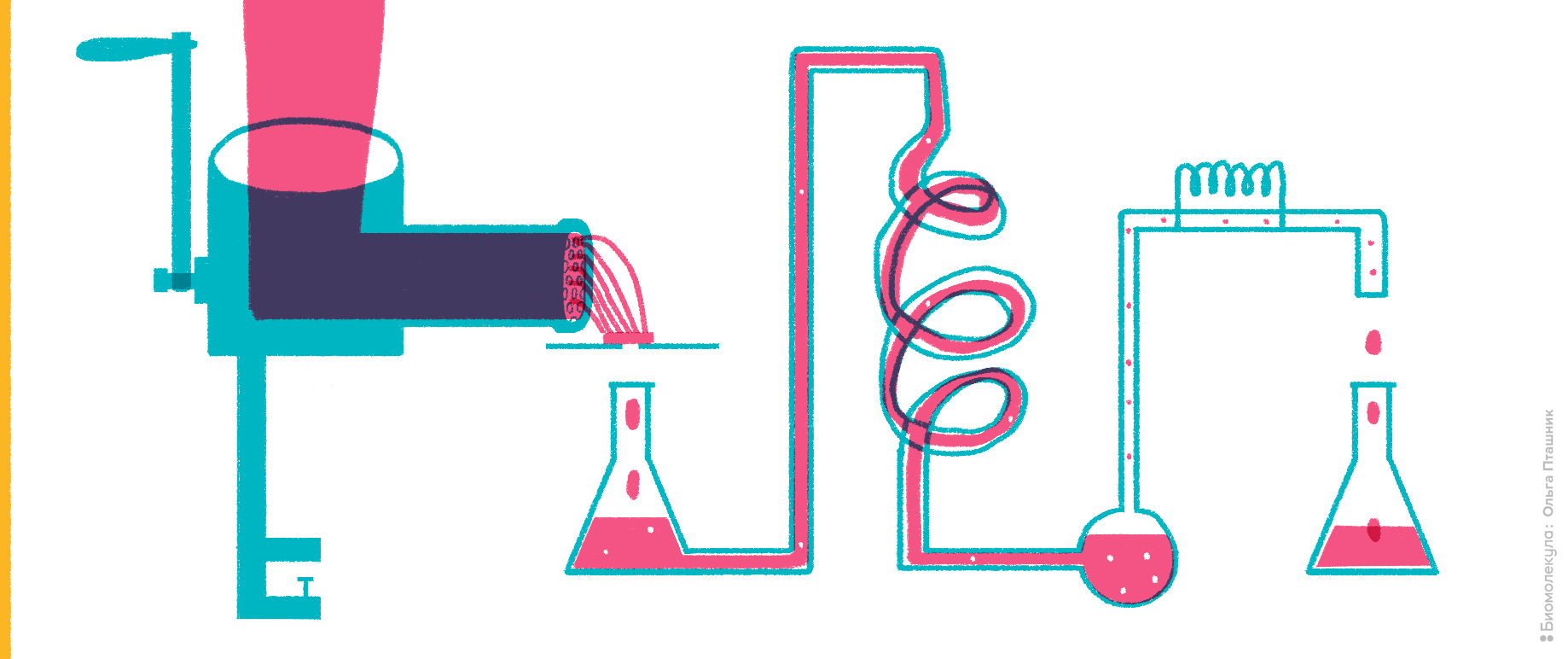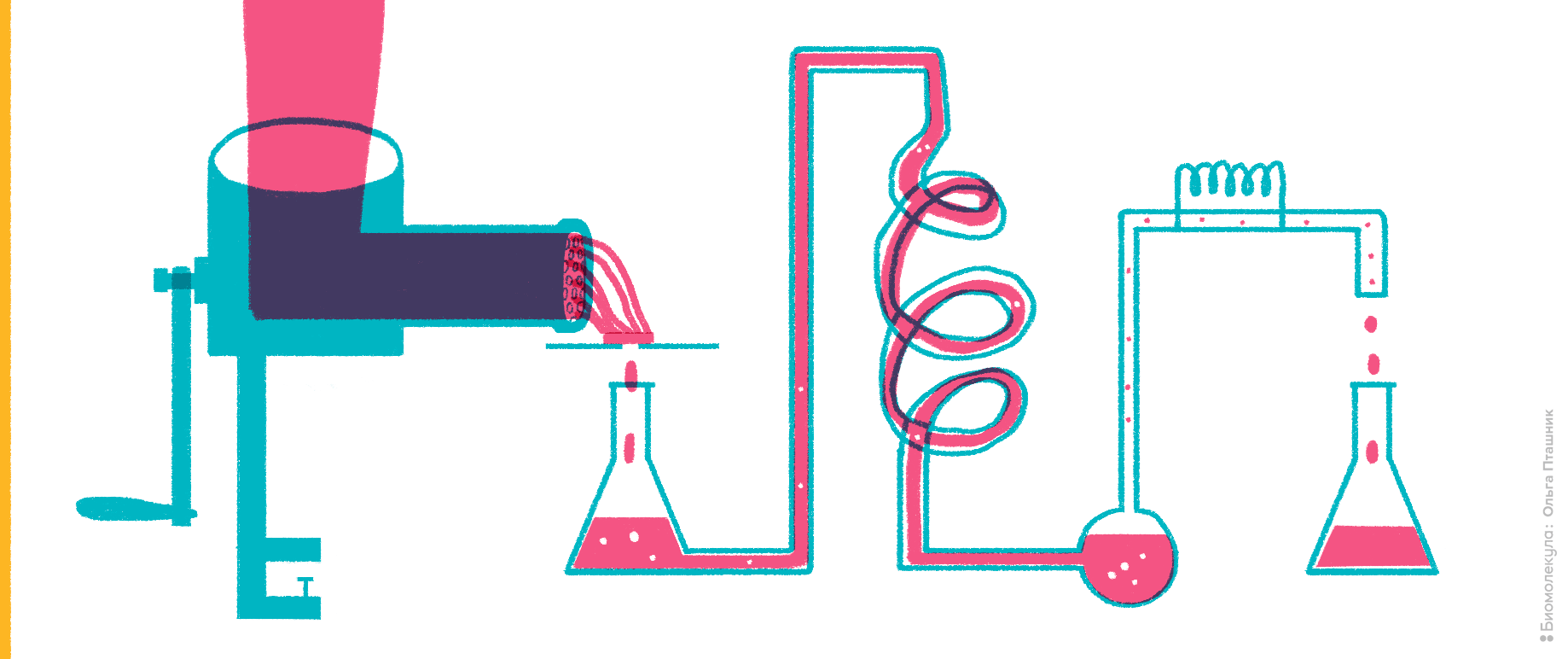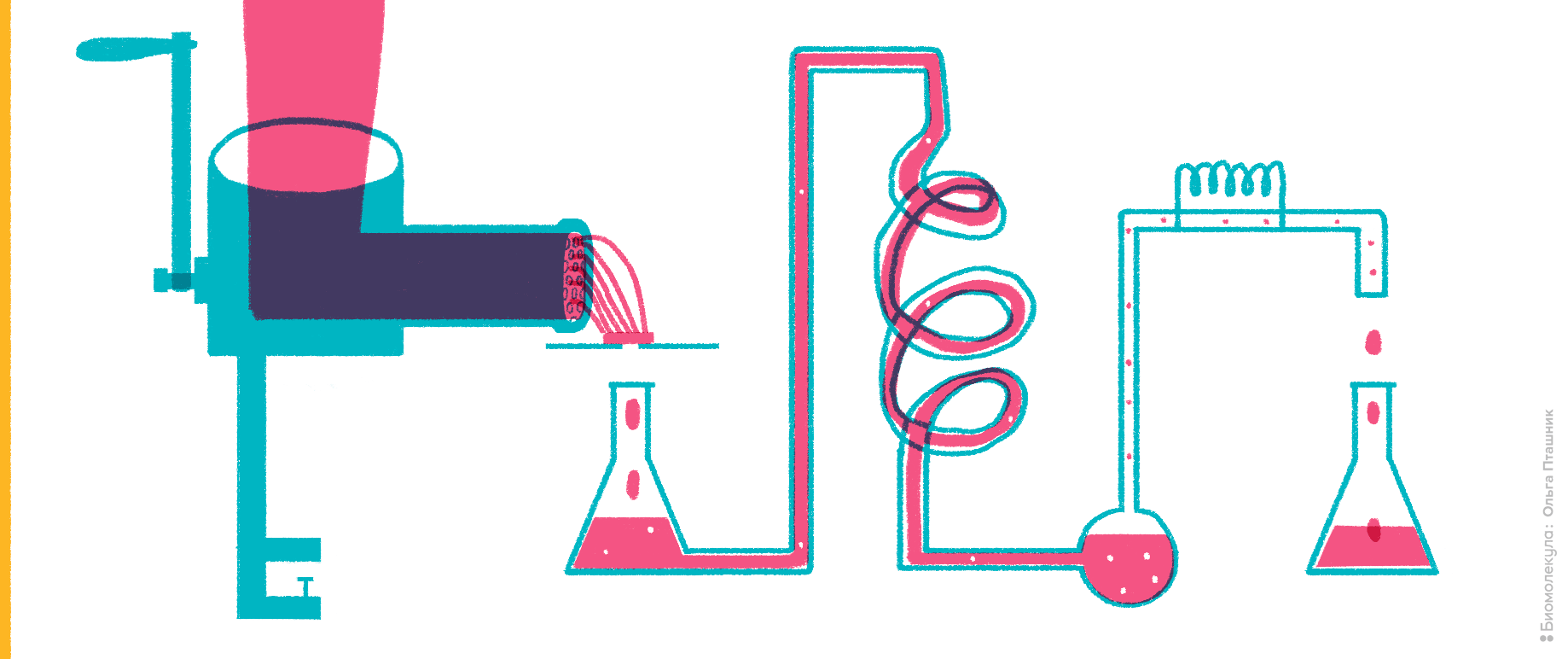Протеомика что это такое
Протеомика
Протеомика — наука, основным предметом изучения которой являются белки и их взаимодействия в живых организмах, в том числе — в человеческом. Учёные, работающие в области протеомики, исследуют «производство» белков, их декомпозицию и замену белков внутри тела. Они также изучают, как белки модифицируются после их синтеза в организме.
Традиционно изучение белков являлось одним из разделов биохимии, но после определения структуры всей геномной ДНК человека и ряда других организмов у исследователей белков появились новые методы, с которыми и связывают появление нового термина протеомика (от протеин и геномика). В частности, появились исчерпывающие базы данных о структуре всех белков человека, а также их протеолитических фрагментов, полученных в стандартных условиях. Это позволяет идентифицировать белки по молекулярной массе их протеолитических фрагментов, полученных в тех же условиях.
Ссылки
Полезное
Смотреть что такое «Протеомика» в других словарях:
Протеомика — * пратэоміка * proteomics недавно появившееся направление молекулярной биологии, целью которого является изучение полного набора белков, кодируемых геномом, а также сравнение клеточных протеомов, т. е. наборов белков данной клетки в данной фазе… … Генетика. Энциклопедический словарь
протеомика — Наука, занимающаяся инвентаризацией (определением и классификацией) белков клетки [http://www.dunwoodypress.com/148/PDF/Biotech Eng Rus.pdf] Тематики биотехнологии EN proteomics … Справочник технического переводчика
протеомика — Термин протеомика Термин на английском proteomics Синонимы Аббревиатуры Связанные термины активный центр катализатора, антитело, атомно силовая микроскопия, белки, биологические моторы, биологические нанообъекты, биосенсор, ван дер ваальсово… … Энциклопедический словарь нанотехнологий
протеомика — proteomika statusas T sritis chemija apibrėžtis Visiškas visų tam tikro organizmo sintetinamų baltymų ištyrimas. atitikmenys: angl. proteomics rus. протеомика … Chemijos terminų aiškinamasis žodynas
протеомика — proteomika statusas T sritis augalininkystė apibrėžtis Mokslas, tiriantis individų baltymų sandarą, funkcijas ir tarpusavio sąveiką. atitikmenys: angl. proteomics rus. протеомика … Žemės ūkio augalų selekcijos ir sėklininkystės terminų žodynas
Системная биология — Системная биология научная дисциплина, образовавшаяся на стыке биологии и теории сложных систем. Впервые термин используется в статье 1993 года авторов W. Zieglgänsberger и TR. Tölle [1]. Является междисциплинарной наукой о жизни.… … Википедия
протеом — Термин протеом Термин на английском proteome Синонимы Аббревиатуры Связанные термины антитело, белки, биологические нанообъекты, геном, капсид, кинезин, клетка, масс спектрометрия с лазерной десорбцией и ионизацией, матрикс, внеклеточный,… … Энциклопедический словарь нанотехнологий
Протеом — термин для обозначения всей совокупности белков (протеинов) организма, производимых клеткой, тканью или организмом в определённый период времени. Или, более строго, это совокупность экспрессированных протеинов в данном типе клеток или в организме … Википедия
Протеомика и фосфопротеомика в медицине
Термин «точная медицина» относится к использованию диагностических, терапевтических и мониторинговых стратегий для отдельных пациентов на основе их молекулярных профилей. В медицине (на практике) фокус исследований сосредоточен главным образом на стратификации болезней на подтипы, основанные на молекулярных биомаркерах или сигнатур, т.е. в молекулярной таксономии болезни. Цель современного врача состоит в том, чтобы использовать эти сигнатуры для назначения правильного лечения пациентам, распределения их в определенные подгруппы заболеваний и назначения наиболее эффективной терапии для каждого пациента. Обширная молекулярная характеристика признаков экспрессии генов при раке молочной железы позволила разработать мультигенные анализы, которые в настоящее время проходят клинические испытания для рутинного использования в клинике с целью руководства лечением пациентов и мониторинга.
В большинстве работ по молекулярной характеристике заболеваний используются геномные методологии для идентификации генетических вариантов, в том числе вариаций числа копий и дифференциальной экспрессии генов, связанных с конкретными подтипами заболевания. В одном из последних метаанализов исследования первой фазы для лечения рефрактерных злокачественных новообразований исследователи обнаружили, что, хотя частота ответов с использованием «прецизионного» биомаркера была значительно выше, чем при его отсутствии, медианный показатель ответа все еще составлял только ∼30%. Системная биология показала, что фокусирование только на геномном и транскриптомном уровнях регуляции клеточных функций делает нас слепыми к другим важным регуляторам клеточных фенотипов и результатов. Например, данные метаболомики предоставляют информацию, касающуюся метаболизма и регуляции энергетического баланса клетки, а эпигеномика может отражать регуляцию экспрессии гена и влияние факторов окружающей среды на клетку.
Последние достижения в области протеомики позволяют точно измерять содержание тысяч белков и фосфопротеинов из нескольких образцов параллельно. Таким образом, впервые у нас появилась возможность систематически измерять протеомные профили тысяч образцов пациентов или клеточных линий модели заболевания, выявлять точный лежащий в их основе молекулярный механизм, открывать персонализированные биомаркеры, сети и методы лечения. В этой заметкерассматриваются примеры успешного использования наборов данных протеомики и фосфопротеомики, а также их интеграции с другими наборами данных различных омик для точной медицины. Здесь также обусждаются проблемы биоинформатики, анализ и интеграция таких больших наборов данных и потенциальные причины, по которым профилирование протеомики и биомаркеры в настоящее время широко не используются в клинических условиях. Однако эти наборы данных не были использованы в области точной медицины из-за времени, необходимого для отбора, сложности и динамического диапазона образцов протеомики, отсутствия воспроизводимости среди лабораторий, различий между методами количественного определения и другими смешанными факторами.
Отсутствие воспроизводимости в различных наборах данных, технические проблемы, такие как проблема переоснащения в подходах машинного обучения и внутренняя сложность заболеваний человека, часто не позволяют перспективным биомаркерам достичь клинического применения.
Совсем недавно была собрана коллекция методов, в основном разработанных и применяемых к наборам данных геномики и транскриптомики, которые учитывают также сеть взаимодействия белков и структуру биохимических путей для выявления специфических для пациента звеньев патогенеза болзени. Алгоритм SPIA (Анализ воздействия сигнального пути) объединяет информацию о дифференциальной экспрессии генов с их влиянием в этом пути на основе их размещения в его топологии. HotNet2 и связанная диффузия через взаимодействующие события (TieDIE) помогла использовать слегка измененные диффузионные подходы, которые включают в себя форму случайного блуждания и взвешивания в соответствии с силой соединения и топологией сети для распространения эффекта возмущения в данной сети.
Протеомика
На практике протеомика пытается идентифицировать глобальным образом белки, извлеченные из клеточной культуры, из ткани или из биологической жидкости, их расположение в клеточных компартментах, их возможные посттрансляционные модификации, а также их количество.
Функциональная протеомика изучает функции каждого белка.
Резюме
История
Были разработаны многие методы, которые до сих пор широко используются.
// поставить фреску с хронологией изучения белков
За последние десять лет протеомика стала самостоятельной наукой со своими собственными методами и методами. Протеомика была награждена в 2002 году Нобелевской премией по химии.
Почему протеом?
Наконец, проблемы и результаты проектов секвенирования (в частности, человеческого генома) оправдывают глубокое изучение протеома. « Удивительное » открытие, что этот геном содержит гораздо меньше генов, чем предсказывалось, демонстрирует важность белков как центральных участников биологических процессов.
Различные подходы к протеомике
На практике белки сначала извлекаются из популяции клеток или ткани, а затем отделяются перед идентификацией.
Добыча
Разделение
Второй этап позволяет разделить белки в соответствии с их физическими или химическими характеристиками или в соответствии с их сродством к лиганду.
Хроматографии используют разницу в аффинности белка между подвижной фазой и стационарной фазой.
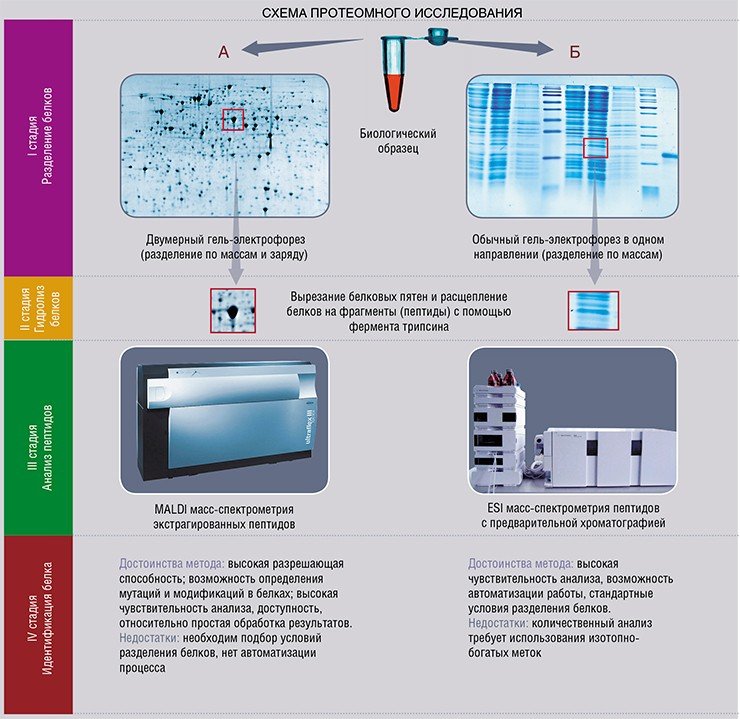
Принцип разделения белков с помощью двумерного электрофореза
Его принцип состоит в том, что сначала проводят разделение белков по их заряду ( изоэлектрическое фокусирование ) с последующим ортогональным разделением в соответствии с их молекулярной массой. Разрешение по первому измерению составляет порядка 0,01 единицы pH.
Поиск интересующих белков с помощью анализа изображений
Анализ изображений основан на оцифровке изображения геля 2-DE после окрашивания. На этом этапе программное обеспечение разрезает изображение на пиксели (сжатие элемента изображения) для передачи и хранения данных. Каждый пиксель изображения записывается в положениях x и y, связанных со значением оптической плотности (OD), пропорциональным интенсивности сигнала, записанного камерой или сканером. Чтобы OD была хорошим параметром измерения и отражала экспрессию белка, применяемое окрашивание должно иметь большой динамический диапазон и, если возможно, линейное. В геле, с точки зрения ОП, отношение интенсивности между наименьшим обнаруживаемым пятном и наибольшим пятном составляет порядка 104, в то время как динамика экспрессии белков в клетке составляет от 105 до 106. аналитический диапазон, который необходимо учитывать при анализе.
Текущее программное обеспечение для анализа изображений включает элементы трехмерной визуализации пятен геля, позволяющие изменять углы x, y и z, что чрезвычайно полезно для разделения близлежащих пятен. Таким образом, количественная оценка улучшается. Использование таких инструментов позволяет значительно расширить узкое место, связанное с анализом гелей. Однако для надежного дифференциального анализа необходимо сравнение серий, по крайней мере, из трех-четырех гелей. Статистические тесты, такие как эвристический анализ или анализ соответствия, объективно позволяют определить дисперсию между гелями различных экспериментальных серий.
Умножение двумерных гелей, необходимое для получения статистически надежной дифференциальной количественной оценки, однако, является препятствием для высокопроизводительных анализов, для которых интересен метод одного геля. Дифференциальный анализ на одном геле: (технология DIGE для дифференциального гель-электрофореза) была представлена на рынке компанией GE (ранее) Amersham Biosciences. Принцип основан на ковалентной маркировке с использованием флуоресцентных цианинов (например, Cy2, Cy3 и Cy5) белков, содержащихся в двух экстрактах, подлежащих анализу. Доступны три структуры с разными спектрами флуоресценции. Они также имеют группу сложного эфира N-гидроксисукцинимидила, которая делает возможным образование амида посредством реакции нуклеофильного замещения с аминогруппой в эпсилон лизинов белков. Анализ изображений геля DIGE проще, поскольку два образца мигрировали на одном и том же геле. Изображения, полученные на двух длинах волн, накладываются друг на друга и количественно сравниваются с использованием подходящего программного обеспечения с добавлением внутреннего эталона. Двухцветное сравнительное исследование приводит к демонстрации белков, которые отличаются или идентичны в двух образцах. Возможность наличия внутреннего стандарта увеличивает надежность количественных измерений. Независимо от используемого метода анализа, после обнаружения представляющие интерес пятна вырезаются из геля, чтобы их можно было идентифицировать спектрометрическими методами (масс-спектрометрия в режиме MALDI-TOF или в режиме тандемной МС / МС). В дополнение к дифференциальному анализу, анализ изображений позволяет создавать и аннотировать справочные карты, служащие основой для баз данных, к которым можно обращаться через WEB.
Идентифицировать, охарактеризовать и количественно определить белки
Идентификация масс-спектрометрией (МС)
Идентификация с помощью МС основана на точном измерении массы ионизированных пептидов. В большинстве случаев белки перевариваются эндопептидазой (чаще всего трипсином), а затем анализируются с помощью SM.
Проблема решается путем частичного секвенирования белков с помощью тандемной масс-спектрометрии (МС / МС). Затем выбирают и фрагментируют определенные пептидные фрагменты, проанализированные во время первого МС. Полученные массовые пики представляют собой представление белковой последовательности, в которой два соседних пика отличаются массой аминокислоты, потерянной во время фрагментации анализируемого пептида. Тогда аналогию с короткой последовательностью белка можно будет искать в базах данных. Если эти последовательности являются общими для группы белков, изоэлектрическая точка и кажущаяся масса, определенные во время разделения с помощью электрофореза, позволяют решить. Информация о перекрестной проверке (короткие последовательности нескольких аминокислот, расположение окна, содержащего пятно в 2D-электрофорезе, виды животных и тип клеток, из которых взят образец) повышает надежность идентификации полипептида.
Запросы к базам данных
Случаи организмов, геном которых еще не секвенирован;
Только определенные организмы, известные как « модельные организмы », имеют полностью секвенированный геном и доступны в Интернете. другие организмы изучаются на основе гомологии с известными организмами.
Количественная оценка экспрессии белка
Это позволяет количественно оценить вариации в уровнях их экспрессии в зависимости от времени, окружающей среды, состояния развития, физиологического и патологического состояния и вида происхождения.
Наиболее часто используемые методы:
Белковые взаимодействия
Она также изучает взаимодействия белков с другими белками, с ДНК или РНК, с веществами.
Функциональная протеомика
Функциональная протеомика изучает функции каждого белка.
Структурная протеомика
Вопросы протеомики
Биомаркерные исследования
Новые терапевтические инструменты
Сравнительные исследования киномов раковых клеток позволяют изучать механизмы резистентности и определять новые терапевтические мишени.
Мы живем в эпоху, которая регулярно обогащает язык массой новых слов, терминов и понятий. Области знания и информация, наполняющая их, множатся быстрее, чем возможности человека позволяют осознать этот процесс. «Протеомика» – новое направление науки, появившееся совсем недавно. Объектом ее изучения являются белки – «рабочие лошадки» любой клетки. Интерес к этим соединениям вызван не только их огромной ролью в функционировании живых организмов, но и тем, что они могут служить мишенями при создании новых лекарств
Слово «протеин», которым в научной литературе принято обозначать белок (высокомолекулярное органическое соединение, представляющее собой цепочку аминокислот), является производным от греческого proteios – «первоначальный». Его этимология точно описывает роль белков в поддержании жизни клетки любого организма – от бактерии до человека.
А вот термин «протеом» знаком, пожалуй, только специалистам. Интересно, что его придумал в 1994 г. австралийский студент М. Уилкинс, пытаясь в своей дипломной работе найти короткое название полному набору человеческих белков вместо неуклюжего словосочетания «все белки, экспрессируемые геномом». Уже на следующий год в научной печати появился термин «proteomics» (протеомика), обозначивший новое направление в молекулярной биологии (Wasinger et al., 1995).
Следует отметить, что само предложение «создать молекулярный белковый атлас человека» было озвучено еще около тридцати лет назад (Anderson, 1985). Но в то время оно было, скорее, пожеланием, технологически невыполнимым. Что же изменилось за прошедшие десятилетия? Во-первых, была успешно реализована программа по геномике, включающая разработку технологий быстрого секвенирования ДНК, создание баз данных нуклеотидных последовательностей. Вторая предпосылка связана со взрывным развитием инструментальных методов: масс-спектрометрии белков и пептидов (небольших цепочек аминокислот), а также электрофореза и хроматографии, использующихся для разделения органических молекул.
Эти факторы сделали возможным появление новой «высокотехнологичной» биологической дисциплины.
Белковое изобилие
В отличие от геномов, протеомы, т. е. полные наборы белков клетки, представлены активным набором молекул, которые постоянно модифицируются. При этом, если биохимия имеет дело с отдельными выделенными молекулами, то в случае с протеомом мы имеем дело с огромным молекулярным пулом (уместно провести аналогию с рыбой, пойманной на удочку, и рыбным изобилием принесенным неводом).
Из этих положений вытекают цели и задачи науки протеомики. Прежде всего, эта дисциплина отвечает за белковую «систематику» – инвентаризацию всех белков, закодированных в геноме определенного организма, которая предполагает также и построение молекулярных белковых атласов отдельных клеток, органов и тканей.
Однако более интересна и намного более существенна задача (назовем ее «физиологической»), которая заключается в определении принципов взаимодействия между белками, а также в установлении закономерностей регуляции их работы при так называемой пост-трансляционной модификации (изменении) белков. Это важно для поиска новых маркеров патологических процессов (болезней) в организме человека.
Дело в том, что пост-трансляционная модификация белков происходит в клетке уже после их синтеза в ответ на какое-либо внешнее возмущение или болезнь. В результате свойства белков могут быстро измениться, что влияет на скорость их синтеза и деградации. В итоге результат таких процессов отразится на общем профиле белков. Изучая его, можно обнаружить белки, «производство» которых в состоянии болезни отличается от «здоровой нормы». Такие белки могут использоваться в диагностических целях в качестве биомаркеров того или иного заболевания.
Функциональная, структурная и медицинская
Протеомика – наука молодая, но исследования в этой области уже имеют хорошую организационную поддержку. В 2001 г. была основана «Human Proteome Organisation» (HUPO) – международная организация, которая объединяет и направляет усилия ученых.
На официальной странице HUPO подробно изложены основные направления исследований, перечень которых может многое сказать даже неспециалисту: протеом человека, протеомика мозга, изучение антител, болезни, вызванные нарушениями метаболизма сахаров, протеомика сердечно-сосудистых заболеваний, протеомика стволовых клеток, определение биомаркеров заболеваний, изучение заболеваний человека на мышиных моделях и т. д.
Методологически в протеомике выделяют несколько направлений, главными среди которых являются функциональная, структурная и медицинская (клиническая) протеомика.
О целях функциональной протеомики уже упоминалось выше. Это получение информации о межбелковых взаимодействиях и их влиянии на экспрессию и модуляцию активности генов, а также пост-трансляционную модификацию белков в составе белковых комплексов.
Структурная протеомика, несмотря на то что является классическим направлением исследования белков, тем не менее, продолжает активно развиваться вследствие усовершенствования аналитических методов, таких как новые варианты ЯМР-спектроскопии, рентгеноструктурного анализа и масс-спектрометрии.
КАК МОЛЕКУЛЫ НАУЧИЛИСЬ «ЛЕТАТЬ»
Медицинская протеомика – новая и перспективная область биомедицинских исследований, позволяющая адаптировать достижения функциональной протеомики, геномики и биоинформатики в буквальном смысле непосредственно «к жизни», т. е. использовать имеющиеся знания для клинического анализа биологических образцов, взятых у пациентов.
Современные достижения
Над поиском протеомных маркеров значимых заболеваний интенсивно работают исследователи всего мира – не только ученые из академических институтов, но и специалисты из исследовательских подразделений крупных и средних фармацевтических компаний.
Уже достигнуты определенные успехи в одной из самых проблемных областей медицины – ранней диагностике тяжелых заболеваний. В первую очередь это относится к раку предстательной железы (Downes et al., 2007; Larkin et al., 2010). Диагностика этого широко распространенного заболевания, проводящаяся по наличию в моче пациента белка простатспецифического антигена, – на сегодняшний день одна из самых ранних и точных.
К настоящему времени достигнуты неплохие результаты и в выявлении маркеров рака молочной железы (Mathelin et al., 2006; Gast et al., 2009). Из-за широкой клинической вариабельности этого заболевания в качестве маркеров предлагается использовать набор из 40 белков. Такой белковый профиль позволяет не только с высокой точностью диагностировать заболевание, но и прогнозировать эффективность лечения. Основные диагностические белки этого набора – гаптоглобин, трансферрин, аполипопротеины A-I и C-I – уже сегодня используются при диагностике рака молочной железы.
Ведутся исследования и по обнаружению маркеров нейродегенеративных заболеваний, таких как болезнь Альцгеймера, склерозов различной этиологии и т. д. (Cedazo-Minguez, Winblad, 2010). В этой области основными прогностическими маркерами являются ангиогенин (фермент, обеспечивающий рост кровеносных сосудов), креатининкиназа, фибриноген, аполипопротеин Е (Bowser, Lacomis, 2009)
В Сибири проблемами структурной и функциональной протеомики интенсивно занимаются в новосибирском Институте химической биологии и фундаментальной медицины СО РАН. В результате совместной работы с НИИ Психического здоровья ТНЦ СО РАМН проведена большая работа по поиску белков-маркеров шизофрении.
Этиология и патогенез этой тяжелейшей психической болезни неизвестны. Согласно одной из теорий возникновения шизофрении, в основе заболевания лежит нарушение белкового обмена. Сравнение протеомных профилей статистически достоверной выборки людей, страдающих шизофренией, и протеомных профилей здоровых добровольцев уже позволило исследователям выявить опредленный набор белков в качестве маркеров: аполипопротеин A-II, фосфомевалонат киназу и сериновую (треониновую) киназу. Дальнейшие усилия ученых будут направлены на уточнение роли этих белков в патогенезе болезни и внедрение этих маркеров в клиническую биохимию.
У работы исследователей-протеомщиков огромный потенциал и перспективы. Учитывая то, что в организме человека число различных белковых молекул и их вариантов может составлять миллионы, ученые уверены, что их высокотехнологичная белковая «рыбалка» будет и в дальнейшем гарантированно приносить богатый улов. Успехи последних лет в этой новой биомедицинской области внушают обоснованный оптимизм.
Cox J., Mann M. Is proteomics the new genomics? // Cell. 2007. V. 130(3). P. 395—398.
Capelo J.L., Carreira R., Diniz M. et al. Overview on modern approaches to speed up protein identification workflows relying on enzymatic cleavage and mass spectrometry-based techniques // Anal. Chim. Acta. 2009. V. 650. N 2. P. 151—159.
Ulrich-Merzenich G., Panek D., Zeitler H. et al. New perspectives for synergy research with the «omic»-technologies // Phytomedicine. 2009. N. 6—7. P. 495—508.
12 методов в картинках: протеомика
Авторы
Редакторы
Отечественному биологу, особенно, молекулярному, все реже и реже приходится писать на родном языке. Понятно, что бóльшая часть научных статей в нашей области создается на нынешнем языке научного общения — английском. Поэтому вместо вступления хочу поблагодарить главного редактора «Биомолекулы» — это он каким-то образом смог заставить меня написать этот текст, пробудив не то графоманский зуд, не то воспаленное эго, не то просто любовь к русскому языку. Но писать мне было легко: волею судеб я уже более пятнадцати лет занимаюсь одним и тем же — идентификацией и количественным анализом белков. То есть тем, что сегодня называется протеомикой. Практически всё, что я об этом знаю, по возможности доступно изложено в следующих строках.
12 биологических методов в картинках
Генеральный партнер цикла — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Одна из главных миссий «Биомолекулы» — докопаться до самых корней. Мы не просто рассказываем, какие новые факты обнаружили исследователи — мы говорим о том, как они их обнаружили, стараемся объяснить принципы биологических методик. Как вытащить ген из одного организма и вставить в другой? Как проследить в огромной клетке за судьбой нескольких крошечных молекул? Как возбудить одну крохотную группу нейронов в огромном мозге?
И вот мы решили рассказать о лабораторных методах более системно, собрать воедино в одной рубрике самые главные, самые современные биологические методики. Чтоб было интереснее и нагляднее, мы густо проиллюстрировали статьи и даже кое-где добавили анимации. Мы хотим, чтобы статьи новой рубрики были интересны и понятны даже случайному прохожему. И с другой стороны — чтобы они были так подробны, что даже профессионал мог бы обнаружить в них что-то новое. Мы собрали методики в 12 больших групп и собираемся сделать на их основе биометодический календарь. Ждите обновлений!
Я был доволен, дней мне не хватало, и жизнь моя была полна смысла.
Братья Стругацкие. Понедельник начинается в субботу
— Десять лет, — со смехом проговорил он, жуя. — Вот через столько он что-нибудь напишет.
Джеймс Джойс. Улисс (пер. с англ. В. Хинкиса и С. Хоружего)
Часть 1. До генома. Идентифицировать можно только то, природу чего ты понимаешь
Физики шутят: «В вашем деле все пойдет на лад, когда биология станет химией, а химия — физикой». История протеомики до ее современного состояния немного напоминает эту шутку. Физики создали могучую технику, а когда науки о жизни стали модной тенденцией, попробовали использовать ее для анализа белков. Вначале разработка физических инструментов стимулировала их использование в биологии и медицине, а результаты — демонстрационные — только намекали на какие-то реальные достижения. Сейчас тот самый момент, когда в этой области просматривается серьезный результат, в том числе для медицины. Я попробую здесь рассказать о развитии высокопроизводительного анализа белков — протеомики, — которое наблюдаю давно, и наблюдаю глазами биолога. Может быть, физики опять пошутят, а вот коллегам-биологам и врачам будет немного легче понять суть происходящего.
Рисунок 1. Главные протеомные вехи. 1950 г. — Группа шведа Пера Эдмана предложила химический метод секвенирования пептидов. 1951–1955 гг. — Под началом британца Фредерика Сэнгера определили структуру короткого белка инсулина и доказали, что отдельные белки не аморфны в плане состава, а обладают постоянной последовательностью аминокислотных остатков. 1959 г. — Американцы Розалин Ялоу и Соломон Берсон создали первый иммуноанализ, в том числе для определения белков. 1967 г. — Создали первый автоматический белковый секвенатор, работающий по методу Эдмана. 1970 г. — Швейцарец Ульрихом Лэммли предложил оптимальный метод гель-электрофореза белков в денатурирующих условиях — с использованием додецилсульфата натрия. 1975 г. — Американец Патрик О’Фарелл и немец Йоахим Клозе независимо изобрели 2D-электрофорез белков и получили первые протеомные карты. 1984 г. — Под руководством американца Джона Фенна разработали ионизацию молекул электрораспылением. Впоследствии она позволила осуществлять масс-спектрометрию макромолекул, включая белки, без их разрушения. 1985 г. — Коичи Танака из Японии предложил мягкую ионизацию макромолекул лазером для масс-спектрометрии. Немцы Франц Гилленкамп и Михаэль Карас применили сходный метод для белков и пептидов. Возник метод ионизации MALDI. 1993-1996 гг. — Несколько групп исследователей предложили идентифицировать белки при помощи масс-спектрометрии фрагментов протеолиза и поиска по предсказанной из генома последовательности. Возникла масс-спектрометрическая пептидная карта (пептидный фингерпринт, или дактилоскопия). 1994 г. — Термин «протеом» как белковое дополнение к геному ввел австралийский аспирант Марк Уилкинс. 1994–1999 гг. — Появились первые поисковые программы для идентификации белков масс-спектрометрией по геномным последовальностям. Протеомика стала доступна широкому кругу пользователей. 1999–2001 гг. — Скорострельная (shotgun) протеомика. Несколько научных групп предложили применять для идентификации смеси пептидов совмещение высокоэффективной жидкостной хроматографии и тандемной масс-спектрометрии. Использовали ионизацию электрораспылением. 2000–2005 гг. — Российский физик Александр Макаров, работающий за рубежом, изобрел ионную ловушку нового типа — Orbitrap. Приборы на основе Orbitrap ввели в эксплуатацию. Масс-спектрометрия высокого разрешения демократизировалась и начала широко использоваться в протеомике. 2005 г. — Американцы Кристи Хантер и Ли Андерсон продемонстрировали использование масс-спектрометрического метода мониторинга множественных реакций (MRM) для количественного анализа природных пептидов. Возникла направленная (таргетная) протеомика. 2007 г. — Под руководством американца Стивена Гиги предложили новый метод оценки уровня ложноположительных результатов скорострельной протеомики с использованием «фальшивых» последовательностей (анализ target-decoy). 2012–2014 гг. — Скорострельная протеомика достигла уровня идентификации около 10 тысяч белков человека в одном образце — примерно половины кодируемых в геноме. Под руководством немца Бернхарда Кустера и американца Ахилеша Пандея независимо были опубликованы работы, декларирующие черновые версии полного протеома человека.
Переместимся в то время, когда матричные процессы передачи информации в клетке уже были вчерне изучены (рис. 1). Было понятно, как in vivo синтезируются белки, из каких аминокислот они состоят. В то же время, в начале 1980-х годов, уже развилась молекулярная иммунология, возникла техника получения моноклональных антител [1]. Начали развиваться методы получения рекомбинантных белков, подпитываемые изобретением полимеразной цепной реакции [2]. Достигли совершенства методы разделения биомолекул — разные виды хроматографии и электрофореза [3].
Ферментативная активность — первые знания о белках
Это внутриклеточные ферменты, организующие в клеточных митохондриях связь метаболизма углеводов и аминокислот. Их появление в крови свидетельствует о разрушении клеток печени.
Рисунок 2. Мясной фарш как источник исследования ферментативной активности.
Антитело как идентификатор от противного
Кроме оценки активности, с 1970-х годов у исследователей появилась еще одна возможность количественно измерять белки, не зная их структуры. Речь идет об использовании антител, особенно моноклональных [1], получение которых изобрели в 1975 г.; подробнее об этом рассказывает статья «12 методов в картинках: иммунологические технологии» [4]. Антитела можно вырабатывать к очищенным компонентам, а можно и к целым тканям, клеткам или фракциям. Причем если они моноклональные, то система их получения и их аналитические характеристики сохраняются без изменений от одной партии к другой. Если мы знаем, против чего были антитела, то есть использовали очищенный и идентифицированный другим, «ортогональным» методом антиген, то полученное связывающее вещество — антитело — может широко использоваться для его повторной идентификации в сложных смесях. Интереснее с антителами, полученными к неизвестным антигенам. Не имея понятия о структуре антигена, такие антитела стали использовать для диагностики злокачественных опухолей. Некоторые из них связывали намного больше своего антигена у больных людей, чем у здоровых. Методику оценки стандартизовали и стали использовать такие моноклональные антитела для диагностики, точно не зная химической структуры антигена. Ярким примером такого подхода служит гликопротеин CA-125, открытый Робертом Бастом с соавторами в виде антитела к нему в далеком 1981 году [5]. Лишь значительно позже идентифицировали ген этого продукта и сам белок — муцин 16.
Выделение чистых белков и секвенирование по Эдману
Тем не менее к 1970-м годам биохимиков перестала удовлетворять работа вслепую, например, измерение активности ферментов и других соединений без представлений об их химической структуре. Появились способы очистки белков, которые сочетали принципы хроматографии, электрофореза, центрифугирования, некоторые из которых исчезли из обращения, а другие используют до сих пор [3]. Отдельной задачей было подтвердить чистоту соединений во фракциях после очистки. Для этого использовали спектральные методы (от простых до сложных), а также визуализацию окрашенных полос при электрофорезе. Получение из биоматериала выделенного хотя бы до 90% чистоты белка без использования антител и других специфических связующих веществ и тогда, и сейчас — длительный трудоемкий процесс. 1970–1980-е годы — золотой век развития методов разделения белков, когда заливали огромные гели для электрофореза, конструировали метровые колонки для ручной и автоматической хроматографии.
Если вам повезло, то после нескольких месяцев или лет кропотливой работы вы убедились, что в пробирке или в геле находится ваш «товар» — белок, функцию которого вы изучаете. Какие варианты его идентификации у вас есть, если вы пока в веке двадцатом? Во-первых, если у вас есть гипотеза по поводу того, что в вашей пробирке, вы можете использовать известные антитела, если они есть в продаже или любезно предоставлены владельцами. Конечно, если сегодня доступны антитела разных видов к большинству белков человека и модельных животных, в то время их ассортимент был гораздо более скромным. Поэтому шанс на окраску интересующей вас молекулы антителами очень мал. Но не отчаивайтесь! Еще в 1950-е годы шведский химик Пер Эдман разработал метод секвенирования пептидов (рис. 3).
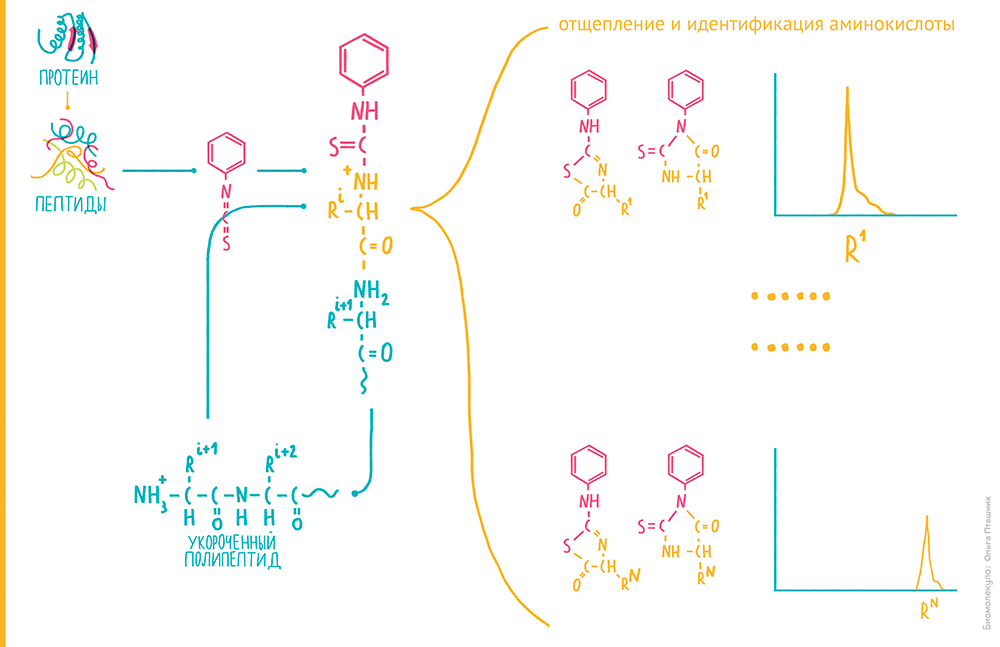
Рисунок 3. Секвенирование белков по Эдману. Если обработать пептид изотиоцианатом фенила (ФИТЦ), электрофильный атом углерода на изотиоцианатном радикале при умеренном подщелачивании взаимодействует с нуклеофильным азотом незаряженной аминогруппы. В итоге на N-конце пептида образуется фенилтиокарбомоильный радикал. Если умеренно закислить реакционную смесь, он отщепляется, увлекая с собой N-концевую аминокислоту, с образованием тиазолинона со специфичным радикалом, характеризующим эту аминокислоту. При этом остальная часть аминокислотной цепи остается неизмененной. Особое производное, которое будет отличаться по присущему аминокислоте радикалу, еще раз преобразуют в кислых условиях — для стабилизации — и анализируют хроматографически. Так можно отличить такие производные для всех аминокислот, поскольку из-за характерного радикала они будут характеризоваться своим временем выхода с обращенной фазы [3]. Если белок или пептид, который мы анализируем, присоединен к твердофазному носителю, производное N-концевой аминокислоты можно смыть и анализировать отдельно, а цикл анализа повторить, выстраивая таким образом аминокислотную последовательность.
Метод Эдмана был по тем временам очень прогрессивен. Он с высокой точностью предоставлял последовательность до 30 аминокислотных остатков. Характеризовался достаточно высокой чувствительностью, будучи способным секвенировать пептиды в количестве менее 0,1 нмоль с 99% точностью. Более того, в конце 1960-х его автоматизировали в виде пептидного секвенатора, где робот-раскапыватель поочередно снимал N-концевые производные с полипептидов, закрепленных на специальной бумаге, направляя их затем в хроматограф. Но исследователям опять хотелось большего — их не устраивала необходимость в очистке пептидов и белков перед секвенированием, а также некоторые другие ограничения эдмановского метода, в частности, его неспособность секвенировать продукты с модифицированным N-концом.
Небольшой интерес к методу Эдмана существует до сих пор, в особенности, для белков и пептидов тех организмов, последовательность которых нельзя предсказать из данных секвенирования нуклеиновых кислот [6]. В этом методе реализуется прямой анализ, где ошибки связаны с технической погрешностью. Последовавшие за ним способы анализа аминокислотной последовательности содержат элементы предсказания, поэтому к техническим ошибкам в них прибавляются алгоритмические (см. ниже).
Двумерный электрофорез — первая карта протеома
Как я уже упоминал выше, при подготовке к качественному и количественному анализу белков использовали обычные методы разделения молекул [3], в том числе электрофорез. В 1970 году в электрофорезе белков произошла методическая революция — швейцарец Ульрих Лэммли предложил оптимальный метод гель-электрофореза в денатурирующих условиях. Белки жестко денатурировали амфифильным веществом, вроде мыла — додецилсульфатом натрия, — за счет чего каждая молекула покрывалась слоем из этого детергента. Суммарный отрицательный заряд такого комплекса оказывался примерно пропорционален молекулярной массе белка. Это позволяло делить белки в полиакриламидном геле хотя и с помощью электрического поля, но по молекулярной массе. По справедливости отметим, что Лэммли не изобрел метод de novo, а лишь оптимизировал его по существующим в литературе предпосылкам. За это, кстати, его работа сейчас входит в пятерку самых цитируемых в мире научных статей [7]. Разработки в этой области публиковали и ранее, в том числе в 1967 г. американец Арнольд Шапиро с соавторами [8].
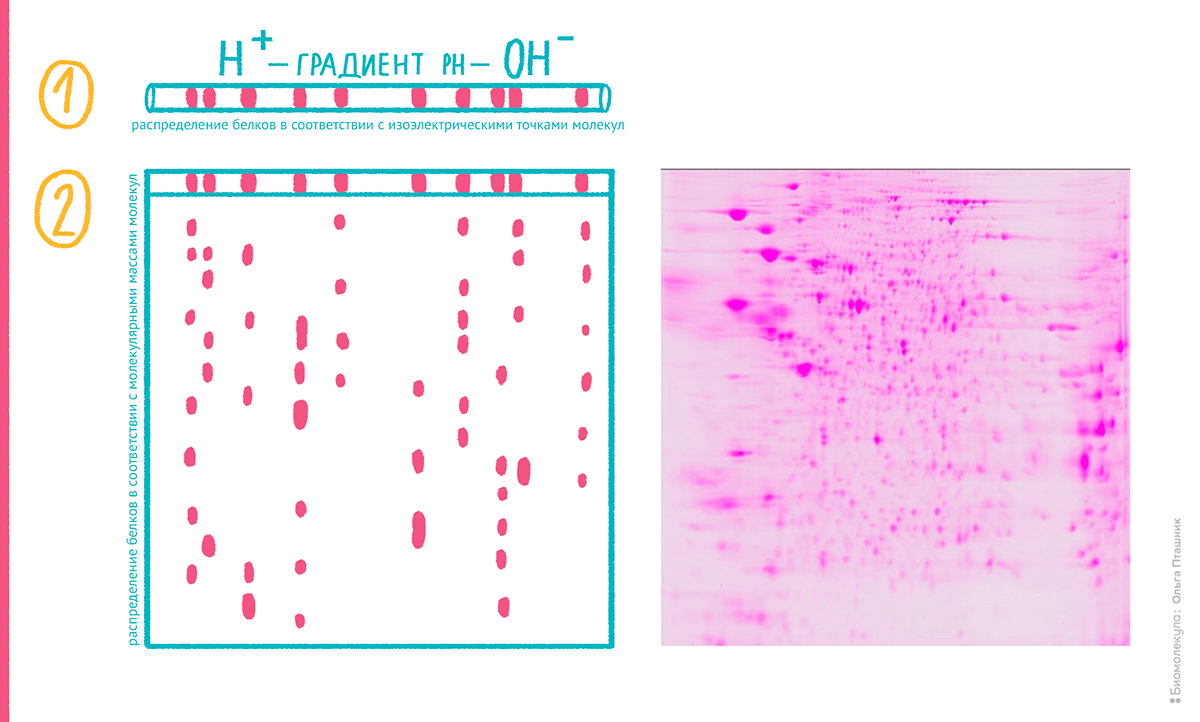
Хорошо принятый метод Лэммли стал совершенствоваться и комбинироваться с другими видами разделения белков. В 1975 году американец Патрик О’Фарелл и немец Йоахим Клозе независимо предложили комбинировать денатурирующий электрофорез в геле с предварительной электрофокусировкой белков. Фокусировку проводят в относительно тонкой, толщиной с гель (1–2 мм) стеклянной трубке [9]. Трубку заполняют гелем со специальными полимерами — амфолинами, — которые способны создавать в ней неподвижный градиент рН. Таким образом, при движении в электрическом поле нанесенные в эту трубку белки останавливаются в участке, где амфолинами был достигнут рН, равный изоэлектрической точке молекулы белка. Гель в виде тонкого тяжа выдавливают из трубки и приплавляют к готовой гелевой пластине для обычного денатурирующего фореза по Лэммли, после чего проводят разделение в другом направлении. Белки, вначале распределенные по изоэлектрической точке, теперь движутся в зависимости от их молекулярной массы. Полученный метод справедливо называется двумерным (2D) электрофорезом (рис. 4). Как можно предполагать, каждый белок на итоговой пластине геля после окраски выглядит не как полоса (в отличие от обычного денатурирующего геля), а как сфокусированное, округлое пятно. Таким образом, О’Фарелл и Клозе впервые показали белковую карту, где каждое пятно на большой пластине геля (до 40×40 см) представляет одну изоформу белка, а его размер и интенсивность — более или менее пропорциональны его концентрации.
Рисунок 4. Схема двумерного электрофореза белков и реальная электрофореграмма, окрашенная флуоресцентным красителем.
Искусные руки биохимиков прошлого многократно усовершенствовали метод двумерного электрофореза, который был ведущим в анализе белков до середины 2000-х годов. Вместо заливки трубок амфолины размещали на готовых полосках. Были предложены разные устройства для приготовления гелевых пластин, разных модификаций процесса электрофореза, причем для разных размеров и толщины геля в зависимости от задачи исследования. По чувствительности совершенствовали красители, в том числе, флуоресцентные. Более того, на волне популярности двумерных гелей, некоторые процессы их приготовления и окраски автоматизировали. Поскольку характеристики окрашенных пятен косвенно связаны с количеством белка в пробе, привлекательно сравнивать изображения гелей, полученные из одних и тех же образцов в различных условиях. Процесс обработки изображений гелей также автоматизировали, причем появилось много конкурирующих компьютерных программ, осуществляющих обработку и сравнение сканов двумерных гелей.
В зависимости от интервала концентраций находящихся в биоматериале белков, число отдельных пятен на двумерных гелях достигало 5 тысяч. С сегодняшней точки зрения очевидно, что это не означает, что на геле визуализированы продукты 5 тысяч генов. Изоформы одного генного продукта, которые отличаются по последовательности за счет гетерозиготности или протеолиза или по более тонкой структуре за счет модификаций остатков, будут, как правило, отражаться в виде отдельных пятен. Например, отщепление одного остатка аргинина от небольшого белка альфа-амилоида так существенно меняло изоэлектрическую точку, что на геле пятно перемещалось примерно на 10 см [10].
Тем не менее двумерная электрофореграмма с визуализированными тысячами белков может считаться первым протеомом — то есть, первым видом анализа, в котором определяется всё множество белков, присутствующих в биологическом образце, или существенная их доля. Отмечу, что этот метод был развит существенно задолго до появления термина «протеом», но об этом чуть позже.
Предположим, мы проанализировали путем двумерного электрофореза образцы опыта и контроля, например, клеточные линии после обработки лекарственным веществом и без такой обработки. Получили похожие карты-электрофореграммы, но десять пятен после обработки появились, пять исчезли полностью, и еще какое-то количество изменило свою интенсивность. Что нам можно сделать, если мы находимся в 1990 году? Всё, о чем мы говорили ранее. Применить метод Эдмана. Покрасить электрофореграмму антителами, которые есть в наличии, то есть осуществить вестерн-блоттинг [4]. Для обоих вариантов белки с геля с использованием электрического поля переносят на бумажную или подобную ей мембрану, с которой уже осуществляют дальнейшие манипуляции. Ограничения использования антител понятны — они, хоть и чувствительны, видят только свои мишени. Ограничение эдмановского метода здесь — чувствительность. Он хорошо работает от десятков и сотен пмоль белка, а современные красители «видят» пятна, в которых содержатся 2,5–5 пмоль. Учитывая потери при переносе на мембрану и вероятную потребность в расщеплении белков на пептиды, осознаем, что метод Эдмана сможет справиться с меньшей частью из визуализированных на хорошем геле белковых пятен.
«Звездное небо» двумерного электрофореза — первый и последний способ увидеть протеом воочию. Более того, при качественной постановке методики человеческого глаза вполне хватает, чтобы обнаружить отличия между похожими пластинами с гелем. Последующие методы протеомики, рассказ о которых впереди, образуют «большие данные», невидимые, как божество. Это обстоятельство во многом сохраняет популярность «двумерника», который используют по сей день, хотя и не так часто, как раньше. Тем не менее в продаже до сих пор имеется оборудование и программное обеспечение для полного цикла выполнения этой методики.
По личным впечатлениям, двумерный электрофорез белков — одна из самых трудоемких и сложных для выполнения биохимических процедур, в которой используются десятки стадий, реагентов и несколько типов лабораторного оборудования. В лаборатории мы в шутку называли тех, кто ставит двумерный электрофорез, «протеомными художниками». И действительно, постановка метода длится два—три дня и требует существенной концентрации на всех ее этапах. Малейшая оплошность приводит к существенному искажению «картины» на геле. Метод не автоматизируется целиком, что и было одной из причин снижения его популярности. Однако он получил второе дыхание уже на рубеже веков, когда в науку ворвался полный геном, а в протеомику вслед за ним — масс-спектрометрия.
«Диаэм»: современное оборудование для протеомного анализа
Материал предоставлен партнёром — компанией «Диаэм»
Часть 2. Постгеном
Протеомика как постгеномная технология
Real talk, think about it, господа аспиранты.
Строго говоря, истинные омиксы — это анализ продуктов передачи геномной информации, то есть кодирующих и некодирующих РНК и белков. Остальные омиксы, по сути, косвенные. Они не связаны с генетическим кодом прямым потоком информации и объединяются в группы по химической природе анализируемых соединений. Примечательно, что омикс-технологии производят одновременный анализ тысяч соединений, например, метаболитов, липидов, гликанов и т.д., и называются, соответственно, метаболомикой, липидомикой (частично они перекрываются), гликомикой и т.д. Энтузиасты последнего десятилетия — эпохи слоганов и мемов — придумали невероятное количество «омик», в том числе достаточно комичные. Число разных употреблений суффикса «омика» или «омикс» к 2010 году превзошло две сотни, что позволило пошутить на эту тему даже «гражданскому» Wall Street Journal, обозвавшему процесс «инкризингомикой» [13].
Явление масс-спектрометрии белковому народу
Точное измерение молекулярной массы химического соединения — желанная цель аналитической технологии. Действительно, это знание решает многие проблемы, а иногда, при наличии дополнительной информации, обеспечивает идентификацию искомого вещества. Масс-спектрометрия — набор методов, направленных на измерение молекулярной массы соединений. Этот подход развивался еще с конца 19 века, когда сэру Джозефу Джону Томсону удалось создать масс-спектрограф, состоящий из газоразрядной трубки, разделяющей по траекториям движения заряженные частицы с разной молекулярной массой. Затем Артур Дэмпстер разработал. Но стоп! В этой статье невозможно охватить всю историю масс-спектрометрии, да в этом и нет необходимости, поскольку это много раз делалось профессионалами [14]. Мне, биохимику по специальности, уместно будет предложить обзор этой увлекательной области в биологическом контексте, чтобы навести мосты между сложной физической техникой и ее биомедицинским применением.
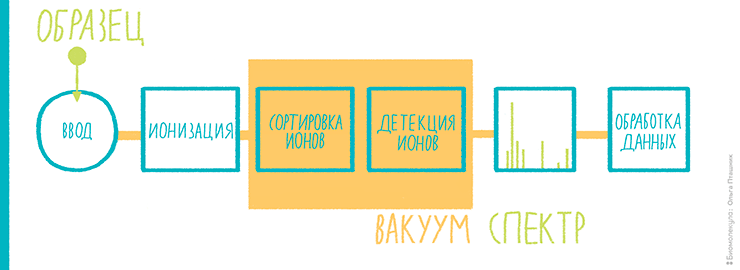
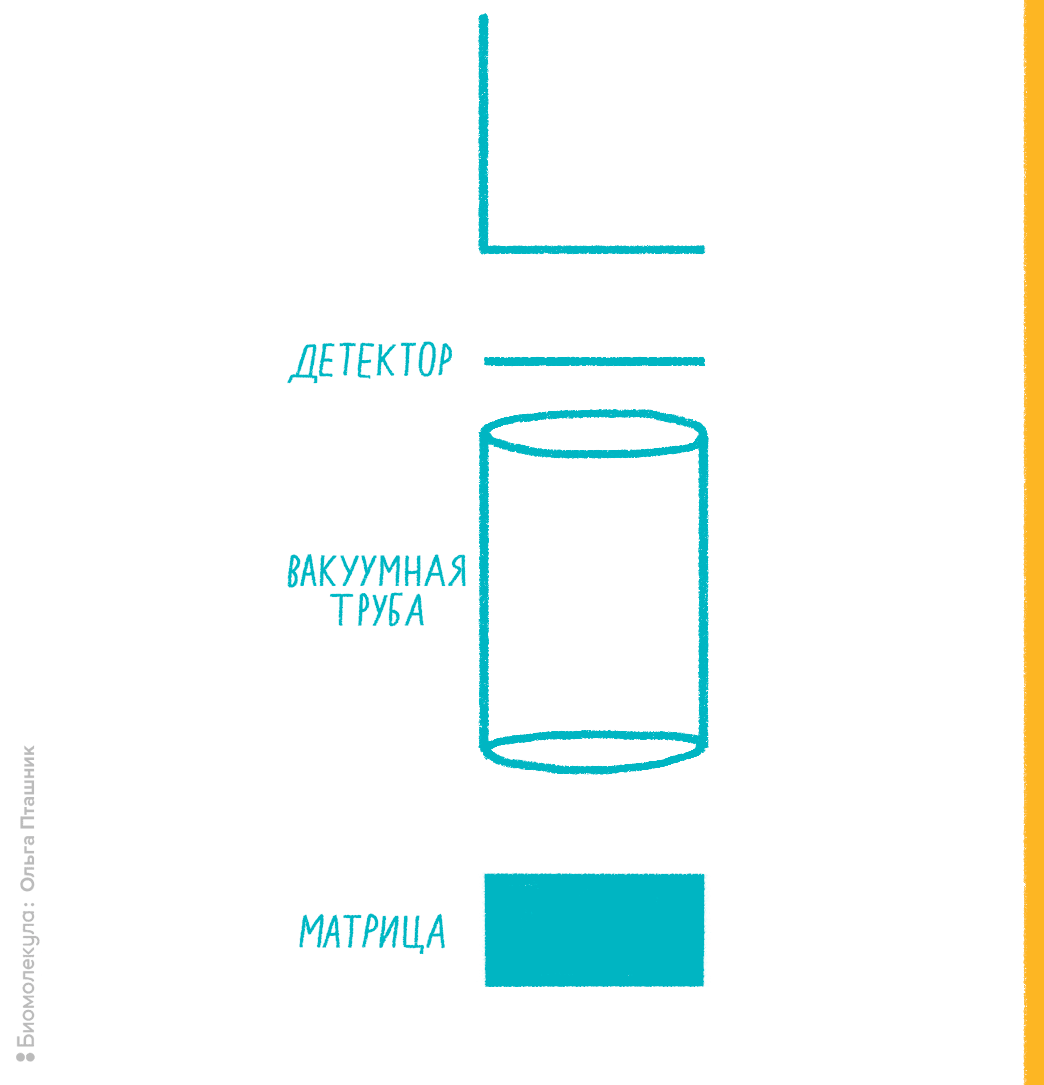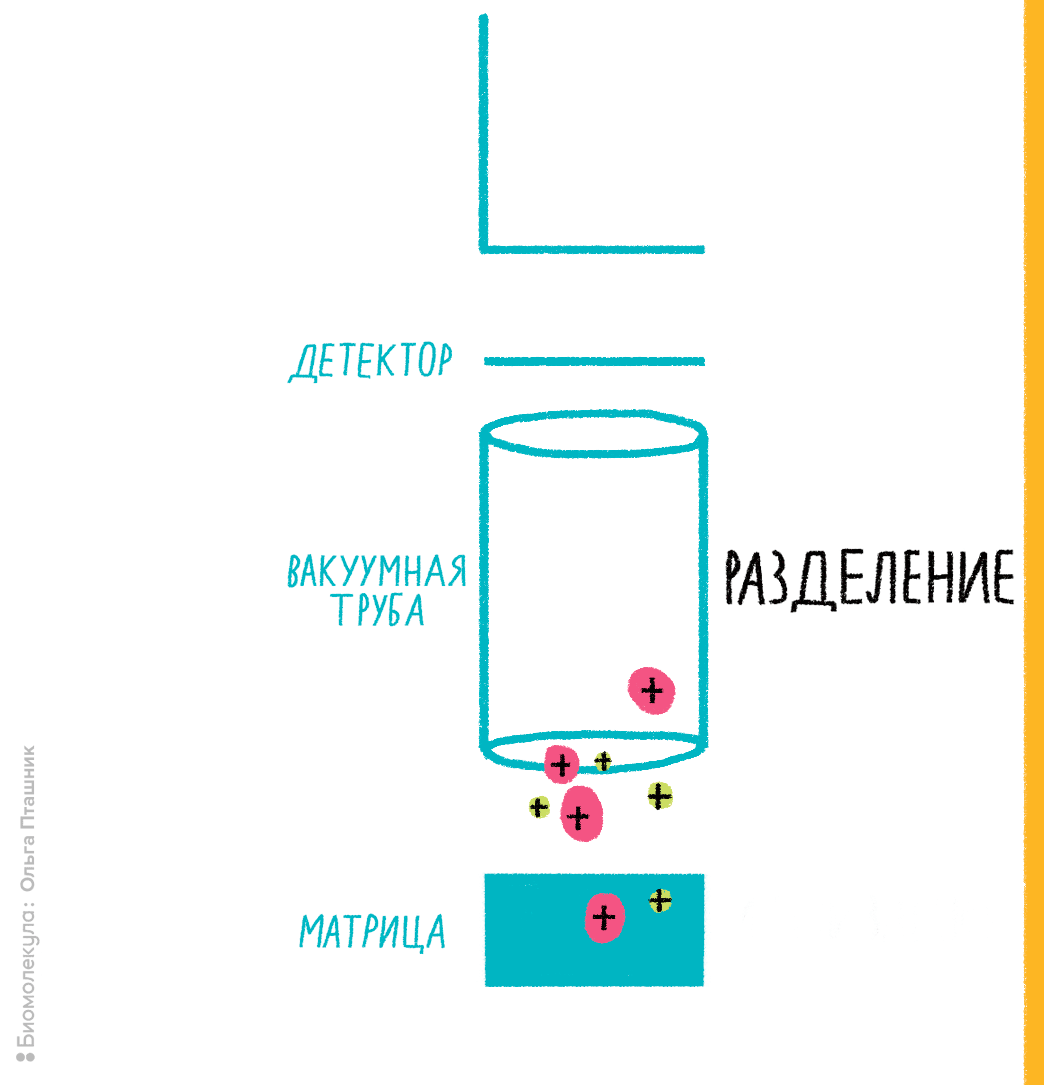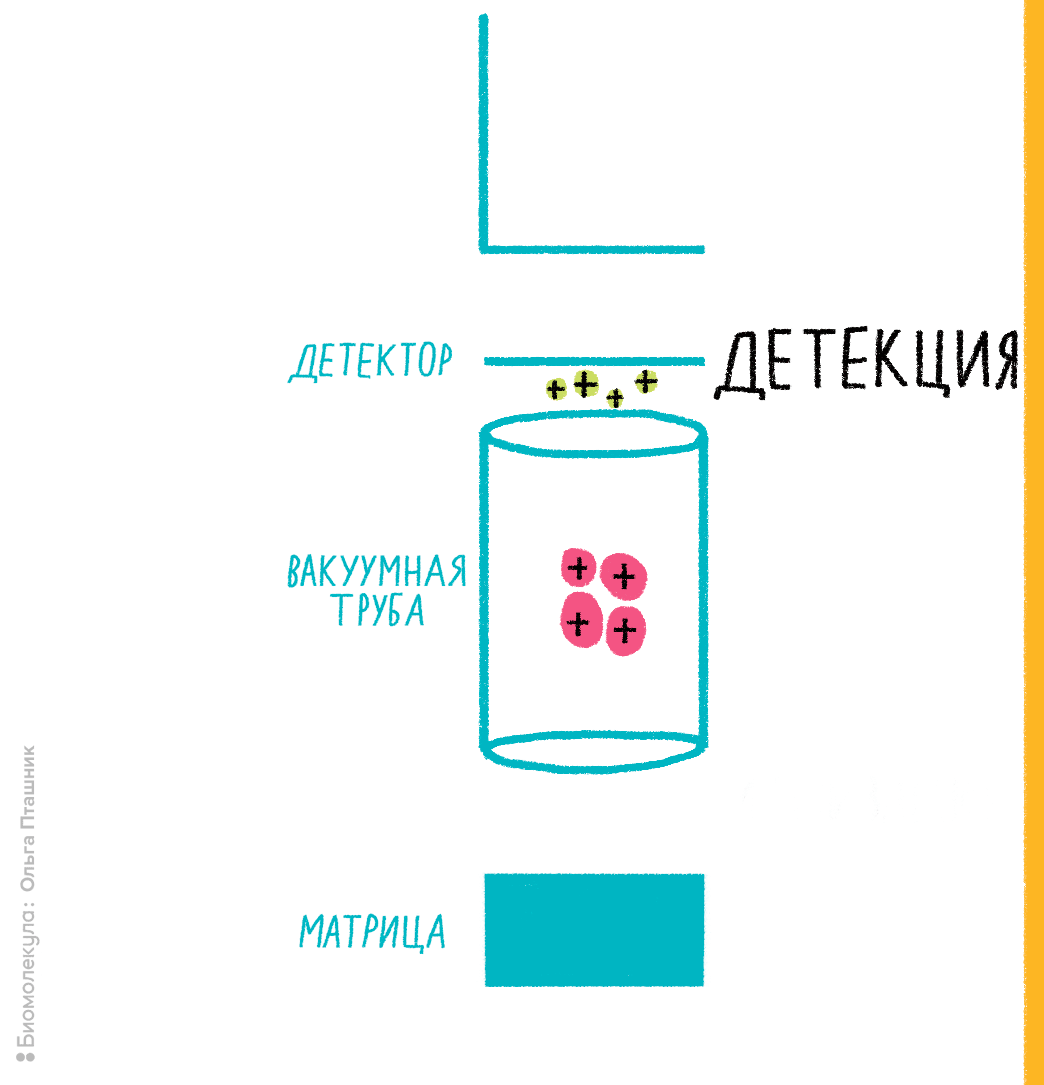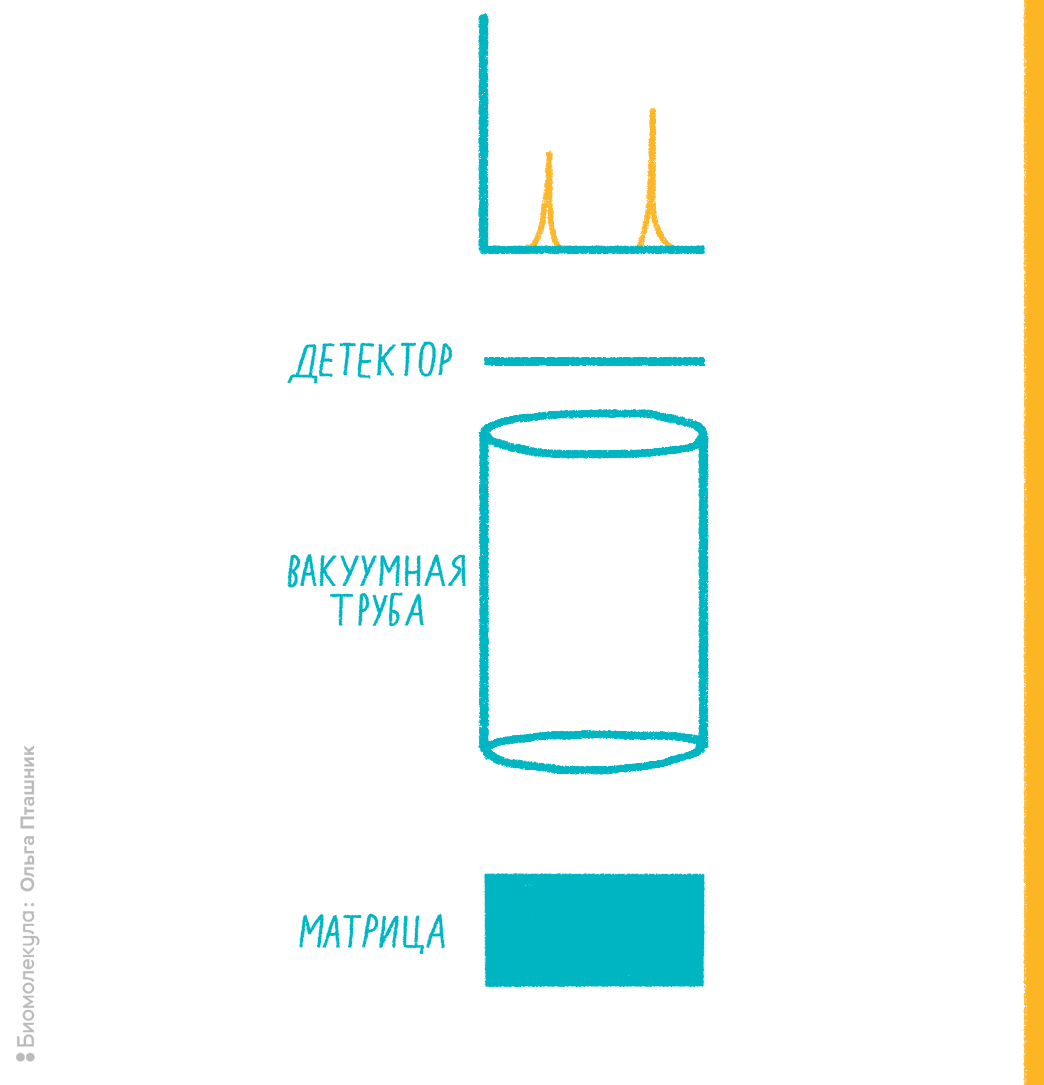
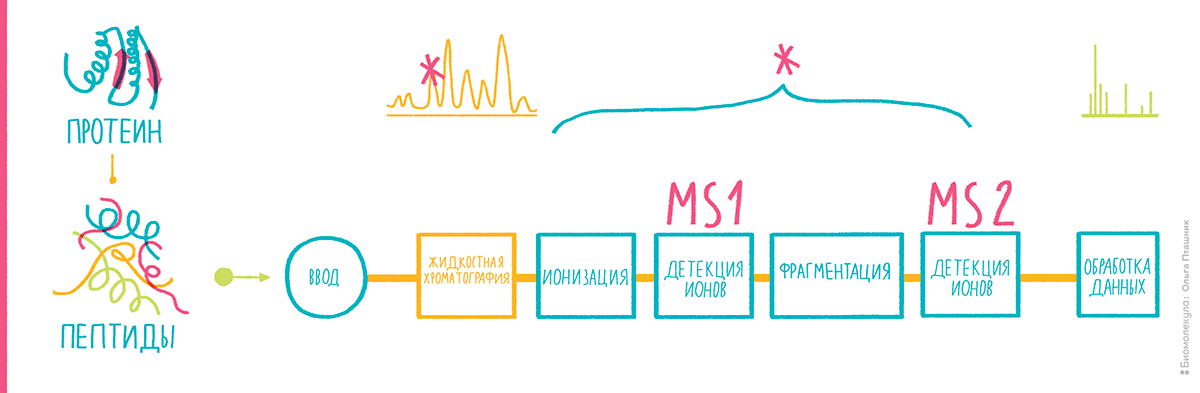
Нам, биологам, придется поверить, что нет никакого другого способа измерить молекулярную массу, кроме как заставить молекулы двигаться. И сразу же после этого поверим в то, что заставить молекулы двигаться можно только в заряженном виде, то есть обратив их в ионы. Так что первый этап масс-спектрометрического анализа (рис. 5) — это ионизация. Первые методы ионизации были жесткими, так что макромолекулы в них не сохранялись. Успехи масс-спектрометрии в биологии, как будет ясно из дальнейшего, связаны с возможностью ионизировать биомолекулы, не разрушая их. После ионизации анализируемые соединения под воздействием электрического поля надо переместить в детектор, который поставит особенности движения молекул в электромагнитном поле в соответствие их молекулярной массе, а точнее, отношению молекулярной массы и заряда. Проще говоря, если две разные молекулы несут одинаковый заряд, но отличаются по массе, приложение к ним одинакового электрического поля заставит их летать по-разному. Если обучить, то есть откалибровать детектор с использованием стандартов с заведомо известными массами, можно, оценивая движение неизвестных ионов, определять их отношение массы к заряду. Если заряд равен единице (то есть мы имеем дело с однозарядными ионами), отношение численно равно молекулярной массе.
Рисунок 5. Примерная схема масс-спектрометрии для протеомики.
Масс-спектрометрия сегодня — гигантская область, активно используемая почти во всех областях промышленности, в химии, биологии, медицине, охране окружающей среды. Более того, в Манхэттенском проекте и, вероятно, в советских ядерных проектах при помощи масс-спектрометра обогащали радиоактивный уран, разделяя его на изотопы. На самом крупном форуме по масс-спектрометрии — конференции Американского масс-спектрометрического общества — ежегодно собирается до 15 тысяч участников. Доля биомедицинских методов в масс-спектрометрии продолжает расти вместе с вложениями в биотехнологии в целом.
Проклятие изотопного распределения
Создание масс-спектрометров совпало по времени с обнаружением у химических элементов разных изотопов. Решая химические задачи в школе или проводя различные биологические эксперименты, мы зачастую не задумываемся, что важные элементы, составляющие органические вещества (C, O, N, S), содержат значимую долю стабильных изотопов, отличающихся по массе от номинальных, указанных в таблице Менделеева. Биологи сталкиваются с радиоактивными изотопами, которые еще недавно использовались для мечения биомолекул. Проблему стабильных и радиоактивных изотопов хорошо знают археологи и палеонтологи — с помощью них они датируют свои находки [15]. Но в большинстве молекулярно-биологических экспериментов помнить об этих примесях нет нужды.
Отношение стабильных изотопов для каждого элемента — это некоторое свойство материалов. Интересно, что такие отношения стабильных изотопов различны в разных средах, например, в пресной и морской воде, в горных породах, а также в разные периоды существования Земли и других небесных тел. Поэтому измерение этого параметра в разных условиях вызывает серьезный интерес в разных областях естественных наук [16]. Но для изучения точных масс белков и пептидов в протеомике существование стабильных изотопов — это своего рода проклятие.
Современные масс-спектрометры способны разрешить пики с разностью молекулярных масс намного меньше 1 Да.
Накапливаются сведения о разном поведении стабильных изотопов одного и того же элемента в химических и биологических процессах [16]. Однако в большинстве случаев работает допущение, что свойства соединений одного строения с разным изотопным составом одинаковы.
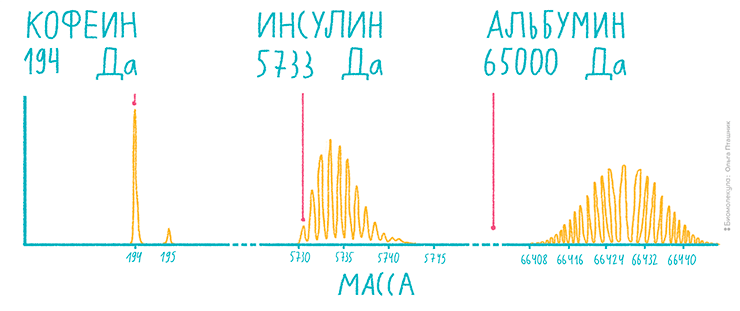
Рисунок 6. Схемы изотопного распределения молекул от низкомолекулярных метаболитов до белка. Чем тяжелее ион, тем ниже интенсивность самого высокого пика. Красной отметкой показана моноизотопная масса — она рассчитывается, как будто в веществе присутствует только основной изотоп.
Число ионов каждого вещества, перенесенного в детектор масс-спектрометра, очевидно, составляет сумму интенсивностей всех изотопных пиков, относящихся к соединению. Также это количество можно выразить в виде площади под касательной, проходящей по вершинам этих пиков. Представим, что в детектор поступили несколько тысяч ионов аминокислоты массой 150 Да и столько же — белка массой 15 000 Да. Аминокислота даст 2–3 основных, очень высоких пика, причем первый будет самым интенсивным, а белок — несколько десятков, но гораздо более низких, с вершиной этой пологой горки где-то посередине. Ясно, что высокую скалу, стоящую посреди ровной степи, заметить гораздо проще, чем маленький холмик, края которого еще и сливаются с высокой травой — техническим шумом, сопровождающим запись масс-спектра.
Итак, чувствительность масс-спектрометра характеризуется обратной зависимостью от молекулярной массы анализируемого соединения. Чем выше эта масса, тем менее интенсивен максимальный пик среди всех изотопных вариантов соединения. Кроме того, огромное количество этих пиков затрудняет интерпретацию масс-спектра. Вот почему в современной протеомике белки перед анализом чаще всего разлагают на пептиды молекулярной массой 500–2500 Да, обозначая такой подход «протеомикой снизу вверх» (bottom-up). Именно такие пептиды удобно анализировать в масс-спектрометре. Расщепление белков обычно проводят наиболее специфичной из протеаз — трипсином, который с высокой специфичностью осуществляет протеолиз по пептидной связи правее остатков лизина и аргинина. Потребность в расщеплении белков я называю проклятием, поскольку при этом происходит потеря информации. В современных протеомных конвейерах, где такое расщепление производится без предварительного разделения, белки после анализа приходится собирать заново, разумеется, небезошибочно. Ситуация напоминает сборку нуклеотидных последовательностей после секвенирования нового поколения [6], но у последней есть преимущество, поскольку там фрагменты гораздо чаще перекрываются друг с другом.
Несмотря на огромную путаницу в масс-спектрах больших белков, многие исследователи продолжают работу с ними без расщепления. Такой подход называют протеомикой «сверху вниз» (top-down). Для получения качественных масс-спектров целых белков используют мощные детекторы сверхвысокого разрешения. Тем не менее пока не удалось создать метод top-down, надежно и воспроизводимо анализирующий белки в масштабах целого протеома.
Масс-спектрометрия MALDI-TOF и пептидная дактилоскопия
Обычно матрицы представляют собой низкомолекулярные органические кислоты, производные коричной, бензойной и других кислот.
Совместно с Джоном Фенном, применившим для биомолекул ионизацию электрораспылением, и Куртом Вютрихом (вообще за ЯМР). Примечательно, что исследование К. Танаки было обнародовано в виде патента, а его основная статья опубликована в скромном специализированном журнале Rapid Communications of Mass Spectrometry. Сам он — инженер-исследователь в частной компании — не имел ученой степени. Как и во многих других случаях, в присуждении премии Танаке было противоречие. Одновременно большой вклад в применения MALDI для белков внесли немцы Франц Гилленкамп и Михаэль Карас.
Рисунок 7. Примерная схема MALDI-TOF-масс-спектрометрии.
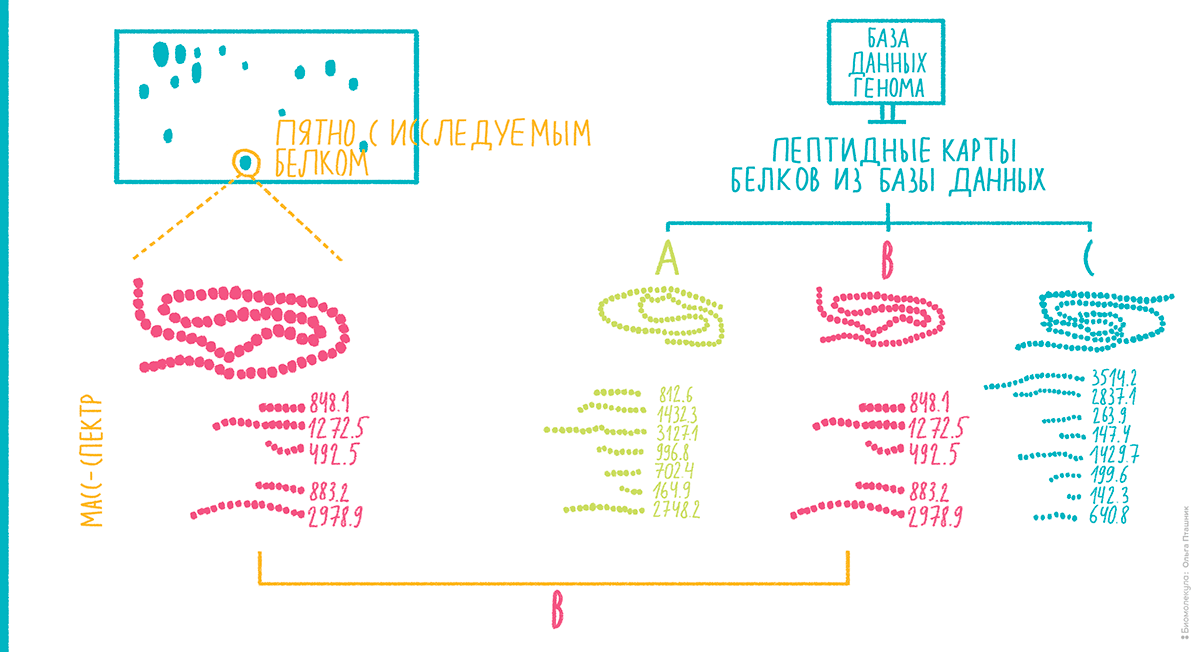
В 1990-е и в начале 2000-х простой и надежный MALDI-TOF-масс-спектрометр стал одной из рабочих лошадок протеомики. Как было сказано выше, основным методом разделения белков в масштабах протеома в то время был двумерный электрофорез. Если вырезать из геля пятно с белком некоторой степени очистки и расщепить связанный с гелем денатурированный белок трипсином, совокупность пептидов этого изолированного белка составит более или менее уникальный набор молекулярных масс — по крайней мере, в пределах отдельно взятого протеома. Это происходит, в первую очередь, из-за высокой специфичности трипсина и уникального распределения лизина и аргинина, по которым происходит расщепление, в разных последовательностях. Набор масс пептидов каждого белка напомнил исследователям об использовании для идентификации личности отпечатков пальцев, поэтому новый подход получил название масс-спектрометрического пептидного картирования, пептидного фингерпринта, или, как лучше сказать по-русски, пептидной дактилоскопии (рис. 8) [17].
Рисунок 8. Принцип масс-спектрометрического пептидного картирования.
Идея пептидной карты белка пришла к масс-спектрометрии через развившуюся к тому времени высокоэффективную жидкостную хроматографию [3]. Очищенные белки могли расщепляться протеазой на пептиды, а их анализ на хроматографе давал уникальную пептидную карту. Если определить стандартизированное время выхода каждого из пептидов с хроматографической колонки, по такой хроматографической пептидной карте можно идентифицировать белок [18]. Теперь такой параметр, как время выхода, решено было заменить на более точный и легко формализуемый показатель — определяемое в масс-спектрометре отношения массы к заряду пептидного иона.
Как же формально оценить соответствие наблюдаемого масс-спектра и теоретических представлений о последовательностях белков? Вначале необходимо «расщепить» все белки трипсином виртуально и составить из них базу данных для сравнения со спектрами. Вот тут протеомика и становится постгеномной — ведь без теоретических последовательностей комбинаций станет слишком много, и прогнозирование совпадения перестанет быть возможным. Далее необходим метод оценки вероятности того, что наблюдаемый набор пептидов относится к конкретному белку. В первом воплощении для решения этой задачи использовали подсчет вероятности того, что набор пиков не случаен. Если кто-то помнит из курса статистики, похожие вероятности высчитывают при изъятии из мешка вслепую шаров разных цветов. В нашем случае нужно ответить на вопрос, случайным ли образом насыпались в наш спектр из большого мешка всех возможностей шары-пептиды определенных масс? Если совпадение сильно не случайное, система присваивает нашему спектру высокий вероятностный коэффициент (score).
Одним из первых алгоритмов для пептидной дактилоскопии стал MOWSE [19], который лег в основу широко известной специалистам программы Mascot. Хочу обратить внимание на важный момент в развитии протеомного анализа. С момента введения в обращение метода пептидной дактилоскопии идентификация белков и пептидов превратилась из измерения в предсказание. Таким образом, каждый идентифицированный таким методом белок характеризуется расчетным параметром вероятности того, что это действительно он. Когда мы красим гель антителами, наличие пятнышек на вестерн-блоте ничего подобного нам не скажет. Так протеомика вступила в эпоху «поисковых машин» — программ, которые сравнивают взятые из генома теоретические последовательности с наблюдаемыми масс-спектрами и возвращают вероятность того, что эти спектры получены из соответствующих белков и пептидов.
Пептидная дактилоскопия представляет собой метод анализа расщепленных белков. Параллельно MALDI-TOF стали использовать для исследования целых белков в сложных смесях — в анализе «сверху вниз». Белковые профили крови пациентов с разными заболеваниями, различные бактериальные и эукариотические клетки анализировали целиком и сравнивали полученные масс-спектры в разных группах для целей клинической диагностики и идентификации различных состояний. Масс-спектр использовали как образ, обучая алгоритмы известным случаям, и эффективно распознавая новые случаи. Если применение такого подхода для анализа белков крови в диагностике злокачественных опухолей оказалось недостаточно надежным для внедрения, метод анализа целых бактериальных клеток стал более успешным и сейчас используется в клиниках [20]. Способы, реализуемые на очень простом масс-спектрометре, и прилагаемые к нему специально обученные алгоритмы способны идентифицировать до видов и родов патогенные микроорганизмы, причем анализ MALDI-TOF применяется к целым клеткам бактерий. Их наносят на металлическую мишень масс-спектрометра, покрывают матрицей и облучают лазером для получения специфичных профилей, распознаваемых алгоритмом по характерным массам.
Тандемные масс-спектры и протеомный поиск
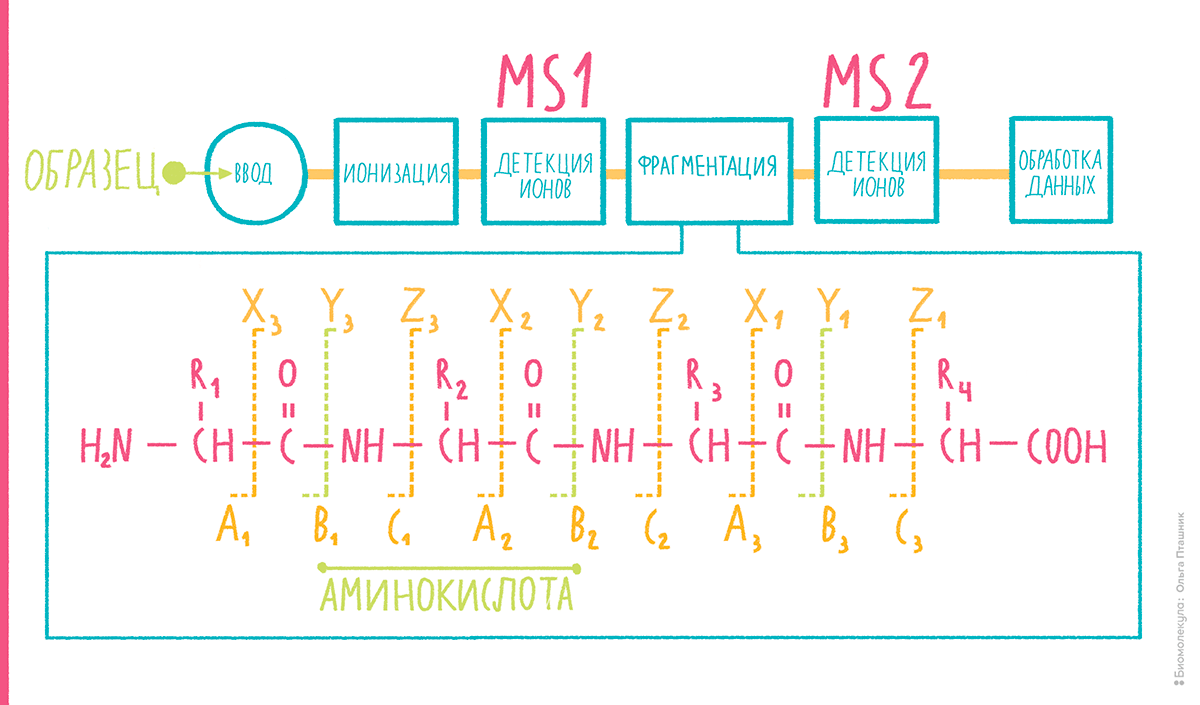
Вытаскивание разноцветных шариков из пыльного мешка продолжилось, когда масс-спектрометры научились в мягких условиях фрагментировать пептиды. Внутри некоторых детекторов ионы пептидов и других соединений подвергаются специальным воздействиям, например, столкновению с незаряженными молекулами инертных газов, в результате чего эти ионы диссоциируют, образуя набор фрагментов (подробнее см. на рис. 9). После диссоциации массы фрагментов также можно измерить. Теперь, когда мы научились осуществлять тандемный анализ, или MS-MS, каждый пептид характеризуется массой иона-предшественника, который иногда называют «родительским» ионом, и набором масс ионов-фрагментов («дочерних» ионов).
Рисунок 9. Тандемная масс-спектрометрия. Схема метода — вверху. Основные типы фрагментов, которые образуются при диссоциации пептидов внутри масс-спектрометра — внизу. Поскольку пептиды имеют однотипную структуру, при подобранных условиях столкновительной диссоциации они разрушаются по определенным связям, в предсказуемой манере. Пептидная цепь может распадаться по связи между первым и вторым (альфа) атомами углерода в аминокислоте, образуя a- и x-ионы справа и слева от разорванной связи. Аналогично, при разрыве пептидной связи возникают b- и y-ионы, а при разрыве связи между атомом азота и α-атомом углерода — соответственно, с- и z-ионы.
Итак, из последовательности пептида можно предположить молекулярные массы образующихся из него при диссоциации в масс-спектрометре фрагментов основных типов. Подобно тому, как при пептидной дактилоскопии последовательность белка делится на пептиды, и массы теоретических пептидов сопоставляются с наблюдаемыми в спектре, здесь можно сопоставить теоретические фрагменты каждого виртуального пептида с наблюдаемыми пиками тандемного масс-спектра. Иначе говоря, весь кодирующий геном in silico делится на пептиды с помощью, например, трипсина, для каждого из них по известным эмпирическим правилам строится теоретический спектр фрагментации. Теперь такие теоретические масс-спектры можно сопоставить с настоящими и рассчитать каким-либо образом вероятность того, что это именно тот пептид. Единицей предсказания последовательностей из масс-спектров теперь становится пара теоретический пептид — настоящий спектр (peptide-spectrum match, PSM). Очевидно, что многие спектры, особенно в случае большого протеома (например человеческого), могут образовывать пары с несколькими теоретическими пептидами, из которых надо выбрать лучшие.
Не хотелось бы очернять чей-то бизнес, но использовать в науке дорогой инструмент, не зная, как он работает, на мой взгляд, противоречит самой идее развития научной мысли.
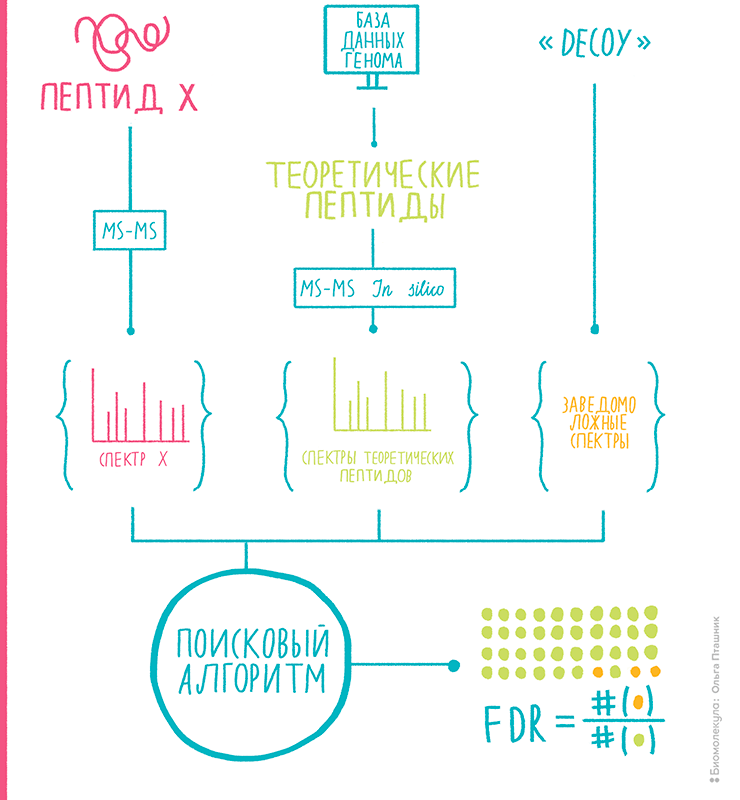
Рисунок 10. Принцип подтверждения результатов протеомного поиска target-decoy. Проверка гипотез о совпадении настоящего спектра с теоретическим приводит к образованию пар спектр—пептид (PSM). Алгоритм поиска приписывает каждому реальному спектру лучший, по его мнению, пептид. Но авторы метода схитрили — они добавили к теоретическим спектрам настоящих пептидов (target) фальшивые, заведомо неподходящие (decoy). И вот когда спектрам начинают соответствовать decoy-пептиды, это явные ошибки, то есть ложноположительные результаты. Мы ждем, когда доля PSM с этими decoy — так называемый уровень ложноположительных результатов (FDR) — достигает определенной величины (обычно, это 1%), и поиск прекращаем. Теперь мы примерно знаем, сколько ошибок у нас среди «правильных» идентификаций PSM, ведь вероятность ошибиться в сторону target равно таковой в сторону decoy.
Изобретение приемлемого MS/MS пептидов и появление способов обработки таких данных дала возможность для доставки в масс-спектрометр смесей пептидов без разделения целых белков. То есть появилась возможность расщепить все белки в образце протеазой и оперировать уже совокупностью пептидов, а не белков. Появилась протеомика-«дробовик» (shotgun proteomics), которую для благозвучия, в ущерб точности, переводят на русский язык как скорострельную или панорамную.
Ионизация электрораспылением и скорострельная протеомика
Одним из обладателей «нобелевки» 2002 года, о которой я упоминал выше, стал американский химик Джон Фенн. Ранее он предложил использовать в масс-спектрометрии метод ионизации электрораспылением, или, как его еще называют, электроспреем (electrospray ionisation, ESI). При приложении высокого напряжения к выходящей из конического капилляра жидкости она превращается в аэрозоль, а при испарении жидкости из частиц аэрозоля (например, в потоке инертного газа) электрический заряд может переходить на растворенные в этом аэрозоле биомолекулы. Так обеспечивается мягкая ионизация при атмосферном давлении, которая почти не фрагментирует высокомолекулярные соединения, в отличие от многих бытовавших ранее способов ионизации. Не лишенный британского чувства юмора Фенн в своих статьях и лекциях аллегорически сравнивал биомолекулы, которые он заставил воспарить с помощью своего метода, с летающими слонами (рис. 11).
Рисунок 11. Молекулярный слон, притаившийся в конусе для ионизации электрораспылением.
Ионизация электрораспылением оказалась необычайно удобной для совмещения двух важных методов аналитической биохимии — высокоэффективной жидкостной хроматографии и масс-спектрометрии [3]. Теперь поток хроматографической фазы с аналитической колонки можно было направить в конус для электрораспыления, или организовать такой конус на конце колонки, и применять масс-спектрометр как анализатор разделяемых в колонке молекул. Возможность осуществлять тандемную масс-спектрометрию вместе с развитием протеомного поиска с середины 2000-х сделали комбинацию методов под многоэтажной аббревиатурой HPLC-ESI-MS/MS, или просто LC-MS/MS, предпочтительным способом исследования протеома. Это и есть та самая скорострельная протеомика (рис. 12). Небольшое огорчение доставило то, что для ее осуществления, как правило, приходится расщеплять целый протеом или его фракции на трипсиновые пептиды с потерей при этом информации о целостных белках. Однако бонусов от введения этого подхода оказалось намного больше.
Рисунок 12. Схема скорострельной протеомики.
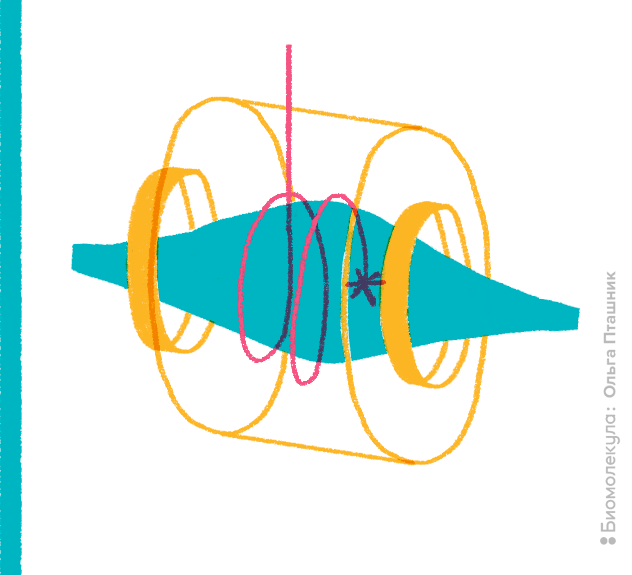
Большим подспорьем для роста информативности скорострельной протеомики оказалась «демократизация» масс-спектрометров с высоким разрешением. Ранее для особо высокого разрешения и точности определения требовалось построение приборов ионно-циклотронного резонанса с преобразованием Фурье, в которых использовали могучие сверхпроводящие магниты с индукцией магнитного поля свыше 7 Тесла. В последнее десятилетие детекторы других типов достигли сопоставимых показателей. Примерами таких приборов служат гибридные детекторы разных производителей, например, квадрупольно-времяпролетные масс-спектрометры (Q-TOF). Главенствующее положение среди доступных масс-спектрометров занимает появившаяся на рынке в 2005 году ионная ловушка особого типа — Orbitrap (рис. 13). Приятную гордость пробуждает тот факт, что создатель этой ловушки — российский физик, работающий в компании Thermo, выпускник МИФИ Александр Макаров [22].
Действие патента на Orbitrap, принадлежащего компании Thermo, в ближайшее время истечет, так что мы можем ожидать дальнейшего снижения цены на детекторы этого типа.
Рисунок 13. Ионная ловушка Orbitrap.
Точность определения молекулярной массы в запусках рутинного протеомного анализа достигла показателя 5 частей на миллион (то есть 0,0005%) и ниже. Это привело к значительному прогрессу в числе идентифицируемых таким образом белков протеома. Сегодня лучшие научные группы сообщают об идентификации методом скорострельной протеомики в клеточных линиях и тканях человека белковых продуктов 9–10 тысяч генов, то есть почти половину всего кодирующего генома [23]. Справедливо указать, что эти цифры достигаются на уровне 1% ложноположительных результатов.
Количественный анализ и изотопные метки
Просто идентифицировать белки протеомным методом в большинстве случаев явно недостаточно. Для познания механизмов биологических процессов необходимы количественные данные, обеспечивающие сравнение протеомов клеток и тканей в разных состояниях. Проще всего проанализировать некоторые показатели получившихся в ходе запусков системы LC-MS/MS хроматограмм, снабженных спектральными данными. Такой подход называется безметковым (label-free quantitation, LFQ), поскольку не требует специальных модификаций метода пробоподготовки. Например, в контрольном образце от всех пептидов некоторого белка зарегистрировано 200 спектров, а в опытном — 400. Можно предположить, что число записанных спектров пропорционально концентрации белка в образце. Для сравнения используют и другие параметры спектров, например, нормированные значения интенсивности сигнала. Безметковый количественный анализ по протеомным данным привлекателен своей простотой, и для него выработано большое количество программных решений, в том числе бесплатных программ с открытым доступом, среди которых сегодня наиболее популярен разработанный группой Матиаса Манна из Германии пакет MaxQuant. Безметковые методы неточны и полуколичественны, а находки, сделанные с их помощью, требуется проверять другим способом, например, с использованием вестерн-блоттинга [4].
Иное дело, когда один из анализируемых образцов или все они подвергаются мечению с помощью тех же стабильных изотопов, о которых уже шла речь выше. Тогда в масс-спектре пики одной и той же химической природы, но содержащие разное количество стабильных изотопов, будут стоять в спектрах рядом, разделенные расстоянием по оси m/z в зависимости от использованной метки. Мы можем сравнить интенсивность стоящих рядом пиков опыта и контроля и точно рассчитать отношение концентраций соответствующих пептидов и белков.
Стоимость набора для мечения нескольких образцов может примерно составлять средний размер гранта РФФИ (!) — для тех, кто знает.
Направленный анализ пептидов — мониторинг множественных реакций
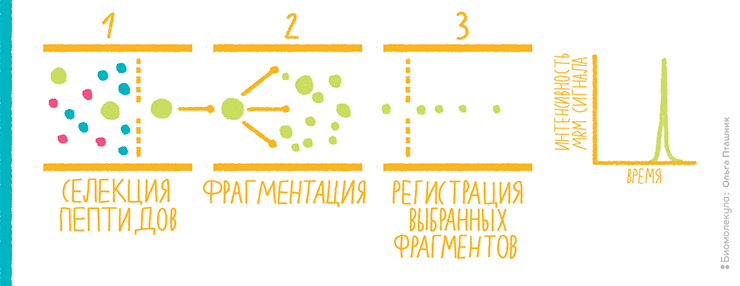
Наконец стоит упомянуть о методе протеомного анализа, который по своей функции составляет конкуренцию методам определения белков при помощи антител. Когда мы знаем, какой пептид, характеризующий целый белок, хотим измерить, можно настроить масс-спектрометр так, чтобы он видел, по сути, только этот пептид. Таким образом, работу проводят в направленном (таргетном) режиме. Для этого используют прибор с детектором типа тройного квадруполя. По сути, это три одинаковых масс-спектрометра, стоящих друг за другом и передающих друг другу ионы. В первом отфильтровывается нужный ион-предшественник, то есть интересующий нас пептид, во втором — куда попал только наш «товар» — он проходит фрагментацию, а третий регистрирует 3–5 выбранных нами заранее фрагментов. По интенсивности фрагментов осуществляется количественный анализ.
Подход известен из анализа низкомолекулярных соединений и начал широко использоваться для пептидов в середине 2000-х под названием «мониторинг множественных реакций» (multiple reaction monitoring, MRM), или «мониторинг выбранных реакций» (selected reaction monitoring, SRM) (рис. 14) [24]. Такой метод не подходит для обнаружения новых явлений в протеоме, но зато обеспечивает надежный количественный анализ, особенно с использованием синтетических изотопно меченных стандартов для интересующих пептидов. MRM позволяет осуществлять анализ нескольких пептидов за один запуск LC-MS/MS. Он позиционируется как «масс-спектрометрический иммунный анализ» и в настоящее время ищет свое место не только в науке, но и в клинической и биотехнологической практике.
Рисунок 14. Мониторинг множественных реакций в приборе типа тройного квадруполя.
Протеомика с помощью антител и других связующих молекул
С совершенствованием точного нанесения жидкости на подложку, иными словами, печати микрочипов различных типов, иммунные тесты на белки смогли стать миниатюрными. Одновременно с чипами для гибридизации нуклеиновых кислот возникло множество технических решений размещения на твердых подложках сотен и более антител к различным белкам. Такое умножение известных иммунных тестов в сочетании с различными остроумными методами визуализации связывания белка-мишени перевело известный до этого анализ в режим протеомного. Детектирование белков в множественном режиме с помощью специфичных связывающих молекул (например, антител и их фрагментов) к настоящему моменту приобрело столь разнообразные формы, что для их описания, наверное, требуется создать отдельный материал. Я не специалист в области белковых микрочипов, поэтому предоставлю сделать это кому-нибудь еще.
Следует упомянуть несколько технических решений в этой области. В нашей стране группа под руководством А.Д. Мирзабекова около 20 лет назад создала микрочипы на основе гидрогеля, в том числе для анализа белков [25], причем эта технология до сих пор развивается в Институте молекулярной биологии РАН. Альтернативой антителам для мультиплексного анализа белков служат аптамеры — связующие олигонуклеотиды. На основе химически модифицированных аптамеров американская компания Somalogic создала микрочипы для анализа более тысячи белков человека. Такие чипы всё чаще используют для поиска биомаркеров, как альтернатива масс-спектрометрической протеомике.
Если говорить об антителах для анализа белков в масштабе целого генома, то нельзя не упомянуть мощный по объему шведский проект под руководством Матиаса Улена — «Атлас белков человека». В ходе этого проекта к большинству человеческих белков получили антипептидные поликлональные антитела, которыми затем покрасили большое количество тканей и клеток. Ценой существенных усилий создали большую базу данных, содержащую диаграммы и изображения, иллюстрирующие синтез большинства белков генома в различных органах и тканях [26].
Протеомный скрининг со скоростью света!
Интересные решения для скрининга белков предлагает компания ForteBio (Pall).
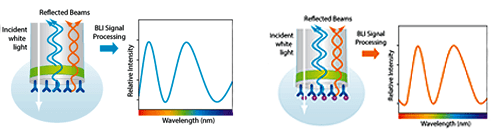
Ранее мы уже упоминали технологию интерферометрии слоя биомолекул (bio-layer interferometry, BLI) в статье, посвященной иммунологическим методам [4].
Суть технологии — в использовании специального биосенсора, который представляет собой светопроводящую иглу с концом, покрытым биосовместимым матриксом.
На матриксе иммобилизованы структуры, способные специфически связываться с анализируемыми биомолекулами по принципу лиганд—рецептор.
При взаимодействии анализируемых молекул с биосенсором происходит изменение преломления светового пучка внутри биосенсора, которое регистрируется прибором и отображается на мониторе компьютера в виде кривых ассоциации—диссоциации.
Преимущества систем Octet в том, что в отличие от систем Blitz они имеют многоканальные модули. Это позволяет проводить исследования в формате 96- и 384-луночных планшетов и применять системы для скрининга белков в биологических жидкостях без выделения самих белков.
Измерение происходит в режиме реального времени, при этом образцы остаются интактными и могут использоваться для дальнейшей работы.
Данную технологию уже сейчас широко используют фармацевтические компании для скрининга при разработке вакцин, моноклональных антител и при изучении специфического взаимодействия молекул лекарственного препарата с рецепторами в организме.
Видео. Аналитические системы Octet
Материал предоставлен партнёром — компанией «Диаэм»
Протеомика и практическая медицина
Из всего сказанного выше понятно, что как технология идентификации белков протеомика за пару десятилетий впечатляюще продвинулась. Однако запросы общества в молекулярной биологии связаны с появлением какой-то полезной продукции. Что же произошло на этом поле? Ранние работы по прямому анализу компонентов крови для диагностики заболеваний, в особенности, злокачественных опухолей, не привели к впечатляющим результатам. Однако, судя по последним открытиям в биологии рака, под сомнением оказалась сама возможность эффективного использования биохимических маркеров для его первичной, ранней диагностики. Но это, в общем, другая история. Выше я упоминал об успехе масс-спектрометрии MALDI-TOF для распознавания бактериальных клеток по профилю анализа их целыми, без предварительной обработки. Несколько альтернативных решений для идентификации патогенных бактерий в этой сфере сегодня используют в клинике (рис. 15).
Рисунок 15. Бактериальные клетки, освещенные лучами лазера и покрытые «шубой» из кристаллов фоточувствительной матрицы, распознаются по масс-спектру различных белков в их составе.
Что касается диагностики опухолей, то протеомика ищет себя в обнаружении биомаркеров для прогностических тестов. Имеется в виду ситуация, когда опухоль уже обнаружена, и требуется определить степень ее злокачественности для того, чтобы правильно выбрать стратегию лечения. Так, ранние попытки анализа MALDI-TOF компонентов крови без их обработки внесли свой вклад в появление разрешенного американскими регуляторами мультиплексного теста OVA1 для прогноза злокачественности опухоли яичника. По справедливости отметим, что сам тест осуществляется уже не с помощью масс-спектрометрии, а иммунными методами. В Северной Америке также разрешен тест Xpresys Lung, который уже использует в своей работе таргетную масс-спектрометрию нескольких белков плазмы крови. Этот тест малоинвазивным путем оценивает степень злокачественности найденных методами визуализации узелков в легких.
Здесь я не ставлю цель оценить, насколько широко используются эти вспомогательные тесты, успешны ли они коммерчески. Обращают на себя внимание факты доведения протеомных экспериментов до продуктов медицинского назначения.
И конечно, не нужно забывать тот вклад в биологию и медицину, который внесли протеомные методы, использованные в многочисленных фундаментальных исследованиях. Настороженность, связанная с недоверием к новой технологии, давно осталась в прошлом, и масс-спектрометрия белков или белковые микрочипы давно стали завсегдатаями страниц самых цитируемых научных журналов. Конечно, методы сами по себе, как бы они ни были хороши, не могут заменить научную мысль. Но когда биологи, способные ее сгенерировать, сочли протеомные методы достаточно надежными, последние начали приносить очевидную пользу в решении сложных фундаментальных задач [27–29].
Что дальше?
В конце полагается очертить перспективы того направления, о котором пишешь. Сивилла из меня не очень — что будет дальше, на самом деле, я не знаю. Но скажу. Все омиксы ждет демократизация — техника станет работать еще лучше, а стоимость анализа будет снижаться [12]. Конечно, с масс-спектрометрией дело не дойдет до решений, похожих на секвенатор нуклеиновых кислот на основе нанопоры, который уже стоит совсем небольших денег. Все-таки там требуется вакуум, который создают насосом. Ну и прочая электроника.
Пробы будут подвергаться сразу нескольким видам омиксного анализа. Даже сегодня в некоторых областях, например при молекулярной характеристике опухолей, образцы стремятся обследовать всесторонне [30], в режиме так называемой протеогеномики. Это нужно для улучшенной классификации образцов, которая может обеспечить более эффективное управление заболеванием.
Снятие молекулярных показателей с гомогенизированных тканей, содержащих миллионы или, как минимум, тысячи клеток, напоминает оценку средней температуры по больнице. Если среди тысяч клеток десятки содержат уникальные белки, важные мишени для лекарств, биомаркеры или другой функционал, при таком анализе сигнал от них просто потеряется. Поэтому должна развиваться протеомика единичных клеток. Надо отметить, что ей гораздо сложнее это сделать, чем, например, транскриптомике, поскольку сигнал от белков нельзя амплифицировать, как нуклеиновые кислоты в полимеразных цепных реакциях.
Что ещё важно: уже сейчас данные, которые получает масс-спектрометр, очень велики — это, похоже, Big Data. И они явно недостаточно интерпретированы. Тенденция ближайшего времени — повышение информационного содержания протеомных данных. В немного переосмысленном виде будет действовать пословица: «Двое с сошкой (люди, проводящие эксперименты и получающие данные), семеро с ложкой (компьютерщики, которые эти данные обрабатывают)». А первых двоих лучше вообще убрать, пусть за них работают роботы. Айтишники будут лежать на пляже с ноутбуками (они это любят) и посылать мне обработанные данные, а я — сидеть на завалинке где-нибудь в русской деревне (это уже люблю я) и писать о протеомах.
И последнее. Исследователи — народ строгий. Потому ожидаю некоторые критические замечания к этому тексту, который ни в коем случае не всеобъемлющ. Возможно, в статье также притаились фактические и технические ошибки. Прошу всех высказывать свое мнение в комментариях и лично, мы открыты к сотрудничеству и обязательно поправим текст в случае обоснованной критики.
Календарь
На основе статей спецпроекта мы решили сделать календарь «12 методов биологии» на 2019 год. Эта статья представляет июнь.