Проаритмогенное действие что это
Проаритмогенное действие что это
Антиаритмические средства, обладающие ограниченной эффективностью при лечении автоматических аритмий и каналопатий, по крайней мере, теоретически, прямо воздействуют на механизм, ответственный за реципрокные аритмии.
Функционирование петли риентри требует некоторых обязательных условий, а именно непременного наличия анатомического или функционального круга, одна часть которого должна проводить медленно, а вторая — иметь удлиненный рефрактерный период (для возникновения однонаправленной блокады). Сразу же можно понять возможную эффективность препаратов, которые путем изменения формы сердечного потенциала действия влияют на проводимость и рефрактерность тканей, формирующих петлю риентри.
Рисунок иллюстрирует, что может произойти при воздействии лекарственных средств на петлю риентри. Препарат, который увеличивает продолжительность сердечного потенциала действия (а значит, и рефрактерного периода), еще больше расширяет и без того длительный рефрактерный период одного из путей и таким образом может превращать однонаправленную блокаду в двунаправленную. Наоборот, препарат, имеющий противоположный эффект на рефрактерные периоды, то есть уменьшающий длительность потенциала действия и рефрактерных периодов, способен укорачивать рефрактерный период одного из путей, так что рефрактерные периоды обоих путей становятся относительно эквивалентными. При отсутствии разницы рефрактерных периодов двух путей невозможно инициировать риентри.
Ключевым моментом в понимании действия антиаритмических препаратов на реципрокные аритмии является тот факт, что риентри требует критических соотношений рефрактерных периодов и скоростей проведения двух частей петли. Обладая способностью изменять рефрактерные периоды и скорости проведения, антиаритмические средства уменьшают вероятность развития реципрокных аритмий.
Проаритмическое действие
Способ, которым действуют антиаритмические препараты, подавляя реципрокные аритмии, имеет очевидное отрицательное следствие. Например, у пациента с предшествующим инфарктом миокарда и асимптомной неустойчивой желудочковой тахикардией имеется скрытая петля риентри, электрофизиологические свойства которой были недостаточны для развития реципрокной аритмии. Для подавления асимптомной аритмии пациенту можно назначить препарат класса IIВ (т. е. препарат, уменьшающий продолжительность потенциала действия).
Этот препарат, возможно, устранит эктопию, но он также способен уменьшить рефрактерный период одного из путей (с более продолжительным рефрактерным периодом) и привести к появлению у петли риентри характеристик, представленных на рисунке. Другими словами, препарат обладает свойством увеличивать вероятность возникновения реципрокной аритмии.
Всякий раз, прописывая антиаритмический препарат пациенту с потенциальной петлей риентри, необходимо учитывать, что он может изменить электрофизиологические характеристики петли таким образом, что риск развития устойчивой аритмии станет больше или меньше. Возможны оба варианта — в некоторых случаях даже с одинаковой вероятностью. К сожалению, тот же самый механизм, который продуцирует антиаритмический эффект, оказывает и проаритмическое действие, так что проаритмия — это отнюдь не необычный, идиосинкразический или редкий побочный эффект антиаритмических препаратов. Проаритмия — это предсказуемое и неотъемлемое свойство антиаритмических средств.
Улучшит ли антиаритмический препарат течение аритмии или ухудшит, трудно предсказать до начала лечения. Вот почему при назначении этих средств не следует забывать о проаритмии.
Проаритмогенное действие пропафенона у больных с трепетанием предсердий.
Национальный научный центр «Институт кардиологии им. акад. Н.Д. Стражеско» АМН Украины, г. Киев.
Трепетание предсердий (ТП) занимает второе место среди тахиаритмий по распространенности после фибрилляции предсердий (ФП) с частотой выявления до 15–20 % всех наджелудочковых нарушений ритма и характеризуется правильным ритмом с частотой сокращений предсердий (ЧСП) 250–350 в 1 мин (170–240 мc). Для восстановления синусового ритма при ТП применяют антиаритмические препараты (ААП), электроимпульсную терапию, электрокардиостимуляцию и катетерную абляцию [11]. Оптимальным и наиболее эффективным методом восстановления синусового ритма является чреспищеводная электрокардиостимуляция (ЧПЭКС), эффективность которой достигает 75–98 %. Электрическую стимуляцию предсердий осуществляют с частотой, превышающей ЧСП, с целью проникновения импульса в круг macrorееntry и создания условий для его прерывания [2, 4, 9].
В основе патофизиологии ТП лежит правильная предсердная цепь циркуляции возбуждения. Эта цепь включает в себя электрический импульс возбуждения и готовый к проведению участок миокарда предсердия. ААП IА класса уменьшают скорость проведения в цепи re-entry и в целом сокращают период возбудимости. ААП IС класса замедляют проведение импульса и, тем самым, уменьшают ЧСП. И напротив, ААП III класса (амиодарон) увеличивают период рефрактерности и могут купировать ТП, так как импульс наталкивается на рефрактерную ткань. Электрическая стимуляция предсердий может купировать ТП при создании функционального блока в одном из направлений круга re-entry. Кроме того, эффективность стимуляции может быть увеличена антиаритмической терапией (ААТ), которая облегчает создание зоны абсолютной рефрактерности [4, 6, 16].
Известно, что помимо антиаритмического, практически все ААП имеют проаритмогенный эффект [5]. Проаритмией называют утяжеление течения или учащение ранее имевшихся аритмий, или появление новых (собственно проаритмогенный эффект) в результате назначения ААП. В большинстве случаев проаритмогенный эффект является дозозависимым. Он наблюдается примерно в 13 % случаев назначения ААП.
Практически все ААП при определенных обстоятельствах могут оказывать проаритмогенный эффект, появлению которого способствует:
Механизмы проаритмогенного действия ААП и его электрофизиологические основы до сих пор достаточно не изучены. Однако, знание механизмов антиаритмического действия препаратов позволяет понять и прогнозировать конкретный проаритмогенный эффект конкретных препаратов. Например, препараты IА класса, замедляя проводимость по проводящей системе сердца и миокарду предсердий, могут способствовать возникновению re-entry. Бета-адреноблокаторы, предотвращая ускорение проводимости по миокарду под действием катехоламинов, могут увеличивать различия в скорости проведения по различным участкам миокарда и также способствовать возникновению петель re-entry.
Антиаритмический эффект в тканях с коротким рефрактерным периодом достигается за счет уменьшения дисперсии рефрактерных периодов и окна возбудимости. Блокаторы натриевых каналов, кроме уменьшения дисперсии рефрактерных периодов, могут также замедлять проведение, увеличивать частоту эпизодов желудочковой тахикардии (ЖТ), замедлять волны ТП с проведением на желудочки 1:1 и увеличивать частоту внезапной смерти, особенно у пациентов с ишемической болезнью сердца. Препараты, удлиняющие потенциал действия, увеличивают частоту веретенообразных желудочковых тахикардий (torsades de pointes), особенно на фоне брадиаритмии и гипокалиемии.
Проаритмогенный эффект может быть обусловлен также усилением нормального или аномального автоматизма или образованием ранних (хинидин) или поздних (сердечные гликозиды) постпотенциалов. Удлинение реполяризации и продолжительности эффективного рефрактерного периода под действием ААП увеличивает блокаду распространения преждевременного импульса, который может появляться во время фазы 3 реполяризации, распространяясь медленно и аномально. Препараты IА класса оказывают ваголитическое действие и поэтому могут вызывать парадоксальное увеличение частоты сокращений сердца (ЧСС), вплоть до развития фибрилляции желудочков (ФЖ). Другими словами, можно сказать, что практически любой ААП при определенных условиях может давать проаритмогенный эффект [5, 6].
Чаще всего проаритмогенный эффект ААП имеет место у больных с тяжелыми нарушениями ритма на фоне ишемической болезни сердца, осложненной недостаточностью кровообращения, то есть у больных с гипоксически-дистрофическими изменениями в миокарде, приводящими к его электрической нестабильности. При таких обстоятельствах ААП, как правило, способствуют развитию неравномерности реполяризации и усилению дисперсии рефрактерностей миокарда. Другими часто встречающимися факторами, обусловливающими проаритмическое действие ААП, являются катехоламины, индуцирующие триггерную активность (как, например, при терапии сердечными гликозидами, прокаинамидом). Еще один нередкий аритмогенный механизм связан с вызываемыми некоторыми препаратами ваголитическими реакциями. Классическим препаратом такого типа является дизопирамид.
Для оценки проаритмогенного эффекта необходимо использование методов электрокардиографии, холтеровского и телеметрического мониторирования ЭКГ, электрофизиологического исследования (ЭФИ), нагрузочных проб. При использовании ААП (особенно I класса) у тяжелых больных следует обязательно мониторировать ритм сердца в течение всего периода применения ААП.
Клиническими предикторами возможного проаритмического эффекта любых применяемых ААП могут быть:
Своевременно проведенные ЭФИ позволяют раньше всего выявить проаритмическое действие ААП. В качестве критериев наличия аритмогенного эффекта могут использоваться следующие:
В 70–80-е годы разработка ААП в основном была нацелена на лечение желудочковых аритмий как маркеров внезапной смерти. Проведенное в 1989 г. исследование CAST (Cardiac Arrhythmia Suppression Trial) изменило эти установки. В последнее десятилетие основные усилия были направлены на поиск препаратов для лечения ФП и ТП.
Типы проаритмий при лечении ФП или ТП различными ААП по классификации Е.М. Vaughan Williams [10]:
1. Желудочковые проаритмии:
2. Предсердные проаритмии:
3. Нарушения проведения или формирования импульса:
Проаритмогенные эффекты ААП IС класса
Для ААП I класса основной мишенью действия являются натриевые каналы. Молекулы ААП проникают в их просвет со стороны внутренней поверхности мембраны и фиксируются на рецепторах. Это приводит к замедлению распространения возбуждения по проводящей системе сердца и миокарду. В терапевтических концентрациях ААП I класса нередко вызывают увеличение продолжительности комплекса QRS и интервала PR. В первую очередь, это касается ААП IС класса — мощных блокаторов натриевых каналов. Меньшее влияние на комплекс QRS имеют ААП IА класса и весьма слабое – ААП IВ класса. На продолжительность интервала PR влияние ААП двух последних групп практически вовсе не выражено: у ААП IA класса – из-за антихолинергических (атропиноподобных) свойств этих препаратов, а у ААП IB класса – из-за слабого влияния на проводимость в предсердиях и атриовентрикулярном узле [6].
Редкое развитие ЖТ по типу torsades de pointes при применении препаратов IВ класса связывают с тем, что они не вызывают блокады выходящего калиевого тока, а ААП IС класса блокируют только задержанный калиевый ток. Пропафенон замедляет скорость проведения в миокарде предсердий и желудочков с небольшим увеличением времени реполяризации, поэтому он и относится к IС классу. Однако у некоторых пациентов он может вызывать неселективную блокаду калиевых каналов, увеличивая длительность реполяризации и интервала QT. У некоторых пациентов фоновый натриевый ток и выходящий калиевый ток могут иметь различную чувствительность к пропафенону, в результате иногда наблюдается увеличение интервала QT и развитие ЖТ по типу torsades de pointes. Кроме того, необходимо помнить, что лечение ФП препаратами IС класса в 3,5–5 % случаев может индуцировать ТП с проведением 1:1.
Пропафенон является эффективным ААП у больных с ФП, позволяющим восстанавливать синусовый ритм как при внутривенном, так и при приеме внутрь. Фармакокинетика позволяет назначать его внутрь в виде нагрузочной дозы. В 90-е годы прошлого века были выполнены несколько рандомизированных исследований, в которых продемонстрирована его высокая эффективность у больных с недавно возникшим пароксизмом ФП–ТП при его назначении в нагрузочной дозе внутрь [1, 3, 7, 8, 15].
По данным некоторых исследований, частота различных проаритмогенных побочных эффектов после приема пропафенона не выше, чем после приема плацебо. В одном исследовании ТП или другая тахикардия длительностью не менее 1 мин наблюдалась у 7 % больных, леченных пропафеноном, и у 6 % больных, получающих плацебо. В другом исследовании ТП с атриовентрикулярным проведением 1:1 и ЧСЖ более 150 в 1 мин с одинаковой частотой встречалась в группах больных, получавших пропафенон и плацебо (14 %) [10].
При ТП наиболее эффективным методом восстановления синусового ритма является ЧПЭКС [2, 9]. По данным ряда работ, отмечено повышение эффективности ЧПЭКС при восстановлении синусового ритма у больных с пароксизмами ТП на фоне предварительного применения ААП IС класса – пропафенона [12–14].
В связи с этим представляет интерес случай дозозависимого проаритмогенного действия ААП IС класса – пропафенона при восстановлении синусового ритма у больной с длительным пароксизмом ТП I типа.
Больная Б., 53 года, обратилась в поликлинику института с диагнозом: Гипертоническая болезнь II стадии. Миокардиофиброз. Персистирующая форма ТП. СН I стадии.
Повышение артериального давления (АД) в течение многих лет, не обследовалась, не лечилась. Пароксизм ТП возник впервые, продолжительностью 40 дней. Из анамнеза известно, что у больной диффузный зоб ІІ степени, клинический эутиреоз.
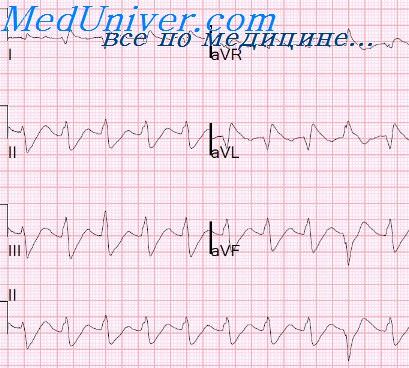
Объективно: Гиперстенического телосложения, повышенного питания. В легких дыхание везикулярное. АД 140/90 мм рт. ст. Деятельность сердца ритмичная, тоны глухие. Периферических отеков нет. ЭКГ: ТП со средней ЧСЖ 120 в 1 мин, ЧСП 240 мс и коэффициентом проведения на желудочки 2:1. Полная блокада правой ножки пучка Гиса (ПБПНПГ).
Структурно-функциональное состояние миокарда оценивали на эхокардиографе Sonoline-Omnia (Siemens, Германия) с частотой датчика 2,5 МГц. В двухмерном и М-режиме определяли линейные и объемные характеристики левого (ЛП) и правого (ПП) предсердий и левого (ЛЖ) и правого (ПЖ) желудочков. Протокол эхокардиографии: размер ЛП (М-режим) – 41 мм; S ЛП (диастола) – 22,8 см2; S ЛП (систола) – 26,9 см2; V ЛП (диастола) – 73 мл; V ЛП (систола) – 99 мл; ФВ ЛП (по Simpson) – 26 %; конечносистолический размер ЛЖ – 38 мм; конечнодиастолический размер (КДР) ЛЖ – 49 мм; конечносистолический объем ЛЖ – 57 мл, конечнодиастолический объем ЛЖ – 111 мл, ФВ ЛЖ – 48 %, толщина межжелудочковой перегородки ЛЖ – 11,5 мм, толщина задней стенки ЛЖ – 10 мм, КДР ПЖ (М-режим) – 29 мм, S ПП (диастола) – 20,6 см2, S ПП (систола) – 23,6 см2, V ПП (диастола) – 61 мл, V ПП (систола) (по Simpson) – 74 мл, ФВ ПП – 18 %, индекс массы миокарда ЛЖ – 90,1 г/м2.
Больной также выполнена чреспищеводная эхокардиография: тромбов не выявлено. После проведенного обследования назначен пропафенон в дозе 450 мг/сут. После подбора целевой дозы антикоагулянта (фенилин) больной амбулаторно проведена лечебная ЧПЭКС.
На ЭКГ (19.05.2009) перед стимуляцией: ТП со средней ЧСЖ 115 в 1 мин, ЧСП 270 мс и коэффициентом проведения на желудочки 2:1, 3:1, QRS – 200 мс, ПБПНПГ.
ЧПЭКС осуществляли с помощью временного электрокардиостимулятора Сordelectro-05 (Литва), диагностическим электродом «ПЭДМ-6» (Украина); регистрацию ЭКГ проводили на электрокардиографе Mingograf-82 (Siemens-Elema, Швеция). Стимуляцию начинали с частоты, на 25–35 % превышающей частоту ТП, и в последующем ее увеличивали до перевода в стойкую ФП. Начальные параметры стимуляции: сила тока – 1,5 мА, продолжительность импульса – 10 мс, продолжительность стимуляции – 2–3 с, межполюсные интервалы – 10 мм.
После проведения протокола ЧПЭКС (сила тока – 2 мА, количество залпов стимуляции – 25) ТП переведено в стойкую ФП. Через 20 мин внутривенно струйно введено 1000 мг прокаинамида. На ЭКГ отмечается уширение комплекса QRS, но синусовый ритм не восстановился. Рекомендовано продолжить прием пропафенона, но в дозе 900 мг/сут, с целью возможной медикаментозной кардиоверсии.
В течение суток произошла обратная трансформация ФП в ТП, но больной рекомендовано продолжить прием препарата. На фоне проводимого лечения состояние пациентки ухудшилось – усилилась одышка. ЭКГ (22.05.2009): ТП со средней ЧСЖ 110 в 1 мин, ЧСП 290 мс и коэффициентом проведения на желудочки 1:1, 2:1, 3:1, QRS – 240 мс, ПБПНПГ.
Выполнена повторная ЧПЭКС. Протокол стимуляции: отмечается ухудшение навязывания ритма на предсердия: неоднократно повышали частоту и продолжительность стимуляции (до 10 с), увеличивали амплитуду импульса и межполюсное расстояние до 20 мм, а также изменяли локализацию электрода. Выполнено более 80 залпов стимуляции с постепенно увеличивающейся частотой, и только при силе тока 5 мА удалось перевести ТП в ФП. Больная продолжила прием пропафенона в той же дозе. На следующие сутки на ЭКГ отмечается графика ТП с увеличением периодов коэффициента проведения на желудочки 1:1.
Учитывая неэффективность повторных стимуляций на фоне пропафенона в дозе 450 и 900 мг/сут; появление его проаритмогенного эффекта: повышение порога возбудимости миокарда, улучшение атриовентрикулярного проведения с появлением периодов 1:1; необходимость применения более агрессивного протокола стимуляции, а также клинического ухудшения течения аритмии, ААП был отменен.
На третьи сутки больной выполнена электрокардиостимуляция без ААТ. ЭКГ (26.05.2009): ТП со средней ЧСЖ 120 в 1 мин, ЧСП 240 мс и коэффициентом проведения на желудочки 2:1, QRS – 180 мс, ПБПНПГ. АД 120/100 мм рт. ст. После пяти залпов стимуляции с амплитудой тока 1,5 мА ТП переведено в ФП. Через 15 мин у больной восстановился синусовый ритм с частотой 60 сокращений в 1 мин.
После успешной кардиоверсии ААТ не проводили. Через неделю у больной сохраняется синусовый ритм – 65 сокращений в 1 мин, на ЭКГ – ПБПНПГ. Выполнено холтеровское мониторирование ЭКГ: средняя ЧСС за сутки – 65 в 1 мин (мин. – 43, макс. – 98); наджелудочковая экстрасистолия – 189, желудочковая – 6; пароксизмальных нарушений ритма не выявлено. После проведенного суточного мониторирования АД больной назначено антигипертензивное лечение (кандесартан 16 мг/сут).
За период наблюдения в течение 6 мес рецидивов аритмии не зафиксировано. Таким образом, нами выполнено успешное восстановление ритма у больной с длительным (более 45 сут) пароксизмом ТП без антиаритмической подготовки.
Представленный клинический случай показал дозозависимое проаритмогенное действие пропафенона, которое проявлялось повышением порога возбудимости миокарда предсердий и, тем самым, затруднением возможности попадания электрического импульса в уязвимое окно петли re-entry, а также улучшения атриовентрикулярного проведения с появлением периодов проведения на желудочки 1:1, необходимостью применения более агрессивного протокола стимуляции: увеличение количества залпов и продолжительности стимуляции; применение большей силы тока стимулирующих импульсов, необходимой для навязывания искусственного ритма на предсердия; увеличение межэлектродного расстояния стимулирующего электрода до 20 мм. Кроме того, следует отметить, что обратная трансформация ФП в ТП на фоне приема пропафенона также обусловлена проаритмогенным действием ААП, с формированием устойчивости круга re-entry.
На представленных ЭКГ пациентки не отмечается существенной динамики, кроме появления периодов атриовентрикулярного проведения 1:1 на фоне приема пропафенона в дозе 900 мг/сут. Увеличение продолжительности комплекса QRS связано с непосредственным электрофизиологическим действием препарата.
Таким образом, интерес данного клинического случая представляется в том, что, несмотря на общепринятое мнение о повышении эффективности восстановления ритма на фоне предварительной антиаритмической подготовки, существуют случаи, когда ААТ оказывает проаритмогенные эффекты, которые невозможно прогнозировать по поверхностной ЭКГ и которые проявляются только при восстановлении ритма.
По данным некоторых работ, возможно восстановление ритма у больных с длительными пароксизмами ТП без предварительной ААТ [2]. В лаборатории ЭФИ отдела аритмий сердца ННЦ «Институт кардиологии им. акад. Н.Д. Стражеско» в течение многих лет амбулаторно выполняются ЧПЭКС при ТП, больным без тяжелой кардиальной патологии, выраженной СН и редкими (реже одного эпизода в 3 мес) пароксизмами, без предварительной антиаритмической подготовки. Продолжительность пароксизма в этих случаях не влияет на тактику восстановления ритма. Необходимо отметить, что больным с пароксизмами ТП более 7 сут проводят чреспищеводную эхокардиографию для исключения тромбов и предикторов тромбообразования в полостях предсердий и ушке ЛП, а также выявления экстракардиальных факторов тромбообразования. Перед восстановлением ритма всем больным проводят лечение основного заболевания, коррекцию АД и компенсацию СН.
Следовательно, врачи, выполняющие электрокардиостимуляции у больных с ТП, должны помнить, что случаи неэффективного навязывания искусственного ритма на предсердия и устойчивость круга re-entry могут быть обусловлены не только анатомическими, структурно-функциональными и электрофизиологическими механизмами, но и проаритмогенным действием ААП.
Антиаритмические препараты
Основным способом лечения аритмий является применение антиаритмических препаратов (ААП). Хотя они не «излечивают» от аритмии, но способны уменьшать или подавлять аритмическую активность и предотвращать рецидивирование аритмий. Классификация ААП. Наиб
Основным способом лечения аритмий является применение антиаритмических препаратов (ААП). Хотя они не «излечивают» от аритмии, но способны уменьшать или подавлять аритмическую активность и предотвращать рецидивирование аритмий.
Классификация ААП. Наиболее широко известна классификация ААП, предложенная E. M. Vaughan Williams (1969; 1984) и дополненная D. Harrison (1979):
I класс — блокаторы натриевых каналов;
II класс — блокаторы β-адренергических рецепторов;
III класс — препараты, увеличивающие продолжительность потенциала действия и рефрактерность миокарда (блокаторы калиевых каналов);
IV класс — блокаторы кальциевых каналов.
Подавляющее большинство ААП относится к I классу. По предложению D. Harrison (1979), препараты I класса были дополнительно разделены на три подкласса: IА, IВ и IС (табл. 1).
Все препараты I класса замедляют скорость деполяризации и скорость проведения в миокарде предсердий и желудочков. Наиболее отчетливо это действие выражено у ААП класса IС. Препараты класса IВ оказывают минимальное влияние на скорость деполяризации, а ААП класса IА занимают промежуточное положение. При этом ААП класса IА замедляют реполяризацию — увеличивают продолжительность потенциала действия и эффективный рефрактерный период, препараты класса IВ могут слегка ускорить реполяризацию, а ААП класса IС почти не оказывают влияния на процесс реполяризации миокарда (хотя удлиняют эффективный рефрактерный период предсердий при высокой частоте сокращений предсердий, например при мерцательной аритмии). Таким образом, действие препаратов I класса различают по скорости:
IА — умеренное замедление скорости деполяризации и реполяризации;
IВ — минимальное замедление скорости деполяризации и ускорение реполяризации;
IС — максимальное замедление скорости деполяризации и минимальное влияние на реполяризацию.
На электрокардиограмме (ЭКГ) замедление скорости деполяризации проявляется в виде расширения зубца Р и комплекса QRS. Замедление реполяризации желудочков на ЭКГ проявляется в виде удлинения интервала QT.
Классификация ААП E. M. Vaughan Williams даже в современной модификации имеет существенные недостатки. Действие ААП в условиях целого организма нередко заметно отличается от воздействия на клетки миокарда, выявленного экспериментально: различные патологические состояния значительно изменяют электрофизиологические свойства миокарда и характер влияния ААП, многие препараты проявляют свойства нескольких или даже одновременно всех классов. Поэтому предпринимались неоднократные попытки дополнения и пересмотра классификации ААП, создания новых классификаций на основе теоретических разработок, данных экспериментальных и клинических исследований, практического опыта лечения аритмий.
Одной из попыток создания более совершенной классификации АAП является так называемый «Сицилианский гамбит». Ведущие специалисты по аритмиям собрались в Сицилии и предприняли попытку связать воедино данные теоретических, экспериментальных и клинических исследований, весь спектр знаний о механизмах возникновения аритмий и действии АAП. Свой доклад они назвали «Сицилианский гамбит» (Сицилия, 1990), по аналогии с «Королевским гамбитом» в шахматах, использование которого предоставляет шахматисту «широкий выбор агрессивных действий». Это был действительно «мозговой штурм» проблемы лечения нарушений ритма. Данный доклад представляет собой прекрасный систематизированный обзор современных представлений об электрофизиологии сердца, механизмах возникновения аритмий и действии АAП.
В «Сицилианском гамбите» суммированы и систематизированы все собранные к настоящему времени сведения о действии ААП (в том числе на клеточном и субклеточном уровнях). Каждый ААП имеет свое собственное место — с учетом всех особенностей его действия.
Однако практического значения «Сицилианский гамбит» не имеет, так как авторы «Сицилианского гамбита» только систематизировали термины и определения в уже известных схемах лечебных мероприятий. При попытках использования положений «Сицилианского гамбита» в практической работе создается иллюзия определенности там, где ее нет. Новый подход направлен на повышение эффективности дальнейших научных исследований по проблеме нарушений ритма сердца и может способствовать пониманию различных аспектов проблемы медикаментозного лечения аритмий, а также облегчит преподавание материалов по аритмиям студентам или врачам, которые хотят стать аритмологами. Известный аритмолог R. N. Fogoros (1997) так определил роль «Сицилианского гамбита»: «Нельзя сказать, что ‘‘Сицилианский гамбит’’ непригоден для практики. Когда механизмы аритмий будут определены более четко, знание конкретных свойств определенных препаратов может помочь в прогнозировании эффективности фармакологической терапии (что и ставили своей целью авторы ‘‘Сицилианского гамбита’’). К тому же такая табличная система определенно полезна для проведения исследований. Система Vaughan Williams (со всеми своими ограничениями) все же остается наиболее полезным средством классификации антиаритмических препаратов».
Нежелательные эффекты ААП. Любое действие ААП может вызывать как антиаритмический, так и аритмогенный эффекты. Вероятность проявления антиаритмического эффекта для большинства препаратов составляет в среднем 40–60%. Исключением является амиодарон, эффективность которого достигает 70–80%, даже при отсутствии эффекта от других ААП. Вероятность аритмогенного эффекта в среднем составляет около 10%, а у препаратов класса IС достигает 20% и более. При этом аритмогенный эффект может проявляться в виде возникновения опасных для жизни аритмий. При тяжелых желудочковых аритмиях у пациентов с выраженным органическим поражением сердца вероятность аритмогенного действия может превышать вероятность антиаритмического эффекта.
В нескольких крупных клинических исследованиях было выявлено заметное повышение общей смертности и частоты случаев внезапной смерти (в 2–3 раза и более) больных с органическим поражением сердца (постинфарктный кардиосклероз, гипертрофия или дилатация сердца) на фоне приема ААП I класса, несмотря на эффективное устранение аритмий. Наиболее известной работой, в ходе которой впервые было выявлено полное несоответствие клинической эффективности препаратов и их влияния на прогноз, является исследование Cardiac Arrhythmia Suppression Trial (CAST). Изучалось действие трех ААП: флекаинида, энкаинида и морицизина (этмозин). При промежуточном анализе обнаружилось резкое увеличение общей смертности и частоты внезапной смерти (соответственно в 2,5 и 3,6 раза) среди больных, принимавших флекаинид и энкаинид, несмотря на эффективное устранение желудочковых экстрасистол. В дальнейшем увеличение смертности было выявлено и на фоне приема морицизина (CAST-II). Результаты исследования CAST заставили пересмотреть тактику лечения не только больных с нарушениями ритма сердца, но и кардиологических пациентов в целом. Исследование CAST сыграло едва ли не основную роль в становлении доказательной медицины.
Единственными ААП, на фоне приема которых отмечается снижение смертности, являются β-блокаторы и амиодарон. Поэтому в настоящее время β-блокаторы и амиодарон являются препаратами выбора при лечении аритмий у больных с органическим поражением сердца.
У всех ААП имеются нежелательные побочные эффекты. Как правило, их частота и выраженность зависят от дозы препарата. Подробный перечень побочных эффектов ААП занимает несколько десятков страниц. Перечень побочных эффектов каждого ААП приводится в аннотациях к препаратам.
Высокая частота аритмогенного действия и побочных эффектов ААП позволяют в качестве одного из основных принципов лечения аритмий предложить следующее: «Избегать назначения антиаритмических препаратов всегда, когда это возможно» (R. F. Fogoros, 1997).
Применяемые для внутривенного введения ААП и рекомендуемые суточные дозы приведены в таблице 2, для приема внутрь — в таблице 3.
Краткая характеристика ААП. Из ААП I класса в России используют в основном четыре препарата: хинидин (кинидин дурулес), аллапинин, этацизин и пропафенон (ритмонорм, пропанорм). Эти препараты обладают примерно одинаковой эффективностью и переносимостью. Кроме этих препаратов I класса, в неотложных ситуациях используют внутривенное введение новокаинамида и лидокаина.
После исследования CAST и опубликования результатов метаанализа исследований по применению ААП I класса, в ходе которого было показано, что практически все ААП I класса способны влиять на увеличение смертности у больных с органическим поражением сердца, β-блокаторы стали самыми популярными ААП.
Антиаритмический эффект β-блокаторов обусловлен именно блокадой бета-адренергических рецепторов, т. е. уменьшением симпатико-адреналовых влияний на сердце. Поэтому β-блокаторы наиболее эффективны при аритмиях, связанных с симпатико-адреналовыми влияниями — так называемых катехоламинзависимых, или адренергических, аритмиях. Их возникновение, как правило, связано с физической нагрузкой или психоэмоциональным напряжением.
β-блокаторы являются препаратами выбора для лечения аритмий при врожденных синдромах удлинения интервала QT.
При аритмиях, не связанных с активацией симпатической нервной системы, β-блокаторы гораздо менее эффективны, но их добавление в схему лечения нередко значительно увеличивает эффективность других ААП и снижает риск аритмогенного эффекта ААП I класса. Препараты I класса в сочетании с β-блокаторами не влияют на увеличение смертности у больных с органическим поражением сердца (исследование CAST).
Дозы β-блокаторов регулируют в соответствии с антиаритмическим эффектом. Дополнительным критерием достаточной β-блокады является снижение частоты сердечных сокращений (ЧСС) до 50/мин.
Оригинальным препаратом является амиодарон. Он обладает свойствами всех четырех классов ААП и, кроме того, оказывает умеренное a-блокирующее и антиоксидантное действие. Амиодарон, несомненно, является самым эффективным из существующих ААП. Его даже называют «аритмолитическим препаратом». Вместе с тем отношение кардиологов к амиодарону с самого начала его использования для лечения аритмий вызывало наибольшие разногласия. Из-за высокой частоты возникновения экстракардиальных побочных эффектов амиодарон достаточно долго считали препаратом резерва: рекомендовали применять только при опасных для жизни аритмиях и лишь при отсутствии эффекта от всех остальных ААП (L. N. Horowitz, J. Morganroth, 1978; J. W. Mason, 1987; J. C. Somberg, 1987).
Однако после проведения CAST и других исследований стало ясно, что амиодарон является не только самым эффективным, но и самым безопасным (после β-блокаторов) ААП. В ходе многочисленных крупных контролируемых исследований эффективности и безопасности применения амиодарона не только не выявлено увеличения смертности, а, наоборот, наблюдалось снижение общей смертности и частоты аритмической и внезапной смерти. Частота возникновения желудочковой тахикардии типа «пируэт» на фоне приема амиодарона гораздо ниже, чем на фоне других ААП, удлиняющих интервал QT, и составляет менее 1%. В результате из препаратов резерва амиодарон перешел в препараты первого выбора при лечении аритмий.
Основным недостатком препарата является высокая частота экстракардиальных побочных эффектов при длительном приеме (J. A. Johus и др., 1984; J. F. Best и др., 1986; W. M. Smith и др., 1986). К основным побочным эффектам амиодарона относятся: фотосенсибилизация, изменение цвета кожи, нарушение функции щитовидной железы (как гипотиреоз, так и гипертиреоз), повышение активности трансаминаз, периферические нейропатии, мышечная слабость, тремор, атаксия, нарушения зрения. Большинство этих побочных эффектов обратимы и исчезают после отмены или при уменьшении дозы амиодарона. Гипотиреоз можно контролировать с помощью приема левотироксина. Наиболее опасным побочным эффектом амиодарона является поражение легких («амиодароновое поражение легких»). По данным разных авторов, его частота составляет от 1 до 17%, а смертность в случае развития фиброза легких — от 10 до 20% (J. J. Heger и др., 1981; B. Clarke и др., 1985, 1986). Однако в большинстве случаев поражение легких развивается только при длительном приеме сравнительно больших поддерживающих доз амиодарона — более 400 мг/сут (до 600 или даже 1200 мг/сут). Такие дозы в настоящее время практически не применяют. Поддерживающая доза препарата в России обычно составляет 200 мг/сут или даже меньше (по 200 мг 5 дней в неделю). В настоящее время частота «амиодаронового поражения легких» составляет не более 1% в год (S. J. Connolly, 1999; M. D. Siddoway, 2003).
Амиодарон обладает уникальными фармакокинетическими свойствами. Для наступления антиаритмического эффекта от приема препарата необходим период «насыщения» — «кордаронизация».
В России наиболее распространенной схемой назначения амиодарона является прием по 600 мг/сут (по 3 таблетки в день) в течение 1 нед, далее — по 400 мг/сут (по 2 таблетки в день) еще 1 нед, поддерживающая доза — длительно по 200 мг в день (по 1 таблетке в день) или менее. Антиаритмический эффект наступает более быстро при назначении высоких нагрузочных доз амиодарона во время «насыщения», например по 1200 мг/сут и более в течение 1 нед, далее — постепенное снижение дозы до 200 мг в день (титрование по эффекту до минимальных эффективных доз). Есть сообщения об эффективном применении очень высоких доз амиодарона — по 800– 2000 мг 3 раза в день (т. е. до 6000 мг/сут — до 30 таблеток в день!) у больных с тяжелыми, рефрактерными к другим способам лечения опасными для жизни желудочковыми аритмиями с повторными эпизодами фибрилляции желудочков (N. D. Mostow и др., 1984; S. J. L. Evans и др., 1992). Однократный прием амиодарона в дозе 30 мг/кг веса официально рекомендован как один из способов восстановления синусового ритма при мерцательной аритмии.
После достижения антиаритмического эффекта дозу постепенно уменьшают до минимально эффективной. Эффективными поддерживающими дозами амиодарона могут быть 100 мг/сут и даже 50 мг/сут (M. Dayer, S. Hardman, 2002).
Действие и эффективность внутривенного применения амиодарона менее изучены по сравнению с пероральным приемом. При болюсном внутривенном введении препарат обычно вводят 5 мг/кг веса в течение 5 мин. Одна из наиболее популярных схем внутривенного введения амиодарона: болюс 150 мг за 10 мин, затем инфузия со скоростью 1 мг/мин в течение 6 ч (360 мг за 6 ч), далее инфузия со скоростью 0,5 мг/мин.
Опубликованные данные свидетельствуют о том, что при желудочковых тахиаритмиях внутривенное введение амиодарона более эффективно, чем применение лидокаина, бретилия тозилата и новокаинамида. Применение амиодарона эффективно при всех вариантах наджелудочковых и желудочковых аритмий. Даже при аритмиях, рефрактерных ко всем остальным ААП, эффективность препарата достигает 60–80%, как при внутривенном введении, так и при приеме внутрь.
При применении соталола (соталекса) средние суточные дозы составляют 240–320 мг. Начинают с назначения 80 мг 2 раза в день. На фоне приема соталола имеется повышенный риск развития желудочковой тахикардии типа «пируэт». Поэтому прием этого препарата желательно начинать в стационаре. При его назначении необходимо тщательно контролировать величину интервала QT, особенно в первые 3 дня. Корригированный интервал QT не должен превышать 0,5 с.
К новым ААП III класса относятся так называемые «чистые» ААП III класса — дофетилид, ибутилид и отечественный препарат нибентан. Эти лекарственные средства применяются преимущественно для лечения мерцательной аритмии. Они удлиняют интервал QT и их применение сопровождается повышенным риском возникновения желудочковой тахикардии типа «пируэт».
Дофетилид назначают внутрь по 0,5 г 2 раза в день. Частота возникновения тахикардии типа «пируэт» составляет около 3%, в основном в первые 3 дня приема препарата. Дофетилид отменяют при удлинении корригированного интервала QT более 0,5 с. Ибутилид назначают внутривенно для восстановления синусового ритма при мерцательной аритмии. Ибутилид вводят внутривенно струйно 1 мг в течение 10 мин. При отсутствии эффекта препарат вводят повторно. Эффективность ибутилида в купировании мерцания и трепетания предсердий составляет около 45%. Частота возникновения тахикардии типа «пируэт» достигает 8,3%.
Нибентан, ампулы по 20 мг (2 мл 1% раствора), отечественный препарат, наиболее эффективный при мерцательной аритмии. По опубликованным данным, нибентан намного превосходит все имеющиеся зарубежные аналоги. Его эффективность в восстановлении синусового ритма даже при постоянной форме мерцательной аритмии достигает 100%. Препарат вводится внутривенно в дозе 0,125 мг/кг (т. е. примерно 1 мл — 10 мг) в течение 3 мин (в 20 мл изотонического раствора натрия хлорида). В последние годы получены данные, что введение в 2 раза меньшей дозы (0,0625 мг/кг — примерно 0,5 мл — 5 мг), как правило, не менее эффективно. При отсутствии эффекта через 15 мин нибентан вводят повторно в той же дозе. Побочные эффекты (появление кислого или «металлического» вкуса во рту, ощущение «жара» или «холода», двоение в глазах, легкое головокружение, першение в горле) и аритмогенное действие нибентана (желудочковые экстрасистолы и желудочковая тахикардия типа «пируэт») наблюдаются сравнительно редко — примерно в 1% случаев.
Основным показанием для назначения верапамила и дилтиазема является купирование пароксизмальных реципрокных атриовентрикулярных узловых тахикардий. Эффективность верапамила и дилтиазема в купировании пароксизмальных наджелудочковых тахикардий составляет 80–100%. Вторым показанием для применения верапамила и дилтиазема служит урежение ЧСС при тахисистолической форме мерцательной аритмии. Следует отметить, что внутривенное введение верапамила противопоказано при мерцательной аритмии у больных с синдромом Вольфа–Паркинсона–Уайта, так как у некоторых больных после введения верапамила наблюдается резкое увеличение частоты сокращений желудочков до 300 в минуту и более. Существует вариант желудочковой тахикардии, при котором верапамил выступает в качестве препарата выбора и нередко единственного эффективного лекарственного средства. Это так называемая верапамилчувствительная желудочковая тахикардия — идиопатическая желудочковая тахикардия, при которой комплексы QRS имеют форму блокады правой ножки пучка Гиса с отклонением электрической оси влево.
Принципы выбора ААП. Как и при лечении других заболеваний, выбор ААП осуществляется прежде всего на основании данных об эффективности, безопасности, побочных эффектах и противопоказаний к его назначению. При наличии показаний для лечения того или иного варианта нарушения ритма выбирают препарат, наиболее приемлемый для данного больного. В дальнейшем при необходимости последовательно оценивают все имеющиеся ААП до тех пор, пока не будет обнаружено первое эффективное средство, или выбирают самый подходящий препарат из нескольких действенных. В случае отсутствия эффекта от монотерапии подбирают комбинацию ААП или применяют немедикаментозные способы лечения аритмий.
У больных с аритмиями, но без признаков органического заболевания сердца считается допустимым назначение любых ААП.
У пациентов с органическим заболеванием сердца (постинфарктный кардиосклероз, гипертрофия желудочков и/или дилатация сердца) препаратами первого выбора являются β-блокаторы и амиодарон. С учетом безопасности ААП оценку эффективности целесообразно начинать с β-блокаторов или амиодарона. При неэффективности монотерапии оценивают эффект сочетания амиодарона и β-блокаторов. Если нет брадикардии или удлинения интервала РR, можно сочетать с амиодароном любой β-блокатор. У больных с брадикардией к амиодарону добавляют пиндолол (вискен). Показано, что совместный прием амиодарона и β-блокаторов в значительно большей степени снижает смертность среди пациентов с сердечно-сосудистыми заболеваниями, чем каждый из препаратов в отдельности. Только при отсутствии эффекта от β-блокаторов и/или амиодарона применяют ААП I класса. При этом препараты I класса, как правило, назначают на фоне терапии β-блокатором или амиодароном.
Примерная последовательность подбора эффективной медикаментозной терапии у больных с рецидивирующими аритмиями:
П. Х. Джанашия, доктор медицинских наук, профессор
Н. М. Шевченко, доктор медицинских наук, профессор
С. В. Шлык, доктор медицинских наук, профессор
Е. О. Хамицаева, кандидат медицинских наук
РГМУ, Москва