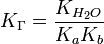Почему степень гидролиза ацетата аммония больше чем степень гидролиза натрия
Гидролиз ацетата аммония
Общие сведения о гидролизе ацетата аммония
Формула – CH3COONH4. Представляет собой бесцветные кристаллы. Молярная масса – 56 г/моль.
Гидролиз ацетата аммония
Гидролизуется по катиону и аниону. Характер среды – нейтральный. Уравнение гидролиза выглядит следующим образом:
NH4 + +HOH↔NH4OH + H + (гидролиз по катиону);
CH3COO — + HOH↔ CH3COOH + OH — (гидролиз по аниону);
Примеры решения задач
| Задание | Какие продукты образуются, если ацетат аммония нагреть до 200 0 С. Запишите уравнение реакции. |
| Решение | При нагревании многих солей происходит их разложение, однако, в случае с ацетатом аммония это не так. Имеет место перегруппировка. В ходе реакции образуется ацетамид (амид уксусной кислоты) и вода: |
| Задание | Укажите основные области применения ацетата аммония. |
| Ответ | Ацетат аммония применяется в качестве пищевой добавки, известной под названием Е264 и представляющей собой консервант. Это вещество также используют при производстве противогололедных материалов, которыми обрабатывают автомагистрали. Ацетат аммония один из компонентов ацетатного буферного раствора. Его применяют в органическом синтезе, например в реакции Кнёвенагеля. |
Копирование материалов с сайта возможно только с разрешения
администрации портала и при наличие активной ссылки на источник.
Гидролиз солей
В общем случае, гидролиз солей – это процесс обменного разложения воды и растворенной в ней соли – электролита, приводящий к образованию малодиссоциирующего вещества.
Гидролиз является частным случаем сольволиза – обменного разложения растворенного вещества и растворителя.
Характеризовать гидролиз количественно позволяют такие величины, как Степень гидролиза и константа гидролиза.
Степень гидролиза
Степень гидролиза — это соотношение количества подвергающейся гидролизу соли nгидр и общего количества растворенной соли nобщ.
Обычно, ее обозначают через hгидр (или α ):
Величина hгидр увеличивается с уменьшением силы образующих соль кислоты или основания.
Константа гидролиза
Представим в общем виде процесс гидролиза соли, в котором в роли соли выступает – МА, а НА и МОН — соответственно, кислота и основание, которые образуют данную соль:
MA + H2O ↔ HA + MOH
Применив закон действующих масс, запишем константу, соответствующую этому равновесию:
Известно, что концентрация воды в разбавленных растворах, имеет практически постоянное значение, поэтому ее можно включить в константу
тогда соотношение для константы гидролиза соли Kг будет иметь такой вид:
По величине константы гидролиза можно судить о полноте гидролиза:
чем больше значение константы гидролиза Kг, тем в большей мере протекает гидролиз.
Константа и степень гидролиза связаны соотношением:
Где С – концентрация соли в растворе,
h- степень гидролиза.
Это выражение можно упростить, т.к. обычно h˂˂1, тогда
Зная, константу гидролиза, можно определить pH среды:
Концентрация образовавшейся кислоты равна концентрации гидроксид ионов, тогда
Kг = [OH — ] 2 /[MA]
Используя это выражение можно вычислить pH раствора
[OH — ] = (Kг·[MA]) 1/2 моль/л
Гидролиз солей можно представить, как поляризационное взаимодействие ионов и их гидратной оболочки.
Гидролиз протекает тем полнее, сильнее поляризующее действие ионов.
Возможны 4 случая протекания гидролиза:
1. Соли, образованные сильным основанием и сильной кислотой (гидролиз не протекает)
Соли, образованные сильным основанием и сильной кислотой не подвергаются гидролизу.
В этом случае, гидролиз практически не происходит, т.к. катионы и анионы, образующиеся в растворе при диссоциации соли, слабо поляризуют гидратную оболочку. pH среды не изменяется (рН ≈ 7):
NaCl ↔ Na + + Cl —
Na + + HOH ↔ реакция практически не протекает
Cl — + HOH ↔ реакция практически не протекает
2. Соли, образованные слабым основанием и сильной кислотой (гидролиз по катиону)
Такое соединение, при ионизации, образует катионы, способные к поляризации гидратной оболочки и анионы, которые их поляризуют слабо. Тогда гидролиз проходит по катиону, при этом среда носит кислый характер, т.е. рН ˂ 7:
NH4Cl ↔ NH4 + + Cl —
NH4 + + HOH ↔ NH4OH + H +
Cl — + HOH ↔ реакция практически не идет
NH4Cl+ HOH ↔ NH4OH + HCl
Для солей, образованных слабым основанием и сильной кислотой, константа гидролиза и константа диссоциации основания связаны соотношением:
Понятно, что чем меньше сила основания, тем в большей степени протекает гидролиз.
Если соль образованна слабым основанием многовалентного металла и сильной кислотой, то ее гидролиз будет протекать ступенчато:
FeCl2 ↔ Fe 2+ + 2Cl —
| I ступень | Fe 2+ + HOH ↔ (FeOH) + + H + FeCl2 + HOH ↔ (FeOH)Cl + HCl |
| II ступень | (FeOH) + + HOH ↔ Fe(OH)2 + H + (FeOH)Cl + HOH↔ Fe(OH)2 + HCl |
Константа гидролиза по первой ступени связана с константой диссоциации основания по второй ступени, а константа гидролиза по второй ступени — с константой диссоциации основания по первой ступени:
Поскольку первая константа диссоциации кислоты всегда больше второй, то первая константа гидролиза всегда больше, чем константа вторая гидролиза, так как первая константа диссоциации основания всегда больше второй
Отсюда следует, что по первой ступени, гидролиз всегда будет протекать в большей степени, чем по второй. Этому также способствуют ионы, которые образуются при гидролизе по первой ступени, они приводят подавлению гидролиза по второй ступени, смещая равновесие влево.
Сравнивая величины Kг и Kосн можно качественно определить pH среды.
Так, если Kг намного больше Kосн, то среда сильнокислая, при Kг намного меньшей Kосн — среда слабокислая, а если Kг и Kосн сопоставимы, то — среднекислая.
3. Соль, образованная сильным основанием и слабой кислотой (гидролиз по аниону)
Такое соединение в растворе образует слабополяризующие катионы и среднеполяризующие анионы. Гидролиз протекает по аниону, и в его результате создается щелочная среда, pH > 7:
NaCN ↔ Na + + CN —
CN — + HOH ↔ HCN + OH —
Na + + HOH ↔ реакция практически не идет
NaCN + HOH ↔ HCN + NaOH
Константа гидролиза и константа диссоциации кислоты связаны зависимостью:
Т.е. гидролиз соли протекает тем полнее, чем слабее образующая эту соль, кислота.
Возможен гидролиз соли, образованной слабой многоосновной кислотой и сильным основанием. В этом случае гидролиз протекает по ступеням:
| I ступень | SO3 2- + HOH ↔ HSO3 — + OH — Na2SO3 + HOH ↔ NaHSO3 + NaOH |
| II ступень | HSO3 — + HOH ↔ H2SO3 + OH — NaHSO3 + HOH ↔ H2SO3 + NaOH |
В этом случае, константа гидролиза по первой и второй ступеням определяется соотношениями:
Следует помнить, что гидролиз по второй ступени протекает в ничтожно малой степени.
Сравнивая величины Kг и Kк-ты, можно качественно определить pH среды. Так, если Kг намного больше Kк-ты, то среда сильнощелочная, при Kг намного меньшей Kк-ты — среда слабощелочная, а если Kг и Kосн сопоставимы, то — среднещелочная.
4. Соли, образованные слабым основанием и слабой кислотой (гидролиз и по катиону и по аниону)
Такие соли, при ионизации образуют среднеполяризующие катионы и анионы, поэтому гидролиз возможен как по катиону, так и по аниону.
При этом относительная сила образовавшихся кислоты и основания, будут влиять на характер среды (слабокислая или слабощелочная, pH ≈ 7). Такого типа гидролиз протекает особо полно, обычно с образованием малорастворимого вещества:
Константу гидролиза можно рассчитать, зная константы диссоциации кислоты и основания с помощью следующего соотношения:
Совместный гидролиз солей
Совместный гидролиз протекает при взаимодействии растворов двух солей, одна из которых образована слабым основанием и сильной кислотой, а вторая напротив сильным основанием и слабой кислотой. Т.е. одна соль гидролизуется по катиону, а другая – по аниону.
В таких случаях гидролиз взаимно усиливается.
Например, рассмотрим совместный гидролиз растворов солей хлорида алюминия и сульфида натрия:
При гидролизе хлорида алюминия соль гидролизуется по катиону:
AlCl3 ↔ Al 3+ + 3Cl —
Al 3+ + 3HOH ↔ Al(OH)3 + 3H +
При гидролизе сульфида натрия соль гидролизуется по аниону:
Na2S ↔ 2Na + + S 2-
S 2- + 2HOH ↔ H2S + 2OH —
Суммарная реакция гидролиза:
Влияние различных факторов на протекание гидролиза
В разделе Задачи к разделу Гидролиз солей приведены задачи на определение степени и константы гидролиза, составление уравнений гидролиза, определение рН среды и др.
Гидролиз
По катиону, по аниону или нет гидролиза?
Если в состав соли входит остаток сильного основания и остаток слабой кислоты, то гидролиз идет по аниону. Примеры: K3PO4, NaNO2, Ca(OCl)2, Ba(CH3COO)2, Li2SiO3.
Если соль образована остатком слабого основания и слабой кислоты, то гидролиз идет и по катиону, и по аниону. Примеры: Mg(NO2)2, Al2S3, Cr2(SO3)3, CH3COONH4.
Среда раствора
Среда раствора может быть нейтральной, кислой или щелочной. Определяется типом гидролиза. Некоторые задания могут быть построены так, что, увидев соль, вы должны будете определить ее тип раствора.
Однако замечу, что в дигидрофосфатах, гидросульфитах и гидросульфатах среда всегда кислая из-за особенностей диссоциации. Примеры: NH4H2PO4, LiHSO4. В гидрофосфатах среда щелочная из-за того, что константа диссоциации по третьей ступени меньше, чем константа гидролиза. Примеры: K2HPO4, Na2HPO4.
Попробуйте определить среду раствора для соединений из самостоятельного задания, которое вы только что решили. Ниже будет располагаться решение.
С целью запутать в заданиях часто бывают даны синонимы. Так «среду раствора» могут заменить водородным показателем pH.
Запомните, что кислая среда характеризуется pH 7.
Гидролиз солей. Степень и константа гидролиза



Гидролиз солей — разновидность реакций гидролиза, обусловленного протеканием реакций ионного обмена в растворах (преимущественно, водных) растворимых солей-электролитов. Движущей силой процесса является взаимодействие ионов с водой, приводящее к образованию слабого электролита в ионном или (реже) молекулярном виде («связывание ионов»).
Различают обратимый и необратимый гидролиз солей:
§ 1. Гидролиз соли слабой кислоты и сильного основания (гидролиз по аниону):
CO3 2− + H2O = HCO3 − + OH −
Na2CO3 + Н2О = NaHCO3 + NaOH
(раствор имеет слабощелочную среду, реакция протекает обратимо, гидролиз по второй ступени протекает в ничтожной степени)
§ 2. Гидролиз соли сильной кислоты и слабого основания (гидролиз по катиону):
Cu 2+ + Н2О = CuOH + + Н +
CuCl2 + Н2О = CuOHCl + HCl
(раствор имеет слабокислую среду, реакция протекает обратимо, гидролиз по второй ступени протекает в ничтожной степени)
§ 3. Гидролиз соли слабой кислоты и слабого основания:
2Al 3+ + 3S 2− + 6Н2О = 2Al(OH)3(осадок) + ЗН2S(газ)
Al2S3 + 6H2O = 2Al(OH)3 + 3H2S
(равновесие смещено в сторону продуктов, гидролиз протекает практически полностью, так как оба продукта реакции уходят из зоны реакции в виде осадка или газа).
Соль сильной кислоты и сильного основания не подвергается гидролизу, и раствор нейтрален.
Степень гидролиза
Под степенью гидролиза подразумевается отношение части соли, подвергающейся гидролизу, к общей концентрации её ионов в растворе. Обозначается α (или hгидр);
α = (cгидр/cобщ)·100 %
где cгидр — число молей гидролизованной соли, cобщ — общее число молей растворённой соли.
Степень гидролиза соли тем выше, чем слабее кислота или основание, её образующие.
Является количественной характеристикой гидролиза.
Константа гидролиза — константа равновесия гидролитической реакции.
Выведем уравнение константы гидролиза соли, образованной слабой кислотой и сильным основанием:
Уравнение константы равновесия для данной реакции будет иметь вид:

Так как концентрация молекул воды в растворе постоянна, то произведение двух постоянных 
Численное значение константы гидролиза получим, используя ионное произведение воды 
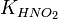
подставим в уравнение константы гидролиза равна:
В общем случае для соли, образованной слабой кислотой и сильным основанием:

для соли, образованной сильной кислотой и слабым основанием:

для соли, образованной слабой кислотой и слабым основанием:
Буферное действие – основной механизм протолитического гомеостаза в организме. Механизм действия буферных систем. Зона буферного действия и буферная ёмкость. Расчёт рН буферных систем.
Буферные системы –это растворы, обладающие способностью сохранять постоянство рН среды при разбавлении, а также при добавлении небольших количеств сильной кислоты или щелочи.
рН венозной крови 7,36
артериальной – 7,4
Буферная система состоит из донора протонов (кислоты) и акцептора (сопряжённого основания).
рН буферной смеси зависит только от соотношения компонентов и не зависит от концентрации. Протоны добавленной кислоты будут связываться с основанием, а гидроксид-анионы добавленного основания – с кислотой буф. Смеси. Предел действия ограничен количеством компонентов буферной смеси. Мерой буферного действия количественно характеризующей способность буферных систем противодействовать смещению активной реакции среды – буферная ёмкость.
Буферная ёмкость равна числу молей эквивалента сильной кислоты или сильного основания, которое нужно добавить к 1 л буф. Смеси, чтобы его рН изменился на 1.
Буф. Ёмкость зависит от:
Концентраций компонентов раствора.
Соотношения концентраций. Чем соотношение ближе к 1, тем больше ёмкость.
Вопрос
Гемоглобиновая буферная система является основным буфером эритроцитов крови и составляет около 75% всей буферной ёмкости крови. Гемоглобин, как и другие белки, — амфолит, то есть, гемоглобиновая буферная система состоит из кислого компонента (оксигенированного Нb, т.е. НbО2) и основного компонента (неоксигенированного, т.е. восстановленного Нb). Показано, что гемоглобин — более слабая кислота (примерно в 70 раз), чем оксигемоглобин. Кроме того, Нb поддерживает постоянство рН благодаря связыванию С02 и переносу его из ткани в лёгкие и далее — во внешнюю среду.
Фосфатная буферная система представлена одно- и двузамещённым фосфорнокислым натрием (NaH2P04 и Na2HP04). Первое соединение ведёт себя как слабая кислота, второе — как слабое основание. Образовавшиеся в организме и поступившие в кровь кислоты взаимодействуют с Na2HP04, а основания — с NaH2P04. В итоге рН крови сохраняется неизменным. Фосфаты выполняют буферную роль главным образом во внутриклеточной среде (особенно клеток канальцев почек) и поддерживают исходное состояние бикарбонатного буфера.
Гемоглобиновая буферная система является основным буфером эритроцитов крови и составляет около 75% всей буферной ёмкости крови. Гемоглобин, как и другие белки, — амфолит, то есть, гемоглобиновая буферная система состоит из кислого компонента (оксигенированного Нb, т.е. НbО2) и основного компонента (неоксигенированного, т.е. восстановленного Нb). Показано, что гемоглобин — более слабая кислота (примерно в 70 раз), чем оксигемоглобин. Кроме того, Нb поддерживает постоянство рН благодаря связыванию С02 и переносу его из ткани в лёгкие и далее — во внешнюю среду.
Белковая буферная система выполняет роль внутриклеточной буферной системы. Обладая амфолитными свойствами, в кислой среде они ведут себя как основания, а в щелочной среде — как кислоты. Белковая буферная система состоит из слабодиссоциирующего белка с кислым свойствами (белок-СООН) и белка в комплексе с сильными основаниями (белок-COONa). Эта буферная система также способствует предупреждению сдвига рН крови
Важнейший показатель гомеостаза организма — концентрация ионов водорода (H+) в клетках, плазме и других внеклеточных средах. Содержание Н+ в последних влияет на конформацию макромолекул, физико-химическое и структурное состояние мембран, интенсивность образования активных форм кислорода и гидроперекисей, возбудимость, лабильность и проводимость возбудимых тканей, особенно нервных структур, чувствительность рецепторов к ФАВ, гормонам, медиаторам, сродство Нb к кислороду, активность ферментативных реакций и т.д.
Вопрос
Константа равновесия — Константа равновесия величина, определяющая для данной химической реакции соотношение между термодинамическими активностями исходных веществ и продуктов в состоянии химического равновесия.
Условие образования осадков непосредственно вытекает из выражения (44): если в растворе произведение реальных концентраций ионов 



Если возникает необходимость растворить осадок 
Обр костной ткани
10Ca(OH)2 + 6H3PO4 = Ca10(PO4)6(OH)2 + 18H2O
3Ca3(PO4)2 + Ca(OH)2 = 2Ca5(PO4)3OH
5CaHPO4 + 6NaOH = Ca5(PO4)3OH + 2Na3PO4 + 5H2O