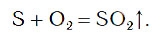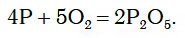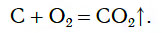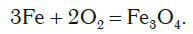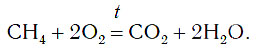Почему скорость реакции горения веществ в кислороде больше чем в воздухе
Урок 18. Физические и химические свойства кислорода
В уроке 18 «Физические и химические свойства кислорода» из курса «Химия для чайников» выясним, какие физические и химические свойства имеет кислород и узнаем о реакциях горения.
Как у любого химического вещества, у кислорода есть свой набор физических и химических свойств, по которым его можно отличить от других веществ.
Физические свойства
По своим физическим свойствам простое вещество кислород относится к неметаллам. При нормальных условиях он находится в газообразном агрегатном состоянии. Кислород не имеет цвета, запаха и вкуса. Масса кислорода объемом 1 дм 3 при н. у. равна примерно 1,43 г.
При температуре ниже −183 °С кислород превращается в голубую жидкость, а при −219 °С эта жидкость переходит в твердое вещество. Это означает, что температура кипения кислорода равна: t кип.= −183 °С, а температура плавления составляет: t пл.= −219 °С. Кислород плохо растворяется в воде.
Химические свойства
Кислород является химически активным веществом. Он способен вступать в реакции с множеством других веществ, однако для протекания большинства этих реакций необходима более высокая, чем комнатная, температура. При нагревании кислород реагирует с неметаллами и металлами.
Если стеклянную колбу наполнить кислородом и внести в нее ложечку с горящей серой, то сера вспыхивает с образованием яркого пламени и быстро сгорает (рис. 80).
Химическую реакцию, протекающую в этом случае, можно описать следующим уравнением:
В результате реакции образуется вещество SO2, которое называется сернистым газом. Сернистый газ имеет резкий запах, который вы ощущаете при зажигании обычной спички. Это говорит о том, что в состав головки спички входит сера, при горении которой и образуется сернистый газ.
Подожженный красный фосфор в колбе с кислородом вспыхивает еще ярче и быстро сгорает, образуя густой белый дым (рис. 81).
При этом протекает химическая реакция:
Белый дым состоит из маленьких твердых частиц продукта реакции — P2O5.
Если в колбу с кислородом внести тлеющий уголек, состоящий в основном из углерода, то он также вспыхивает и сгорает ярким пламенем (рис. 82).
Протекающую химическую реакцию можно представить следующим уравнением:
Продуктом реакции является CO2, или углекислый газ, с которым вы уже знакомы. Доказать образование углекислого газа можно, добавив в колбу немного известковой воды. Помутнение свидетельствует о присутствии CO2 в колбе.
Возгорание уголька можно использовать для отличия кислорода от других газов. Если в сосуд (колбу, пробирку) с газом внести тлеющий уголек и он вспыхнет, то это указывает на наличие в сосуде кислорода.
Кроме неметаллов, с кислородом реагируют и многие металлы. Внесем в колбу с кислородом раскаленную стальную проволоку, состоящую в основном из железа. Проволока начинает ярко светиться и разбрасывать в разные стороны раскаленные искры, как при горении бенгальского огня (рис. 83).
При этом протекает следующая химическая реакция:
В результате реакции образуется вещество Fe3O4 (железная окалина). В состав формульной единицы этого вещества входят три атома железа, причем один из них имеет валентность II, а два других атома имеют валентность III. Поэтому формулу этого вещества можно представить в виде FeO * Fe2O3.
На заметку: Реакцию железа с кислородом используют для резки стальных изделий. Для этого определенный участок детали сначала нагревают с помощью кислородногазовой горелки. Затем направляют на нагретое место струю чистого кислорода, для чего перекрывают кран поступления горючего газа в горелку. Нагретое до высокой температуры железо вступает в химическую реакцию с кислородом и превращается в окалину. Так можно разрезать очень толстые железные детали.
Реакции горения
Общим для рассмотренных нами реакций является то, что при их протекании выделяется много света и теплоты. Очень многие вещества именно так взаимодействуют между собой.
Рассмотренные выше реакции простых веществ серы, фосфора, углерода и железа с кислородом являются реакциями горения.
Реакциями горения называются химические реакции, протекающие с выделением большого количества теплоты и света.
На заметку: Некоторые химические реакции протекают очень быстро. Такие реакции называют взрывными или просто взрывами. Например, взаимодействие кислорода с водородом может протекать в форме взрыва.
Горение может протекать не только в кислороде, но и в других газах. Об этих процессах вы узнаете при дальнейшем изучении химии.
Горение веществ на воздухе и в кислороде
Вы уже знаете, что в состав окружающего нас воздуха входит кислород. Поэтому многие вещества горят не только в чистом кислороде, но и на воздухе.
Горение на воздухе протекает чаще всего гораздо медленнее, чем в чистом кислороде. Происходит это потому, что в воздухе лишь одна пятая часть по объему приходится на кислород. Если уменьшить доступ воздуха к горящему предмету (а следовательно, уменьшить доступ кислорода), горение замедляется или прекращается. Отсюда понятно, почему для тушения загоревшегося предмета на него следует набросить, например, одеяло или плотную тряпку.
На заметку : При пожарах для тушения горящих предметов часто используют пену (рис. 84). Она обволакивает горящий предмет и прекращает доступ к нему кислорода. Горение сначала замедляется, а затем прекращается совсем.
Некоторые вещества, быстро сгорающие в кислороде, на воздухе не горят вообще. Так, если нагреть железную проволоку на воздухе даже до белого каления, она все равно не станет гореть, тогда как в чистом кислороде быстро сгорает с образованием раскаленных искр.
Краткие выводы урока:
Надеюсь урок 18 «Физические и химические свойства кислорода» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Урок по химии 9 класс по теме: «Факторы, влияющие на скорость химических реакций»
Предложите способы ускорения разложения бытовых отходов, используя изученные вами факторы, влияющие на скорость химической реакции. Ответ обоснуйте.
Сортировка (разные вещества разлагаются с различной скоростью);
Сжечь (влияние температуры), выделяющуюся при этом тепловую энергию используют, например для подогрева воды.
— А какие именно отходы вы бы предложили сжечь, и что делать с остальными?
При горении некоторых веществ выделяются ядовитые газы, что вызывает дополнительные проблемы. Кроме того, потребность человечества в материалах так высока, что мы не можем «разбрасываться», просто сжигания их. Большинство отходов необходимо пускать во вторичную переработку, предприятия, которые этим занимаются, являются, как правило, достаточно прибыльными.
Измельчение (увеличение площади соприкосновения веществ).
Проведите дома проблемный эксперимент
Купите в аптеке раствор перекиси водорода. Возьмите кусочек отварного картофеля и кусочек сырого. На каждый налейте немного перекиси водорода. Что наблюдаете? Почему? Попытайтесь объяснить наблюдаемые.
Предложите минимум 2 фактора, которые могли бы увеличить скорость химической реакции.
Задание №4 Экспесс-тест (5 баллов)
1) Зачем нам дома нужен холодильник? (С точки химика)?
2) Почему в лабораторных условиях для проведения реакции гидролиза сахарозы раствор нужно кипятить, а в пищеварительном тракте эта реакция идет при t 36,6 ͦ С и гораздо быстрее?
3) Почему скорость реакции горения веществ в кислороде больше, чем в воздухе? (В воздухе кислорода всего 21%, соответственно в чистом О 2 вещество сгорает быстрее.)
4) На каком принципе основано тушение костра разбрасыванием горящих дров? (Скорость горения тем выше, чем больше V и меньше S поверхности сгораемого материала.)
5) Железо окисляется и на воздухе, и в кислороде. Почему оно горит в кислороде и не горит на воздухе? (Концентрация кислорода в воздухе ниже, чем в чистом кислороде, для окисления его хватает, а для горения- нет.)
Дайте характеристику реакции 2 SO 2 + O 2 ↔2 SO 3 + Q :
а) по числу и составу исходных веществ и продуктов реакции (реакция соединения);
б) по тепловому эффекту (экзотермическая);
в) по изменению степеней окисления (окислительно-восстановительная);
г) по использованию катализатора (каталитическая);
д) по направлению (обратимая).
Выбранный для просмотра документ Домашнее задание. без ответов doc.doc
Предложите способы ускорения разложения бытовых отходов, используя изученные вами факторы, влияющие на скорость химической реакции. Ответ обоснуйте.
Проведите дома проблемный эксперимент
Купите в аптеке раствор перекиси водорода. Возьмите кусочек отварного картофеля и кусочек сырого. На каждый налейте немного перекиси водорода. Что наблюдаете? Почему? Попытайтесь объяснить наблюдаемые.
Предложите минимум 2 фактора, которые могли бы увеличить скорость данной химической реакции.
Задание №4 (5 баллов)
1) Зачем нам дома нужен холодильник? (С точки химика)?
2) Почему в лабораторных условиях для проведения реакции гидролиза сахарозы раствор нужно кипятить, а в пищеварительном тракте эта реакция идет при t 36,6 ͦ С и гораздо быстрее?
3) Почему скорость реакции горения веществ в кислороде больше, чем в воздухе?
4) На каком принципе основано тушение костра разбрасыванием горящих дров?
5) Железо окисляется и на воздухе, и в кислороде. Почему оно горит в кислороде и не горит на воздухе?
Дайте характеристику реакции 2 SO 2 + O 2 ↔ 2 SO 3 + Q :
а) по числу и составу исходных веществ и продуктов реакции
б) по тепловому эффекту
в) по изменению степеней окисления
г) по использованию катализатора
Назовите основные виды человеческой деятельности, влияющей на баланс поглощенного и выделившегося диоксида углерода. К каким последствиям приводит повышение концентрации этого газа в земной атмосфере?
Задание №7. (1-2 балла)
C 
Предложите хотя бы 1 способ смещения равновесия данной реакции влево – к относительно безопасным продуктам.
Урок – практикум в 9 классе по теме: «Факторы, влияющие на скорость химической реакции»
Цель : создать условия для исследования учащимися факторов, влияющих на скорость химической реакции, ситуацию для самостоятельного мышления учащихся.
— продолжить формирование понятия скорость химической реакции;
— углубить знания учащихся о факторах, влияющих на скорость химической реакции;
— рассмотреть влияние различных факторов на скорость химической реакции на основании теории столкновения частиц при химических реакциях;
— развивать умения делать выводы о зависимости скорости химической реакции от различных факторов;
— развивать навыки экспериментальной и практической работы с веществами;
— развивать мотивацию изучения предмета при обращении к жизненному опыту школьников, раскрытии практического значения новых знаний в процессе проведения эксперимента;
— формировать научное мышление учащихся в процессе установления причинно-следственных связей, сравнения и наблюдения объектов и процессов, применения знаний и умений в новых ситуациях;
— формировать научное мировоззрение школьников при усвоении мировоззренческой идеи курса: зависимости протекания химических реакций от природы реагентов, внешних условий и др.
Форма работы: индивидуальная, парная.
Методы работы: частично проблемно – поисковый, лабораторный опыт как метод экспериментального изучения химии.
Тип урока: комбинированный
Оборудование: мультимедийный проектор, компьютер, дидактические карточки, карточки – бонусы,
С понятием «скорость» вы хорошо уже знакомы, оно не раз встречалось вам при решении задач по математике или физике (слайд №2), а на прошлом уроке мы познакомились с понятием «скорость химической реакции», узнали как можно её вычислить, познакомились со значением скорости протекания химических реакций для жизни и деятельности человека
Есть реакции, которые протекают очень быстро, практически мгновенно и реакции, протекающие медленно. Опыт демонстрационный (образование осадка). А вот реакция ржавления проходит медленно и, если мы попытаемся заложить этот опыт, то нам придется ждать результатов несколько дней (слайд 3)
Давайте вспомним, что такое скорость химической реакции?
Далее один из учеников даёт определение и записывает на доске формулу для расчёта скорости химической реакции (слайд 4)
III . Мотивация познавательной деятельности (создание проблемной ситуации):
Вокруг нас и внутри нас постоянно происходят какие-то химические реакции: на кухне, в организме, в лаборатории, на производстве. Одни реакции мы хотели бы ускорить, другие замедлить, например, разложение отходов, огромное количество которых стало существенной проблемой для всего человечества (слайд 5). Как вы думаете, куда идет тот мусор, который мы выбрасываем? Далее развивается дискуссия, на которой обсуждаются вопросы:
— Насколько быстро разлагается, например, пищевые отходы?
— А бумага, древесина, текстиль, металлы?
— Как связана данная проблема с нашим уроком химии?
— Что нужно знать, чтобы уметь управлять скоростью химической реакции?
— Какие факторы влияют на скорость химической реакции?
— Как мы можем это проверить?
Исходя из данной проблемы, как вы сформулируете тему нашего урока? (Н-р, «Определить факторы, влияющие на скорость химической реакции») слайд 6.
-Сегодня, с помощью эксперимента, мы попытаемся узнать, как некоторые факторы могут повлиять на скорость химической реакции.
Экспериментальные исследования показали, что основные факторы, влияющие на скорость химических реакций, это:
природа реагирующих веществ;
концентрация реагирующих веществ;
площадь поверхности соприкосновения реагентов;
температура, при которой проводится реакция;
присутствие в реакции катализатора.
Сейчас вам предстоит экспериментально доказать влияние этих факторов на с.х.р.
IV . Решение проблемы. Изучение нового материала
При выполнении химического эксперимента вы будите пользоваться инструктивными картами (путевой лист урока). В которые запишите свои наблюдения, уравнения химических реакций и выводы по результатам проведенных экспериментов. В конце урока вы сдадите мне их на проверку. Итак. Первый фактор, влияющий на скорость химической реакции это…
1. Природа реагирующих веществ
У каждого вещества свой характер, свой темперамент, своя скорость взаимодействия с другим веществом.
По скорости выделения пузырьков водорода убеждаются во влиянии природы вещества на скорость реакции. Записывается вывод: чем активнее металл, вступающий в реакцию, тем быстрее идет эта реакция (слайд 7, 8)
Вопрос учителя: как вы можете определить, какой из металлов более активен не проводя эксперимента? (Работа с рядом активности металлов)
В пробирку с оксидом меди ( II ) добавили раствор разбавленной серной кислоты. Что наблюдаете? Осторожно нагрейте смесь. Что изменилось? Почему? Какой вывод можно сделать на основании результата этого опыта? Вывод: При повышении температуры скорость большинства химических реакций существенно увеличивается (слайд 7, 8)
3. Площадь поверхности соприкосновения
В пробирку с кусочком мела и порошком мела добавьте немного раствора соляной кислоты. Одинаково ли протекают реакции? Почему? Сделайте вывод (слайд 11.12)
Вывод: Чем больше площадь соприкосновения реагирующих веществ, тем выше скорость химической реакции
4. Концентрация реагирующих веществ
Все вещества состоят из молекул, поэтому естественно предположить, что для того чтобы вступить в реакцию, две молекулы должны достаточно сблизиться.
Как вы думаете, когда более вероятно столкнуться с другими людьми в метро рано утром, вечером или в час пик? Так и в химической реакции, чем выше концентрация реагирующих веществ, тем чаще происходят столкновения молекул, тем быстрее будет протекать реакция. Давайте проверим это предположение экспериментально. Налейте в 2 пустые пробирки немного раствора соляной кислоты, содержимое одной пробирки разбавьте водой приблизительно в 2 раза. В каждую пробирку опустите по 1 грануле цинка. Что наблюдаете? Подтвердилось ли наше предположение? (Слайд 13,14).
5. Влияние катализатора
1) Налейте в пробирку немного раствора H 2 O 2. Видны ли признаки реакции? Добавьте в пробирку небольшое количество оксида марганца ( II ). Что наблюдаете?
2) Положите в пробирку гранулу цинка и добавьте немного раствора соляной кислоты, что наблюдаете? Опустите в реакционный раствор медную проволоку. Изменился ли ход реакции? Что наблюдаете? Почему? Как вы думаете какую роль выполняют в этих реакциях оксида марганца ( II ) и медь? Сделайте выводы?
Вывод: Катализаторы – вещества, ускоряющие протекание химической реакции. Ингибиторы – вещества, замедляющие протекание химической реакции.
Как называются вещества, выступающие в качестве катализаторов в живых организмах? (Слайд 15,16)
V . Оформление полученных результатов
Самостоятельная работа учащихся.
VI . Закрепление и обобщение новых знаний
Вернёмся к вопросу утилизации отходов. Предложите способы ускорения разложения бытовых отходов:
• сортировка (разные вещества разлагаются с различной скоростью);
• сжигание (влияние температуры), выделяющуюся при этом тепловую энергию используют, например, для подогрева воды.
-Могут ли пригодиться знания о скорости химической реакции в быту?
(Например, использование эффективных стиральных порошков, содержащих энзимы (ферменты).
Объясните, почему при использовании таких порошков белье замачивают на несколько часов в теплом мыльном растворе, но, ни в коем случае не кипятят в нем?
(При температуре 50-60 0 ферменты разрушатся («сварятся»), а пятна останутся).
-Почему продукты хранят в холодильнике?
— Для консервирования продуктов используют вещества консерванты. Какое другое название можно дать этим веществам?
Заполнение карты самооценки (см. путевой лист урока)
Почему скорость реакции горения веществ в кислороде больше чем в воздухе
I. Горение и медленное окисление
Горение – это первая химическая реакция, с которой познакомился человек. Огонь… Можно ли представить наше существование без огня? Он вошел в нашу жизнь, стал неотделим от нее. Без огня человек не сварит пищу, сталь, без него невозможно движение транспорта. Огонь стал нашим другом и союзником, символом славных дел, добрых свершений, памятью о минувшем.
Горение — реакция окисления, протекающая с достаточно большой скоростью,сопровождающаяся выделением тепла и света.
Схематически этот процесс окисления можно выразить следующим образом:
Для возникновения горения необходимы:
Температура воспламенения у каждого вещества различна.
В то время как эфир может воспламениться от горячей проволоки, для того чтобы поджечь дрова, нужно нагреть их до нескольких сот градусов. Температура воспламенения веществ различна. Сера и дерево воспламеняются при температуре около 270 °С, уголь – около 350 °С, а белый фосфор – около 40 °С.
Однако не всякое окисление непременно должно сопровождаться появлением света.
Существует значительное число случаев окисления, которые мы не можем назвать процессами горения, ибо они протекают столь медленно, что остаются незаметными для наших органов чувств. Лишь по прошествии определенного, часто весьма продолжительного времени мы можем уловить продукты окисления. Так, например, обстоит дело при весьма медленном окислении (ржавлении) металлов или при процессах гниения.
Разумеется, при медленном окислении выделяется теплота, но это выделение вследствие продолжительности процесса протекает медленно. Однако сгорит ли кусок дерева быстро или подвергнется медленному окислению на воздухе в течение многих лет, все равно – в обоих случаях при этом выделится одинаковое количество теплоты.
Медленное окисление – это процесс медленного взаимодействия веществ с кислородом с медленным выделением теплоты (энергии).
Примеры взаимодействия веществ с кислородом без выделения света: гниение навоза, листьев, прогоркание масла, окисление металлов (железные форсунки при длительном употреблении становятся тоньше и меньше), дыхание аэробных существ, т. е. дышащих кислородом, сопровождается выделением теплоты, образованием углекислого газа и воды.
Познакомимся с характеристикой процессов горения и медленного окисления приведённой в таблице.
Характеристика процессов горения и медленного окисления
§ 18. Реакции горения
1. По каким внешним признакам можно отличить реакции горения от других химических реакций?
Реакции горения протекают с выделением большого количества тепла и света.
2. Почему вещества горят не только в чистом кислороде, но и на воздухе?
Вещества горят и на воздухе, так как в воздухе содержится кислород, который поддерживает горение.
3. Почему в кислороде многие вещества горят более интенсивно, чем на воздухе?
В кислороде многие вещества горят более интенсивно, чем на воздухе, так как воздухе лишь 1/5 объема приходится на кислород.
4. Какое практическое применение имеют реакции горения веществ в кислороде и на воздухе? Приведите приме такой реакции горения.
Реакции горения используются для окислительных процессов различных металлов. Также реакции горения используются для получения тепловой энергии.
5. Как называют вещества, которые используются на практике для получения тепловой энергии за счет их реакции с кислородом? Назовите три примера таких веществ.
Вещества, которые используются на практике для получения тепловой энергии за счет их реакции с кислородом, называю топливо. Например, нефть, горючие сланцы, уголь.
6. Если на тлеющие угольки костра сильно подуть, они вспыхивают ярким пламенем. Поясните, почему это происходит.
Если на тлеющие угольки костра сильно подуть, они вспыхивают ярким пламенем, так как увеличивается количество поступающего кислорода.
7. Почему для тушения горящих предметов в бытовых условиях рекомендуется быстро набросить на них одеяло или плотную ткань?
Для тушения горящих предметов в бытовых условиях рекомендуется быстро набросить на них одеяло или плотную ткань с целью уменьшения доступа кислорода, результате чего горение замедляется или прекращается.
8. Почему использование традиционных видов топлива приводит к усилению парникового эффекта? Как можно избежать этого нежелательного явления?
При использовании традиционных видов топлива в атмосфере увеличивается содержание углекислого газа, который является основным парниковым газом, что приводит к усилению парникового эффекта. Для уменьшения этого нежелательного явления используют очистные установки, совершенствуют системы очистки выхлопных газов автотранспорта, разрабатывают новые экологически чистые производства и виды транспорта (например, электромобили).