какие гормоны синтезируются фетоплацентарной системой
Какие гормоны синтезируются фетоплацентарной системой
При физиологическом течении беременности существует тесная связь между гормональным статусом материнского организма, плацентой и плодом. Плацента обладает избирательной способностью переносить материнские гормоны. Так, гормоны, имеющие сложную белковую структуру (соматотропин, тиреотропный гормон, АКТГ и др.), практически не переходят через плаценту. Проникновению окситоцина через плацентарный барьер препятствует высокая активность в плаценте фермента окситоциназы. Переходу инсулина от организма матери к плоду, по-видимому, препятствует его высокая молекулярная масса.
В противоположность этому стероидные гормоны обладают способностью переходить через плаценту (эстрогены, прогестерон, андрогены, глюко-кортикоиды). Тиреоидные гормоны матери также проникают через плаценту, однако трансплацентарный переход тироксина осуществляется более медленно, чем трийодтиронина.
Наряду с функцией по трансформации материнских гормонов плацента сама превращается во время беременности в мощный эндокринный орган, который обеспечивает наличие оптимального гормонального гомеостаза как у матери, так и у плода.
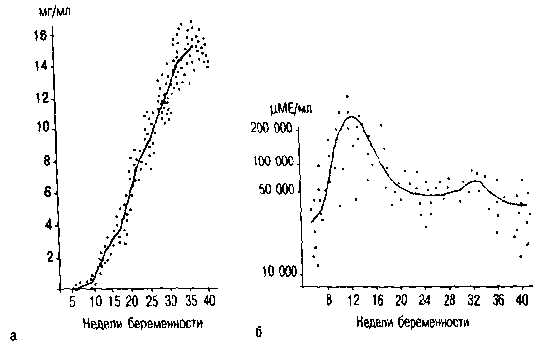
Одним из важнейших плацентарных гормонов белковой природы является плацентарный лактоген (ПЛ). По своей структуре ПЛ близок к гормону роста аденогипофиза. Гормон практически целиком поступает в материнский кровоток и принимает активное участие в углеводном и липидном обмене. В крови беременной ПЛ начинает обнаруживаться очень рано — с 5-й недели, и его концентрация прогрессивно возрастает, достигая максимума в конце гестации (рис. 3.11, а). ПЛ практически не проникает к плоду, а в амниотической жидкости содержится в низких концентрациях. Этому гормону уделяется важная роль в диагностике плацентарной недостаточности.
Другим гормоном плаценты белкового происхождения является хорионический гонодотропин (ХГ). По своему строению и биологическому действию ХГ очень сходен с лютеинизирующим гормоном аденогипофиза. При диссоциации ХГ образуются две субъединицы (а и В). Наиболее точно функцию плаценты отражает В-ХГ. ХГ в крови матери обнаруживают на ранних стадиях беременности, максимальные концентрации этого гормона отмечаются в 8—10 нед беременности (рис. 3.11, б). В ранние сроки беременности ХГ стимулирует стероидогенез в желтом теле яичника, во второй половине — синтез эстрогенов в плаценте. К плоду ХГ переходит в ограниченном количестве, Полагают, что ХГ участвует в механизмах половой дифференцировки плода. На определении ХГ в крови и моче основаны гормональные тесты на беременность: иммунологическая реакция, реакция Ашгейма — Цондека, гормональная реакция на самцах лягушек и др.
Плацента наряду с гипофизом матери и плода продуцирует пролактин. Физиологическая роль плацентарного пролактина сходна с таковой ПЛ гипофиза.
Кроме белковых гормонов, плацента синтезирует половые стероидные гормоны (эстрогены, прогестерон, кортизол).
Эстрогены (эстрадиол, эстрон, эстриол) продуцируются плацентой в возрастающем количестве, при этом наиболее высокие концентрации этих гормонов наблюдаются перед родами (рис. 3.12). Около 90% эстрогенов плаценты представлены эстриолом. Его содержание служит отражением не только функции плаценты, но и состояния плода. Дело в том, что эстриол в плаценте образуется из андрогенов надпочечников плода, поэтому концентрация эстриола в крови матери отражает состояние как плода, так и плаценты. Эти особенности продукции эстриола легли в основу эндокринной теории о фетоплацентарной системе.
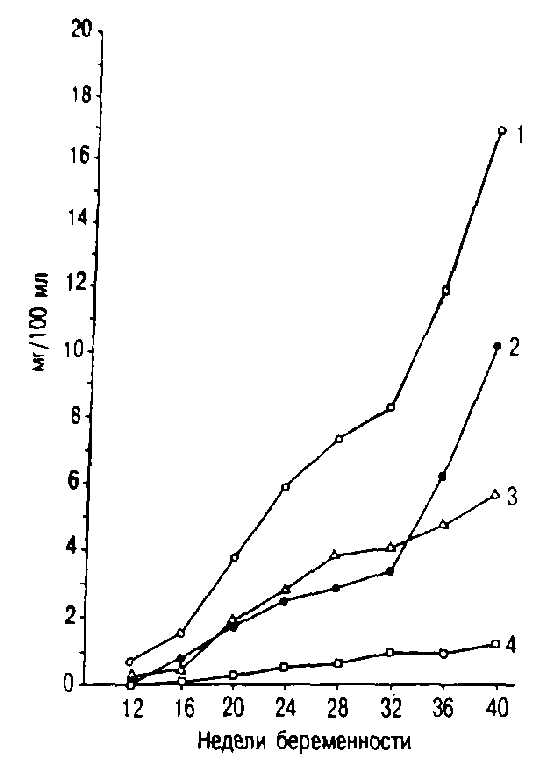
1 — суммарные эстрогены; 2 — эстри-ол; 3 — эстрон; 4 — эстрадиол.
Прогрессирующим увеличением концентрации во время беременности характеризуется также эстрадиол. Многие авторы считают, что именно этому гормону принадлежит решающее значение в подготовке организма беременной к родам.
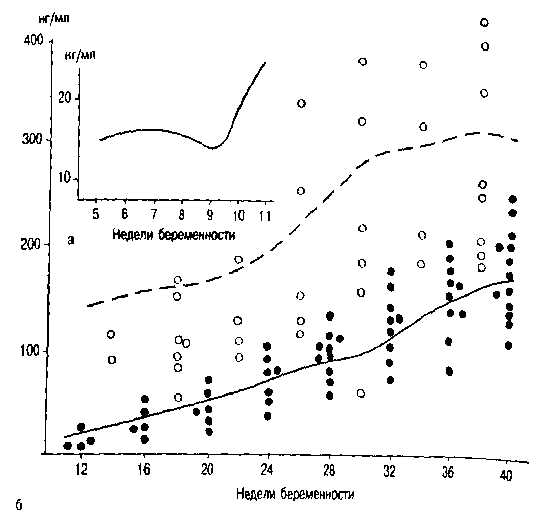
а — продукция прогестерона в начале беременности (5—7 нед); б — продукция этого гормона с 12-й по 40-ю неделю беременности. Пунктирная линия — динамика концентрации прогестерона плацентарного происхождения, сплошная линия — продукция этого гормона надпочечниками матери.
Важное место в эндокринной функции плаценты принадлежит синтезу прогестерона (рис. 3.13). Продукция этого гормона начинается с ранних сроков беременности, однако в течение первых 3 мес основная роль в синтезе прогестерона принадлежит желтому телу и лишь затем эту роль берет на себя плацента. Из плаценты прогестерон поступает в основном в кровоток матери и в значительно меньшей степени в кровоток плода.
В плаценте вырабатывается глюкокортикоидный стероид кортизол. Этот гормон также продуцируется в надпочечниках плода, поэтому концентрация кортизола в крови матери отражает состояние как плода, так и плаценты (фетоплацентарной системы). До настоящего времени открытым остается вопрос о продукции АКТГ и ТТГ плацентой.
Какие гормоны синтезируются фетоплацентарной системой
Клетки трофобласта во время его имплантации в функциональный слой эндометрия дифференцируются в цитотрофобласт и синцитиотрофобласт Оба типа клеток секретируют белковые и пептидные гормоны, а син-цитиотрофобластные — стероидные. Функция гормонов плаценты — это регуляция нормального течения беременности и развития плода. В плаценте синтезируются хорионический гонадотропин, хорионический сомато-маммотропин, плацентарный лактогенный гормон, а также стероиды — эстрогены и прогестерон
Человеческий хорионический гонадотропин. Секреция этого гормона начинается на ранних этапах беременности — примерно с 9-го дня гестации. В течение I триместра беременности концентрация гормона в плазме крови беременной женщины интенсивно нарастает до максимума на 9—12-й неделях (рис. 16.13). Появление гормона в моче женщины является тестом на наличие беременности. Функция хорионического гонадотропина исключительно важна для продолжения беременности. В течение овариаль-ного цикла, если оплодотворения не происходит, прогестерон желтого тела и эстрогены тормозят секрецию лютропина в аденогипофизе, поддерживая сохранение желтого тела. В период снижения концентрации прогестерона и эстрогенов в плазме крови беременной женщины происходит меструация. Во время беременности стабильный уровень концентрации эстрогенов и прогестерона в плазме крови поддерживает нормальное функциональное состояние эндометрия. Это обеспечивается регулирующим эффектом хорионического гонадотропина, который во время беременности действует как плацентарный гонадотропин. С начала II триместра беременности плацента способна самостоятельно продуцировать достаточное количество эстрогенов и прогестерона, при участии которых эндометрий поддерживается в нормальном функциональном состоянии, независимо от секреции гормонов в желтом теле. С этого периода концентрация хорионического гонадотропина в плазме крови беременной женщины постепенно снижается, а желтое тело может функционировать без регулирующего влияния хорионического гонадотропина. В этот период развития плода физиологическая роль гормона заключается в стимуляции секреции клетками Лейдига фетального тестостерона, а клетками надпочечников — де-гидроэпиандростерона. Эти гормоны необходимы для нормального развития наружных половых органов у плода, т. е. становлению фенотипическо-го пола.
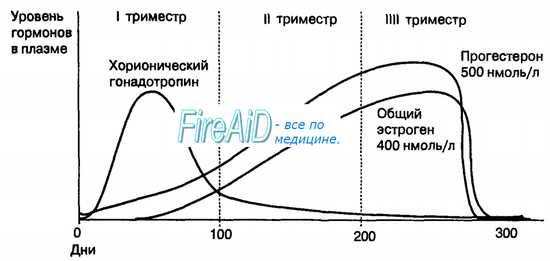
Эстрогены. На протяжении беременности концентрация эстрогенов в плазме крови беременной женщины постоянно увеличивается (см. рис. 16.13). Основным эстрогеном, синтезируемым в плаценте, является эстри-ол, в меньшем количестве синтезируются эстрадиол-17В и эстрон-17В. Например, в поздний период беременности концентрация эстриола в плазме крови женщины составляет 400 нМ/л, а эстрадиола — порядка 50 нМ/л. Плацентарный синтез эстриола обеспечивается 16-альфа-гидрокси-дегидроэпи-андростероном, который поступает только от плода, в то время как источником эстрадиола-17В и эстрона-17В является дегидроэпиандростерон матери и плода. Поэтому нормальная концентрация эстрогенов в моче беременной женщины отражает нормальное функционирование фетоплацентарной единицы. Если снижается функционирование организма плода, то существенно понижается экскреция с мочой эстриола в общем количестве выводимых из организма беременной женщины эстрогенов.
Прогестерон. В течение беременности лютропин аденогипофиза стимулирует рост и гормональную активность материнского желтого тела. Желтое тело секретирует прогестерон, который является наиболее важным гормоном в отношении сохранения жизнеспособности плода во время его развития в полости матки. Примерно с 12-й недели беременности в плазме крови беременной женщины сохраняется постоянный повышенный уровень прогестерона, который достигает концентрации порядка 500 нМоль/л во II и III триместрах беременности (см. рис. 16.13). Гормон существенно снижает сократительные свойства миометрия во время беременности, поскольку тормозит функцию всей системы окситоциновых рецепторов в матке.
К концу беременности, которая продолжается в среднем 9 мес, в крови беременной женщины уровень прогестерона снижается. Происходит «смещение» содержания в плазме крови половых гормонов в сторону эстрогенов, которые резко увеличивают чувствительность миометрия к окситоци-ну. Под действием окситоцина повышается сократительная активность мускулатуры матки. К началу родов возрастает концентрация в амниотической жидкости некоторых простагландинов (F2, E, и Е2), которые также стимулируют родовую деятельность. Эффекты окситоцина и простагландинов на миометрий реализуется через цАМФ, при этом происходит деполяризация мембранного потенциала клеток за счет повышения проницаемости мембран миоцитов для ионов натрия. Повышается также проницаемость мембран миоцитов для ионов кальция, мобилизация которых из внеклеточной среды необходима для начала активной родовой деятельности.
Человеческий хорионический соматомаммотропин. Нормальная концентрация этого гормона в плазме крови беременной женщины является основным индикатором нормального развития плода. Имеется прямая зависимость нарастания концентрации гормона в плазме крови беременной женщины по мере увеличения массы плаценты, однако этот феномен не получил объяснения. По структуре и функции гормон идентичен пролактину аденогипофиза и поэтому имеет другое название — человеческий плацентарный лактоген. Действие гормона на ткани идентично гормону роста, поскольку они имеют одинаковую молекулярную структуру. Гормон стимулирует захват протеинов клетками тканей и усиливает рост тела плода. Этот гормон обладает также липолитическим действием, что позволяет организму беременной женщины использовать запасы жира в ее организме как альтернативный источник энергии при дефиците белков и углеводов. Хорионический соматомаммотропин оказывает антиинсулиновый эффект, что сохраняет уровень глюкозы в крови на необходимом для жизнедеятельности организма плода и матери уровне. На ранних этапах беременности недостаточная секреция гормона в плаценте может стать причиной спонтанного аборта, а на поздних — служит показателем недостаточной секреторной функции плаценты.
Пролактин. В период беременности секреция пролактина в гипофизе женщины прогрессивно увеличивается, превышая в 10 раз его содержание в крови небеременной женщины. Функция гормона проявляется в совместном действии эстрогена и прогестерона на развитие секреторных отделов молочных желез у беременной женщины. Во время всего периода беременности высокая концентрация в плазме крови беременной женщины эстрогенов и прогестерона тормозит в ее молочных железах продукцию молока под влиянием пролактина, хотя лактогенная функция молочных желез формируется на четвертом месяце гестации. Пролактин резко усиливает продукцию молока лишь после снижения в плазме крови эстрогенов и прогестерона, что имеет место непосредственно перед родами. Высокий же уровень пролактина в плазме крови у кормящей женщины тормозит в ранний период после родов начало овариального цикла, что обусловливает аменорею послеродового периода.
Релаксин в I триместре беременности секретируется клетками желтого тела, а в поздние сроки — децидуальными клетками эндометрия. Функция этого гормона в наибольшей степени проявляется в подготовке родовых путей к родам: расслабление тазовых связок и, особенно, шейки матки. В течение беременности гормон снижает возбудимость клеток миометрия и их сократительную способность.
Лабораторная диагностика нарушений репродуктивной системы (часть 2)
Нечаев В.Н., к.б.н.
Определение уровня пролактина
Первым этапом лабораторного обследования лиц обоего пола, страдающих нарушениями репродуктивной функции, по рекомендации ВОЗ является измерение концентрации пролактина (молочного гормона) в сыворотке (плазме) крови. Пролактин не оказывает непосредственного влияния на функциональную активность половых желез, в то же время уровень пролактина в крови четко коррелирует с состоянием гипоталамуса и аденогипофиза. Пролактин регулирует секрецию молока во время лактации. Пролактин является гормоном-антагонистом ФСГ и ЛГ, и при повышении выработки пролактина нарушается гормональная функция яичников и возникает гиперпролактинемическая форма бесплодия. Физиологическая гиперпролактинемия наблюдается у женщин, кормящих грудью. У некормящих женщин повышенный уровень пролактина может быть связан с приемом некоторых лекарственных препаратов, опухолью гипофиза или нарушением его работы. Одним из проявлений гиперпролактинемии является выделение молозива или молока из молочных желез, особенно у нерожавших женщин. Патологические изменения в организме, при повышенных или пониженных уровнях пролактина представлены в таблице 1.
Таблица 1. Патологические изменения в организме при повышенных или пониженных уровнях пролактина
Увеличение концентрации
Неврогенные и психиатрические нарушения, нарушения менструального цикла
Показания к определению:
Женщины детородного периода:
Пролактин имеет довольно выраженный циркадный ритм с максимальным выбросом гормона во время ночного сна. Забор крови рекомендуется проводить утром (8-10 ч), в раннюю фолликулиновую фазу цикла (у женщин с регулярным циклом) и в спокойной обстановке. Для исключения случайного повышения уровня пролактина в ответ на стресс (взятие крови) желательно 2-3-кратное исследование.
Современные ИФА тест-системы на определение ФСГ и ЛГ основаны на использовании монклональных антител, которые не имеют перекрестной реакции с близкородственными гормонами ТТГ и ХГЧ.
В таблице 11 приведены концентрации ХГч в сыворотке крови женщины в динамике физиологической беременности.
Какие гормоны синтезируются фетоплацентарной системой
ФГУ Эндокринологический научный центр Минздравсоцразвития России, Москва
ФГБУ «Эндокринологический научный центр» Минздрава России, Москва, Россия, 117036; ФГБОУ ВО «Первый МГМУ им. И.М. Сеченова»
Медико-генетическое отделение Московского областного НИИ акушерства и гинекологии
ГБОУ ВПО «Первый Московский государственный медицинский университет им. И.М. Сеченова» Минздрава России, Москва, Россия
Эндокринные аспекты функционирования фетоплацентарного комплекса (обзор литературы)
Журнал: Проблемы репродукции. 2017;23(1): 15-24
Григорян О. Р., Михеев Р. К., Волеводз Дир., Андреева Е. Н., Мельниченко Г. А., Дедов И. И. Эндокринные аспекты функционирования фетоплацентарного комплекса (обзор литературы). Проблемы репродукции. 2017;23(1):15-24.
Grigorian O R, Mikheev R K, Volevodz N N, Andreeva E N, Melnichenko G A, Dedov I I. Endocrine aspects of fetoplacental complex function (a review). Russian Journal of Human Reproduction. 2017;23(1):15-24.
https://doi.org/10.17116/repro201723115-24
ФГУ Эндокринологический научный центр Минздравсоцразвития России, Москва
Эндокринная система плода начинает функционировать на самых ранних сроках развития, находясь под влиянием гормонов и других биологически активных веществ, продуцируемых организмом матери и плацентой. Роль собственной эндокринной системы фетоплацентарного комплекса, имеющего сложную регуляцию, прогрессивно возрастает с увеличением срока беременности, обеспечивая подготовку плода к постнатальной жизни.
ФГУ Эндокринологический научный центр Минздравсоцразвития России, Москва
ФГБУ «Эндокринологический научный центр» Минздрава России, Москва, Россия, 117036; ФГБОУ ВО «Первый МГМУ им. И.М. Сеченова»
Медико-генетическое отделение Московского областного НИИ акушерства и гинекологии
ГБОУ ВПО «Первый Московский государственный медицинский университет им. И.М. Сеченова» Минздрава России, Москва, Россия
Эндокринная система плода начинает функционировать на самых ранних сроках развития. Она находится под влиянием гормонов и других биологически активных веществ, продуцируемых организмом матери и плацентой. Роль собственной эндокринной системы прогрессивно возрастает с увеличением срока беременности, что обеспечивает подготовку плода к постнатальной жизни [1].
Гормоны раннего срока беременности
Уже в начале имплантации эмбрион активно продуцирует хорионический гонадотропин человека (чХГ), который может определяться в крови матери с 8-го дня после овуляции. Уникальная роль этого гормона состоит в поддержании активности желтого тела, которое продуцирует прогестерон, обеспечивающий адекватное беременности морфофункциональное состояние эндометрия. В процессе имплантации зародыш продолжает продуцировать чХГ и другие белки беременности, а также начинает секретировать стероидные гормоны.
Децидуальная оболочка, представляющая собой модифицированный эндометрий периода беременности, является местом продукции материнских стероидов и белков, необходимых для поддержания беременности и защиты плода от иммуноопосредованного отторжения. В частности, кортизол децидуального происхождения совместно с вырабатываемыми зародышем чХГ и прогестероном подавляет направленный против зародыша иммунный ответ организма матери. Помимо этого, децидуальная оболочка продуцирует пролактин, белок, связывающий инсулиноподобный фактор роста и другие белки [2].
Эндокринная функция плаценты
Плацента играет первостепенную роль в создании баланса между ростом и развитием плода и гомеостазом матери. Дыхание, питание и выделительная функция плода обеспечиваются плацентой. В каком-то смысле функционирование плаценты напоминает работу оси гипоталамус — гипофиз — орган-мишень с активирующими и ингибирующими механизмами обратной связи. Однако в плаценте нет прямых нервных афферентных путей, что имеет место в случае зрелой гипоталамо-гипофизарной системы, поэтому точные механизмы, ответственные за регуляцию выработки плацентой гормонов, аналогичных гормонам гипоталамуса, неизвестны.
Изменения концентрации гормонов в крови матери чрезвычайно важны для модулирования метаболических и иммунных изменений, необходимых для нормального течения беременности. Плод и плацента секретируют стероиды и белки, поступающие в кровоток матери и влияющие на выработку материнских гормонов. Количество и источники (плод или плацента) продукции гормонов беременности очень существенно изменяются с течением беременности.
Плацента, как орган активного стероидогенеза, характеризуется высокой ароматазной, сульфатазной активностью и активностью 11β-гидроксистероиддегидрогеназы 2-го типа, но при этом не обладает 17α-гидроксилазной и 17/20-лиазной активностью. Кроме того, плацента — главный источник прогестерона во время беременности. Холестерин для продукции стероидов децидуальной оболочкой и плацентой поступает в основном от матери в форме липопротеидов низкой плотности (ЛПНП) [3].
Прогестерон обеспечивает нормальную имплантацию, поддержание беременности и нормальные роды: стимулирует децидуализацию эндометрия; подавляет сокращение гладкомышечных клеток; снижает продукцию простагландинов; подавляет иммунный ответ, подобный реакции отторжения трансплантата. Предполагается, что вместе с чХГ и кортизолом, продуцируемым децидуальной оболочкой, прогестерон подавляет опосредованную Т-лимфоцитами реакцию отторжения, обеспечивая иммунную толерантность к имплантированному зародышу и развивающейся плаценте. Прогестерон также используется в качестве субстрата для образования глюкокортикоидов (таких как кортизол) и минералокортикоидов (альдостерон) в надпочечниках плода. Эта важная функция прогестерона является следствием дефицита 3β-гидроксистероиддегидрогеназы (одного из ключевых ферментов стероидогенеза) в надпочечниках плода [4].
В ранние сроки беременности эстрон в основном продуцируется органами матери (яичники, надпочечники, периферическая конверсия). Затем основным источником эстрона (за счет конверсии циркулирующего дегидроэпиандростерона матери и плода) становится плацента.
В табл. 1 представлены гормоны и биологически активные вещества, продуцируемые фетоплацентарным комплексом. Основная масса этих гормонов во время беременности синтезируется в плаценте.

Гипоталамус и гипофиз
Гипоталамус формируется в течение первых недель жизни плода, достигая хорошего развития к 12-й неделе. Большинство гипоталамических рилизинг-гормонов, а также дофамин, норэпинефрин и соматостатин определяются на 6—8-й неделе. Передний гипофиз развивается из кармана Ратке и с 7-й недели способен секретировать гормон роста (ГР), фолликулостимулирующий гормон (ФСГ), лютеинизирующий гормон (ЛГ) и адренокортикотропный гормон (АКТГ). В то же время гипоталамо-гипофизарная портальная сосудистая система, доставляющая рилизинг-гормоны от гипоталамуса к гипофизу, развивается только к 18-й неделе гестации.
Во время беременности гипофиз матери увеличивается в 2—3 раза, давая гиперинтенсивный сигнал при магнитно-резонансной томографии (МРТ) [5]. Увеличение обусловлено, главным образом, гипертрофией и гиперплазией лактотрофов под действием эстрогенов, так что параллельно с течением беременности возрастает уровень пролактина. Количество гонадотрофов уменьшается, а кортикотрофов и тиреотрофов остается неизменным. Соматотрофы подавляются по механизму отрицательной обратной связи за счет продукции плацентарного соматотропина и могут функционировать, как лактотрофы. Размер гипофиза, по данным МРТ, к концу беременности и в первые дни после родов может достигать 12 мм, однако быстро уменьшается, возвращаясь к норме в течение полугода [6—8].
Плацентарный гормон роста (ПГР), синтезируемый синцитиотрофобластом, отличается от гипофизарного соматотропина на 13 аминокислот. Механизмы регуляции образования плацентарного соматотропина неизвестны, его концентрация увеличивается до 10—20 мкг/л в течение второй половины беременности. Он оказывает сходное с гипофизарным соматотропином влияние на углеводный и жировой обмен, на рост, однако обладает меньшей лактогенной активностью. Уровень инсулиноподобного фактора роста-1 (ИФР-1), образование которого стимулируется соматотропином и который опосредует практически все периферические эффекты ГР, повышается во второй половине беременности, чем обусловлены акромегалоидные изменения внешности беременной женщины. Физиологическое значение изменений уровня и источника ГР во время беременности неизвестно [9].
Кортиколиберин синтезируется в основном цитотрофобластом плаценты и децидуальной оболочкой, в течение беременности его уровень увеличивается в сотни раз (табл. 2). Он стимулирует продукцию АКТГ как плацентой, так и гипофизом, вследствие чего уровень АКТГ возрастает с течением беременности и в родах. Соотношение гипофизарного и плацентарного АКТГ неизвестно. Продукция плацентарного АКТГ не подавляется дексаметазоном. Уровень кортизола во время беременности также прогрессивно нарастает с пиковым повышением во время родов. Одновременно под действием эстрогенов увеличивается концентрация кортизолсвязывающего глобулина, вследствие чего концентрация кортизола к концу беременности возрастает в 2—3 раза. Также в 2—3 раза увеличивается уровень «свободного» кортизола и его экскреция с мочой, что существенно затрудняет диагностику и лечение заболеваний гипофизарно-надпочечниковой системы во время беременности [10] (см. табл. 1, 2).

Во время беременности отмечается низкий уровень вазопрессина в крови матери. Предполагается, что он не играет важной роли в поддержании беременности. Содержание окситоцина также сохраняется на низком уровне, повышаясь лишь во время родов.
Щитовидная железа
Продукция гормонов щитовидной железы (трийодтиронин — Т3 и тироксин — Т4) контролируется гипофизом, который синтезирует тиреотропный гормон (ТТГ) под действием гипоталамического тиролиберина — классическая система, регулируемая по принципу обратной связи. Циркулирующие в крови Т3 и Т4 в основном связаны с транспортными белками, главный из которых — тироксинсвязывающий глобулин. На периферии гормоны щитовидной железы дейодируются, и биологически активный Т3 активно поступает в клетку.
Захват йода и формирование фолликулов в щитовидной железе плода начинаются с 11-й недели гестации, однако продукция гормонов щитовидной железы плодом определяется только со второй половины беременности [11]. Перенос гормонов щитовидной железы через плаценту осуществляется с помощью транстиретина. Поступление материнских гормонов щитовидной железы к плоду жестко регулируется дейодиназами плаценты, однако даже к моменту родов 30% тироксина и трийодтиронина плода имеют материнское происхождение [12—14]. Учитывая, что йод — обязательный компонент гормонов щитовидной железы, содержание йода в организме матери — чрезвычайно важный параметр, определяющий развитие плода, особенно в условиях возрастающего в период беременности клиренса йода. Поддержание эутиреоза матери во время беременности совершенно необходимо для нормального роста и развития плода, особенно для созревания нервной системы. Даже незначительные изменения тиреоидного статуса беременной и кормящей матери могут серьезно навредить плоду или ребенку [15].
Плацента мало проницаема для ТТГ и Т4, таким образом гипоталамо-гипофизарно-тиреоидная ось плода развивается и функционирует относительно независимо. Уровень ТТГ и Т4 в крови плода остается низким до середины беременности, с 24—28-й недели уровень Т4 и уровень биологически неактивного реверсивного Т3 возрастают, одновременно достигает пика концентрация ТТГ. Во время родов происходит резкий выброс ТТГ и гормонов щитовидной железы с развитием относительного гипертиреоза, что, по всей видимости, необходимо для терморегуляции в новых внеутробных условиях.
Тиреоидный статус матери существенно изменяется во время беременности. Во-первых, чХГ обладает ТТГ-подобной активностью, так что резкое повышение уровня чХГ в I триместре беременности может приводить к повышению продукции гормонов щитовидной железы и снижению уровня ТТГ. Во-вторых, физиологическая гиперэстрогения обусловливает повышение уровня тироксинсвязывающего глобулина, что приводит к физиологическому повышению уровня Т4 на 50%. Во II и III триместрах чХГ-индуцированная стимуляция щитовидной железы снижается, в то время как уровень Т4 в крови матери остается повышенным — у верхней границы нормы для небеременных женщин или выше, а уровень ТТГ — у нижней границы нормы небеременных [16, 17]. Во время беременности повышается почечный клиренс йода, объем циркулирующей крови матери, в то время как материнские гормоны щитовидной железы захватываются плацентой для передачи плоду и метаболизма. Вследствие повышенного запроса щитовидная железа матери гиперплазируется, увеличиваются ее размеры и васкуляризация. Развитие истинного зоба зависит от поступления йода и селена, а также от воздействия других способствующих формированию зоба факторов. При достаточном потреблении йода во время беременности поддерживается эутиреоз. Уровень Т3 и Т4 повышается, однако гипертиреоз не развивается, благодаря тому, что одновременно возрастает уровень тироксинсвязывающего глобулина [18].
Сывороточная концентрация свободных гормонов щитовидной железы и ТТГ должна оставаться в пределах физиологической нормы, за исключением короткого промежутка, когда продукция ТТГ подавляется вследствие стимулирующей активности чХГ. В то же время референсные пределы для гормонов щитовидной железы в обычном состоянии не годятся для оценки тиреоидного статуса во время беременности. Более того, повышенный уровень тироксинсвязывающего глобулина сказывается на результатах лабораторного анализа на уровень свободных и связанных гормонов щитовидной железы. Таким образом, во время беременности высока вероятность неверной интерпретации результатов исследования функции щитовидной железы [19, 20].
Сложность оценки результатов функции щитовидной железы при беременности усугубляется неадекватной унификацией нормативных показателей, так как они разнятся у разных популяций (и зависят, в частности, от потребления йода), а кроме того, зависят от метода лабораторного исследования. Следовательно, каждая лаборатория должна представлять свои нормативные значения. Более того, существуют индивидуальные генетически детерминированные «установочные точки» уровня тиреоидных гормонов, колебания вокруг которых происходят в достаточно узких пределах, в том числе во время беременности, поэтому более информативна оценка динамики уровня ТТГ и тиреоидных гормонов в течение беременности, чем сравнение их единичных измерений с нормативными по триместру показателями. В заключение следует отметить, что для оценки функции щитовидной железы во время беременности врачу следует использовать все доступные лабораторные тесты и соблюдать большую осторожность при их интерпретации, так как неверное заключение может привести к необратимым нарушениям развития нервной системы плода [16].
Во время беременности следует использовать как минимум два из трех приведенных выше тестов по оценке уровня Т3 и Т4 с применением референсных значений по триместрам.
Надпочечники
Морфология надпочечников плода уникальна. К середине беременности их размеры непропорционально велики — превышают размер почек плода, в то же время к моменту рождения они принимают свойственные для взрослого размеры и массу — около 10 г. Основную часть — 80—85% надпочечника плода составляет внутренняя фетальная зона, которая обусловливает невероятные размеры и функциональную активность органа во внутриутробном периоде. Фетальная зона быстро регрессирует после родов, полностью исчезая к годовалому возрасту, вследствие чего размер надпочечников уменьшается в 2 раза. Помимо фетальной зоны в надпочечнике плода наружный слой клеток формирует кору надпочечника (зрелая зона). Фетальная зона существенно отличается от зрелой как гистологически, так и функционально. Так, в фетальной зоне содержится мало 3β-гидроксистероиддегидрогеназы, в связи с чем она продуцирует в основном С-19 стероиды (главным образом дегидроэпиандростендион), в то время как кора секретирует кортизол. Надпочечники зрелого плода секретируют большое количество стероидных гормонов, около 200 мг в сутки — скорость надпочечникового стероидогенеза плода приблизительно в 5 раз выше, чем у взрослого в состоянии покоя. Образуемые С-19 стероиды используются в качестве субстрата для синтеза эстрогенов в плаценте. Клинические данные подтверждают, что главным трофическим фактором для надпочечников плода является АКТГ.
Надпочечники матери существенно не изменяются во время беременности. Уровень надпочечниковых стероидов в крови матери прогрессивно увеличивается с развитием беременности. В то же время повышение уровня кортизола связано в основном с увеличением содержания кортизолсвязывающего глобулина. Уровень кортизола в плазме и в моче увеличивается приблизительно в 2—3 раза, однако клинических проявлений гиперкортицизма нет. Уровень ренина и ангиотензина также значительно повышается, что ведет к увеличению концентрации ангиотензина-II и альдостерона.
Главным лимитирующим фактором для продукции гормонов в надпочечниках плода является доступность холестерина ЛПНП — основного субстрата стероидогенеза. Показано высокое сродство надпочечников плода к ЛПНП, но низкая способность к связыванию этих липопротеидов, повышающаяся под действием АКТГ. Последний регулирует продукцию гормонов в обеих зонах надпочечников плода. В начале II триместра уменьшается активность рецепторов АКТГ в фетальной зоне, в это время возрастает влияние других факторов, таких как чХГ. Примечательно, что уровень АКТГ во время беременности не коррелирует с динамикой размеров и функциональной активностью фетальных надпочечников, в том числе с резким повышением уровня стероидов, типичным для III триместра беременности. Гипофизарный АКТГ плода определяется с 9-й недели гестации, уровень его неуклонно растет до 20-й недели, затем остается стабильным до 34-й недели, после чего значительно снижается к моменту родов [21].
Плацента является важным корегулятором функции надпочечников плода за счет продукции кортикотропин-рилизинг-гормона, плацентарного чХГ, прогестерона и эстрадиола. В опытах invitro и invivo показано наличие рецепторов к чХГ в фетальной зоне, под действием этого гормона увеличивается продукция дегидроэпиандростерона. Однако после 20-й недели гестации основным регулятором фетальной зоны становится АКТГ. Плацентарный кортиколиберин во взаимодействии с плацентарным АКТГ усиливает эффекты гипоталамуса и гипофиза плода, что приводит к резкому повышению уровня фетальных глюкокортикоидов в поздние сроки III триместра для обеспечения роста и созревания органов и систем к моменту родов [22].
Плацентарный прогестерон подавляет переход D5-стероидов в D4-форму в фетальной зоне надпочечников плода. Это еще один механизм, объясняющий дефицит 3β-гидроксистероиддегидрогеназы в надпочечниках плода. Продуцируемый плацентой эстрадиол модифицирует образование и метаболизм кортикостероидов и прогестерона. Invivo плацента регулирует взаимопревращения материнских кортизола и кортизона, а также продукцию АКТГ гипофизом плода. Этот эффект опосредуется изменением транспорта материнского кортизола плоду через плаценту. С прогрессированием беременности надпочечники плода становятся более чувствительными к циркулирующему АКТГ, между 32-й и 36-й неделей масса надпочечников плода увеличивается. Факторы роста модулируют пути образования надпочечниковых стероидов в направлении, характерном для взрослых [23].
Инсулин и метаболический гомеостаз
В начале беременности толерантность к глюкозе и чувствительность периферических тканей к инсулину обычно остаются в пределах общепопуляционной нормы. Чувствительность к инсулину во время беременности может изменяться в зависимости от исходного метаболического статуса беременной женщины. Так, выраженность исходной инсулинорезистентности может уменьшаться, в то время как слишком высокая чувствительность к инсулину до беременности также может снижаться в период беременности. С течением беременности выброс инсулина в ответ на употребление углеводов усиливается, в то время как толерантность к глюкозе изменяется незначительно. Баланс поддерживается за счет прогрессивного увеличения базальной и постпрандиальной концентрации инсулина в ответ на возрастающую инсулинорезистентность. Ближе к концу беременности базальная и средняя суточная концентрация инсулина может увеличиваться в 2 раза по сравнению с уровнем до беременности, а первая и вторая фазы секреции инсулина возрастают в 3 раза. C нарастанием инсулинорезистентности увеличивается концентрация нутриентов (глюкоза, жиры и аминокислоты), доступных для плода [24, 25].
Продукция глюкозы печенью увеличивается приблизительно на 30%. Даже несмотря на это, концентрация глюкозы натощак снижается, вероятно, за счет фетоплацентарной утилизации. Потребности в глюкозе плода и плаценты могут достигать 150 г в сутки в III триместре. Голодание во время беременности приводит к быстрому истощению запасов гликогена в печени матери, через 12 ч происходит переход с метаболизма углеводов на повышенный катаболизм жиров, интенсивный липолиз и образование кетонов.
Физиологическим изменениям во время беременности подвержен и обмен жиров. Характерно повышение уровня холестерина, триглицеридов, свободных жирных кислот и липопротеидов. Гипертриглицеридемия обусловлена эффектами эстрогенов и инсулинорезистентностью. На молекулярном уровне взаимосвязь между обменом жиров и инсулинорезистентностью опосредуется цитокинами. Так, содержание фактора некроза опухоли-α (ФНО-α) в крови матери, в противоположность плацентарным гормонам, жестко коррелирует с уровнем чувствительности к инсулину. Продуцируемый плацентой ФНО-α может играть важную роль в снижении чувствительности к инсулину во время беременности через влияние на пострецепторный инсулиновый сигнальный каскад. Также инсулинорезистентность усиливается под действием плацентарного соматотропина [26].
Транспорт глюкозы через плаценту прямо пропорционален уровню глюкозы в крови матери, в то же время плацента способна резко усиливать поступление глюкозы к плоду даже в отсутствие гипергликемии у матери. Фетоплацентарные ткани используют глюкозу в качестве основного источника энергии, в связи с чем транспорт глюкозы через плаценту количественно преобладает над транспортом всех других веществ. В случае недостаточности поступления глюкозы вследствие гипогликемии матери или плацентарной недостаточности плод может использовать альтернативные источники энергии, такие как кетоновые тела, образующиеся при бета-окислении жирных кислот.
Инсулин не переходит через плаценту, так что плод достаточно рано начинает продуцировать инсулин самостоятельно. Секреция инсулина плодом зависит как от среднего уровня глюкозы, так и от пиковых его колебаний. Фетальный инсулин — важный фактор роста плода.
В последнее время все больше внимания уделяется обмену липидов во время беременности, так как увеличивается количество страдающих ожирением женщин, с крупным к сроку гестации плодом, несмотря на нормальную толерантность к глюкозе. Предполагается возможность прямой передачи избытка липидов от матери плоду, что ведет к его ожирению [27].
Паращитовидные железы и обмен кальция
Количество кальция, поступающего к плоду, регулируется плацентой за счет изменения транспорта кальция от матери. Изменения в организме матери направлены на обеспечение роста костей плода: запасание кальция за счет повышения его потребления с пищей, удвоения скорости всасывания в тонкой кишке к 12-й неделе гестации, повышения уровня 1,25-дигидроксивитамина D3 и уровня паратгормона. С течением беременности содержание кальция и фосфора в организме плода неуклонно нарастает за счет активного транспорта через плаценту. Более того, к моменту родов уровень общего и ионизированного кальция и фосфора в крови плода превышает аналогичные показатели матери. На самом деле, уровень общего кальция и фосфора в крови матери во время беременности снижается, однако концентрация ионизированного кальция остается неизмененной. Примечательно, что удвоение скорости интестинальной абсорбции кальция в I триместре беременности превышает потребности плода в это время, так что избыток кальция либо запасается в скелете матери, либо выводится с мочой. Кроме того, повышение суточной экскреции кальция с мочой обусловлено возрастанием уровня кальцитонина во время беременности, что увеличивает риск развития уролитиаза во время беременности. С другой стороны, запасание кальция в скелете матери в I триместре может быть направлено на обеспечение возрастающих потребностей в минерализации костей плода на более поздних сроках беременности.
Минерализация костей матери также увеличивается к моменту родов, что позволяет обеспечивать потребности в кальции новорожденного. Приблизительно с 10—12 нед гестации паращитовидные железы плода секретируют паратиреоидный гормон. Во время беременности его концентрация в крови плода низка, однако существенно возрастает после родов. В противоположность неизменному уровню кальцитонина в крови матери в течение беременности щитовидная железа плода продуцирует много кальцитонина. Паратиреоидный гормон не проходит через плаценту и, таким образом, изменения содержания кальция в крови плода наиболее вероятно связаны с колебаниями выработки паратиреоидного гормона и кальцитонина самим плодом и соответствуют потребностям роста костей плода. В то же время предполагается, что на обмен кальция могут влиять и другие ассоциированные с беременностью гормоны, такие как половые стероиды, пролактин, плацентарный лактоген и ИФР-1 [28].
При использовании современных методов анализа уровень интактного паратиреоидного гормона матери остается постоянным в течение беременности. В то же время в нескольких исследованиях показано повышение уровня некоторых предшественников и метаболитов паратиреоидного гормона.
Таким образом, характерные для беременности изменения кальциевого обмена могут привести к неверной интерпретации физиологических колебаний уровня связывающих белков, концентрации кальция, суточной экскреции кальция с мочой и уровня витамина D. После родов уровень кальция и фосфора в крови новорожденного уменьшается. В течение 48 ч после родов уровень паратиреоидного гормона возрастает. В течение нескольких следующих дней уровень кальция и фосфора возрастает, что зависит от их содержания в материнском молоке [29—31].
Резюмируя приведенные выше данные, можно сделать следующие практические замечания:
— исследование глюкокортикоидного статуса матери затруднено, так как уровень кортизола во время беременности физиологически повышен за счет увеличения содержания кортизолсвязывающего глобулина;
— измерение уровня свободного кортизола мочи и слюны более информативно, хотя эти показатели также повышаются во время беременности;
— во время беременности у матери развивается относительная инсулинорезистентность, что направлено на обеспечение плода глюкозой и жирными кислотами;
— оценка метаболизма кальция во время беременности должна проводиться с учетом физиологических изменений содержания связывающих белков, концентрации кальция, суточной экскреции кальция с мочой и уровня витамина D;
— чХГ обладает ТТГ-подобной активностью;
— продукция тироксинсвязывающего глобулина и объем циркулирующей крови, в котором распределен тироксин, во время беременности увеличиваются, что приводит к повышенной продукции тироксина для установления нового равновесного состояния;
— недостаток йода и селена в организме матери, а также поступление зобогенных веществ во время беременности могут привести к развитию клинически значимого зоба;
— следует проявлять осторожность при оценке тиреоидного статуса во время беременности, принимая во внимание специфические по сроку гестации референсные значения, учитывая больше индивидуальные колебания уровня гормонов, а не популяционный разброс, а также влияние множества связанных с беременностью изменений на метаболизм гормонов и влияние связывающих белков на биохимические реакции, лежащие в основе лабораторных тестов;
— необходимо использовать все доступные лабораторные методы исследования для оценки функции щитовидной железы во время беременности во избежание неверной интерпретации отдельных тестов.
Основные направления дальнейших исследований:
— необходимо продолжить исследования физиологических эндокринных изменений периода беременности, чтобы более уверенно дифференцировать патологические состояния от нормы;
— разработка новых методов оценки эндокринных функций во время беременности;
— решение указанных проблем возможно только во взаимодействии клиницистов и медицинских биохимиков.
Гормоны аденогипофиза плода
Уже к 8—10-й фетальной неделе определяются характерные для аденогипофиза типы клеток, и к 12-й неделе из аденогипофиза плода можно выделить все гормоны, которые продуцирует гипофиз взрослого человека. На 8—10-й неделе беременности уже присутствуют и гипоталамические рилизинг-гормоны ТРГ, ГнРГ и соматостатин. Непосредственные циркуляторные связи между гипоталамусом и гипофизом формируются позже, капиллярная сеть становится заметной только в 16-й неделе. Роль гипофиза плода в органогенезе различных органов-мишеней во время I триместра беременности кажется незначительной. До 20-й недели беременности ни один из гипофизарных гормонов не секретируется в кровоток плода в больших количествах. Даже Г.Р. не является столь необходимым. Напротив, неопределяемые концентрации ГР в этот период являются показателем нормального развития плода к рождению. Развитие половых желез и надпочечников в I триместре беременности происходит не под влиянием гипофизарных гормонов, а под прямым влиянием чХГ. Во время II триместра беременности происходит значительное повышение секреции всех гипофизарных гормонов и в то же время становление гипофизарной портальной системы. В это время наблюдается существенное повышение продукции ГР и увеличение концентрации ТТГ в сыворотке крови плода, что сочетается с повышением захвата йода щитовидной железой плода. Продукция гонадотропинов также увеличивается, причем содержание ФСГ повышается у девочек в 2 раза больше, чем у мальчиков. Гонадотропины плода не оказывают непосредственного влияния на раннее развитие половых желез; однако необходимы для их дифференцировки и нормального формирования наружных гениталий. Во II триместре беременности концентрация АКТГ значительно повышается, что отражает возрастающее прямое влияние этого гормона на формирование и дифференцировку надпочечников плода. Как было показано, у плодов с анэнцефалией отмечается атрофия надпочечников после 20-й недели беременности. После 20-й недели также увеличивается фетальная продукция пролактина, однако функциональное значение этого гормона — если есть какое-либо — остается неизвестным. В течение III триместра беременности происходит становление функциональных взаимодействий между гипоталамусом и гипофизом, что приводит к снижению концентрации всех гипофизарных гормонов, кроме пролактина [2, 9, 26].
Гормоны нейрогипофиза плода
Показано, что вазопрессин и окситоцин начинают определяться в задней доле гипофиза к 12—18-й неделе беременности, что совпадает по времени с развитием гипоталамических структур, отвечающих за их продукцию, — супраоптического и паравентрикулярного ядер соответственно. Содержание гормонов в нейрогипофизе постепенно повышается к родам, обратной регуляции секреции гормонов не выявлено. Во время родов содержание окситоцина в пупочной артерии выше, чем в пупочной вене. Это позволяет предположить, что нейрогипофиз плода может участвовать в инициации или поддержании родовой деятельности [19, 32].
Соматотропная активность во время беременности
Семейство генов ГР человека представлено 5 генами, кодирующими гипофизарный гормон роста (ГР-N), плацентарный вариант гормона роста (ГР-V) и хорионические соматотропины (ХС-A, ХС-B, ХС-L). Эти гены локализованы на длинном плече 17-й хромосомы (q22–q24), предполагается, что их множественность является следствием дупликаций [32].
Гормональная функция плаценты характеризуется постепенным повышением уровня хорионического соматотропина (ГР-V) с течением беременности, что отражает увеличение массы синцитиотрофобласта. К концу беременности суточная продукция холестерина достигает 1—3 г/сут. Однако физиологическая роль холестерина изучена плохо [33]. ПГР является продуктом экспрессии гена GH-V и синтезируется синцитиотрофобластом. ПГР-V отличается от гипофизарного ГР-N последовательностью из 13 аминокислот и, кроме того, имеет один сайт гликозилирования. ПГР обладает большей соматотропной активностью и меньшей лактотропной. Начиная с 12—20-й недели до конца беременности ПГР постепенно замещает гипофизарный ГР в кровотоке матери, уровень которого снижается до лабораторно неопределяемого. ПГР секретируется не дискретными порциями, а непрерывно. Такой тип секреции важен для приспособления организма матери к беременности, в первую очередь в плане контроля уровня материнского ИФР-1. Секреция ПГР зависит от уровня глюкозы. Снижение уровня ПГР ассоциировано с задержкой роста плода. Плацентарный гормон — один из гормонов трофобласта, обеспечивающих адаптацию метаболизма матери к беременности, снабжение плода нутриентами без существенных вариаций уровня глюкозы в крови матери. Результаты недавно проведенных исследований показывают, что на ворсинах хориона имеются рецепторы ПГР, а трофобласт вне ворсин продуцирует этот гормон, что подтверждает непосредственное его воздействие на развитие плаценты через ауто- и паракринные механизмы [32, 34, 35].
Регуляция продукции ПГР существенно отличается от регуляции гипофизарного Г.Р. Соматолиберин не оказывает влияния на его уровень. В опытах invitroпоказано, что продукция ПГР снижается под действием глюкозы. Эти данные получили подтверждение в эксперименте invivo: во время проведения орального глюкозотолерантного теста концентрация ПГР у больных гестационным диабетом снижается, в то время как уровень чХГ, хорионического плацентарного лактогена и лептина остается неизмененным [36]. Во время эугликемического гиперинсулинемического клэмп-теста у больных инсулинзависимым сахарным диабетом беременных уровень ПГР увеличивается в среднем на 27%. Это говорит о том, что синцитиотрофобласт, находящийся в прямом контакте с кровью матери и экспрессирующий главный транспортер глюкозы, Glut1, отвечает на быстрые колебания уровня глюкозы в крови матери через изменение секреции ПГР.
Уровень ПГР-V в крови матери одинаков при анэнцефалии плода и при его нормальном развитии, что свидетельствует о независимости продукции ПГР от гипоталамо-гипофизарной оси плода [37]. У женщин с делецией гена CS-A-B-GHV с отсутствием хорионического пролактина наблюдается нормальная беременность и рождение здорового ребенка. Однако при этом отмечается повышение экспрессии гипофизарного ГР-N в плаценте [38], что свидетельствует о способности плаценты компенсаторно увеличивать продукцию гормонов, обладающих аналогичной соматогенной активностью. L. Ghizzoni и соавт. [39] наблюдали 4 новорожденных с делецией генов GH-N, GH-V, CS-A и CS-L, у которых наблюдалось укорочение туловища. Однако жизнеспособность плода не зависела от плацентарного синтеза ГР.
Рост плода на поздних сроках беременности напрямую зависит от обеспечения организма матери питательными веществами, ПГР — один из гормональных механизмов, обеспечивающих адаптацию организма матери к катаболической фазе. Уровень инсулиноподобных факторов роста, а также общего и свободного ПГР снижается в случаях внутриутробной задержки роста плода [40]. При этом в разы снижается экспрессия мРНК ГР-V клетками на единицу площади плаценты. Таким образом, при внутриутробной задержке роста плода снижение уровня ГР в крови матер