какие гормоны регулируют реабсорбцию воды
Какие гормоны регулируют реабсорбцию воды
Точная регуляция объемов жидких сред и концентрации растворенных в них веществ требует от почек выделения воды и различных веществ с различной интенсивностью, иногда независимо друг от друга. Например, при увеличении поступления калия почки должны выделять его более интенсивно, поддерживая при этом выделение натрия и других электролитов на нормальном уровне. Аналогично при изменении поступления натрия почки должны соответствующим образом отрегулировать его выделение без ущерба для других электролитов. В организме задача избирательной реабсорбции электролитов и воды выполняется с помощью нескольких гормонов.
В таблице выше приведены сводные данные по некоторым наиболее важным гормонам, регулирующим канальцевую реабсорбцию с учетом места их действия в канальцевой системе, а также влияния на выделение воды и растворенных веществ. Действие некоторых гормонов подробно рассмотрено в отдельных статьях на сайте (просим вас пользоваться формой поиска выше). Далее кратко рассмотрим их влияние на канальцы.
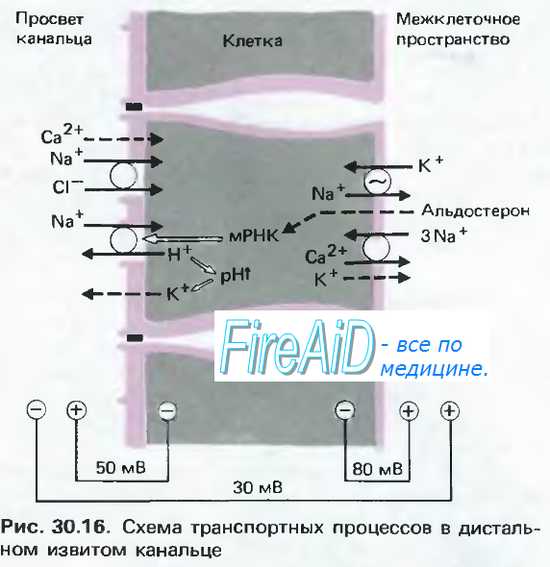
а) Альдостерон увеличивает реабсорбцию натрия и секрецию калия. Альдостерон, выделяемый клубочковой зоной коры надпочечников, является важным регулятором реабсорбции натрия и секреции калия почечными канальцами. Клетками-мишенями алъдостерона являются главные клетки корковых собирательных трубочек. Механизм, благодаря которому альдостерон увеличивает реабсорбцию натрия и в то же время повышает секрецию калия, заключается в активации натрий-калиевой АТФ-азы на базолатеральной мембране эпителиоцитов. Альдостерон также увеличивает проницаемость апикальной мембраны для натрия. Механизмы действия альдостерона на клеточном уровне обсуждаются в отдельной статье на сайте (просим вас пользоваться формой поиска выше).
При отсутствии альдостерона, связанном с повреждением или нарушением функции надпочечников (например, при болезни Аддисона), организм теряет натрий и задерживает калий, и наоборот, его избыточная секреция, например при опухолях надпочечников (синдром Кона), приводит к задержке натрия и истощению запасов калия. Хотя для повседневной регуляции содержания натрия могут использоваться минимальные количества альдостерона, невозможность секретировать гормон в соответствующем количестве существенным образом сказывается на регуляции выделения калия с мочой и его концентрации в жидких средах организма. Таким образом, альдостерон имеет гораздо большее значение для регуляции содержания калия в организме, чем для натрия.
б) Ангиотензин II увеличивает реабсорбцию воды и натрия. Ангиотензин II, возможно, является наиболее сильным гормоном, задерживающим натрий в организме. Его образование увеличивается при снижении артериального давления либо уменьшении объема внеклеточной жидкости, что наблюдается при кровотечении, потере воды и солей жидкими средами организма. Увеличение образования ангиотензина II способствует стабилизации артериального давления, возвращая его и объем внеклеточной жидкости к норме благодаря усилению реабсорбции натрия и воды в канальцах. Стабилизация артериального давления осуществляется тремя основными способами.
1. Ангиотензин II стимулирует секрецию альдостерона, что, в свою очередь, увеличивает реабсорбцию натрия.
2. Ангиотензин II сужает просвет выносящей артериолы, изменяя кровообращение в перитубулярных капиллярах, увеличивая таким образом реабсорбцию воды и натрия. Во-первых, сужение просвета выносящей артериолы уменьшает гидростатическое давление в пери-тубулярных капиллярах, что способствует усилению реабсорбции в канальцах, особенно в проксимальных. Во-вторых, сужение просвета выносящей артериолы, уменьшая почечный кровоток, увеличивает фракцию фильтрации в клубочке, приводя к концентрированию белков и повышению онкотического давления в перитубулярных капиллярах. Это усиливает реабсорбцию натрия и воды в капиллярах и канальцах.
3. Ангиотензин II непосредственно стимулирует реабсорбцию натрия в проксимальных канальцах, петлях Генле, дистальных канальцах и собирательных трубочках. Одним из непосредственных эффектов ангиотензина II является активация АТФ-азы Na+/K+-Hacoca, расположенного на базолатеральной поверхности мембран эпителия канальцев. Вторым механизмом служит активация Na+/H+-нacoса на апикальной мембране клеток, особенно в проксимальной трубочке. Таким образом, ангиотензин II стимулирует транспорт натрия как через апикальную, так и базолатеральную мембраны канальцевого эпителия. Перечисленные эффекты ангиотензина II при повышении его содержания приводят к значительной задержке натрия почками.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
— Вернуться в оглавление раздела «Физиология человека.»
Какие гормоны регулируют реабсорбцию воды
Регуляция канальцевой реабсорбции осуществляется как нервным, так и, в большей мере, гуморальным путем.
Нервные влияния реализуются преимущественно симпатическими проводниками и медиаторами через бета-адренорецепторы мембран клеток проксимальных и дистальных канальцев. Симпатические эффекты проявляются в виде активации процессов реабсорбции глюкозы, ионов натрия, воды и анионов фосфатов и осуществляются через систему вторичных посредников (аденилатциклаза — цАМФ). Нервная регуляция кровообращения в мозговом веществе почки увеличивает или уменьшает эффективность сосудистой противоточной системы и концентрирование мочи. Сосудистые эффекты нервной регуляции также опосредуются через внутри-почечные системы гуморальных регуляторов — ренин-ангиотензиновую, кининовую, простагландины и др.
Основным фактором регуляции реабсорбции воды в дистальных отделах нефрона является гормон вазопрессин, называвшийся ранее антидиуретическим гормоном. Этот гормон образуется в супраоптическом и паравен-трикулярных ядрах гипоталамуса, по аксонам нейронов транспортируется в нейрогипофиз, откуда и поступает в кровь. Влияние вазопрессина на проницаемость эпителия канальцев обусловлено наличием рецепторов к гормону, относящихся к V2-типу, на поверхности базолатеральной мембраны клеток эпителия. Образование гормон-рецепторного комплекса влечет за собой через посредство GS-белка и гуанилового нуклеотида активацию аденилатциклазы и образование цАМФ, активацию синтеза и встраивания аквапоринов 2-го типа («водных каналов») в апикальную мембрану клеток эпителия собирательных трубочек. Перестройка ультраструктур мембраны и цитоплазмы клетки ведет к образованию внутриклеточных специализированных структур, переносящих большие потоки воды по осмотическому градиенту от апикальной к базолатеральной мембране, не позволяя транспортируемой воде смешиваться с цитоплазмой и препятствуя набуханию клетки. Такой трансцеллюлярный транспорт воды через клетки эпителия реализуется вазопрессином в собирательных трубочках. Кроме того, в дистальных канальцах вазопрессин обусловливает активацию и выход из клеток гиалуронидаз, вызывающих расщепление гликозаминогликанов основного межклеточного вещества, тем самым способствуя межклеточному пассивному транспорту воды по осмотическому градиенту.
Таблица 14.1. Основные гуморальные влияния на процессы мочеобразования
Канальцевая реабсорбция воды регулируется и другими гормонами (табл. 14.1). По механизму действия все гормоны, регулирующие реабсорбцию воды, делятся на шесть групп:
• повышающие проницаемость мембран дистальных отделов нефрона для воды (вазопрессин, пролактин, хорионический гонадотропин);
• меняющие чувствительность клеточных рецепторов к вазопрессину (паратирин, кальцитонин, кальцитриол, простагландины, альдостерон);
• меняющие осмотический градиент интерстиция мозгового слоя почки и, соответственно, пассивный осмотический транспорт воды (паратирин, кальцитриол, тиреоидные гормоны, инсулин, вазопрессин);
• меняющие активный транспорт натрия и хлорида, а за счет этого и пассивный транспорт воды (альдостерон, вазопрессин, атриопептид, прогестерон, глюкагон, кальцитонин, простагландины);
• повышающие осмотическое давление канальцевой мочи за счет нере-абсорбированных осмотически активных веществ, например глюкозы (контринсулярные гормоны);
• меняющие кровоток по прямым сосудам мозгового вещества и, тем самым, накопление или «вымывание» осмотически активных веществ из интерстиция (ангиотензин-П, кинины, простагландины, паратирин, вазопрессин, атриопептид).
Гормональная регуляция
1. Гормоны, регулирующие реабсорбцию воды:
1) повышающие проницаемость мембран дистальных отделов нефрона для воды – антидиуретический гормон (АДГ) (вазопрессин), пролактин, хорионический гонадотропин;
2) изменяющие чувствительность рецепторов нефроцитов к АДГ – паратгормон, кальцитонин, кальцитриол, простагландины, альдостерон;
3) меняющие осмотический градиент интерстициальной ткани мозгового слоя почки, что изменяет пассивный осмотический транспорт воды – паратгормон, кальцитриол, тиреоидные гормоны, инсулин, вазопрессин;
4) меняющие активный транспорт натрия и хлора, что также изменяет пассивный осмотический транспорт воды – альдостерон, АДГ, атриальный натрийуретический пептид (АНП), прогестерон, глюкагон, кальцитонин, простагландины;
5) повышающие осмотическое давление канальцевой мочи за счет увеличения содержания осмотически активных веществ – контринсулярные гормоны;
6) влияющие на кровоток в сосудах мозгового вещества, что вызывает накопление или вымывание осмоактивных веществ из интерстициальной ткани – ангиотензин II, кинины, простагландины, паратгормон, АДГ, АНП.
АНТИДИУРЕТИЧЕСКИЙ ГОРМОН (АДГ) или ВАЗОПРЕССИН
Нанопептид, вырабатывается в супраоптическом ядре гипоталамуса. По волокнам нейросекреторных клеток поступает в заднюю долю гипофиза. Уменьшает мочеотделение.
МЕХАНИЗМ ДЕЙСТВИЯ АДГ
Рецепторы (V1 иV2) расположены на базальных и латеральных мембранах клеток дистального сегмента нефрона и собирательных трубок.После взаимодействия сV1 рецепторами активируется образование вторичных мессенджеров инозитолтрифосфата и триацилглицерина. После взаимодействия сV2 рецепторами активируется фермент аденилатциклаза, в результате чего из АТФ образуется вторичный мессенджер циклический АМФ (цАМФ).Который способствует встраиванию в апикальную мембрану агрефоров – предшественников водных каналов, содержащихся в цитоплазме клетки. В этом процессе участвуют микрофиламенты и микротрубочки.Чем больше образуется цАМФ, тем больше водных каналов на апикальной мембране, т.е. тем выше ее проницаемость для воды (цАМФ разрушается ферментом фосфодиэстеразой цАМФ.
В реализации действия АДГ имеет значение и стимуляция им гиалуронатгидролазы – фермента, деполимеризующего гликозаминогликаны межклеточного вещества. Это повышает трансмембранный транспорт воды.
Доказательство – введение в кровь антисыворотки к почечной гиалуронатгидролазе уменьшает способность АДГ увеличивать реабсорбцию воды.
2. Гормоны, регулирующие реабсорбцию ионов:
Минералокортикоид, образуется в клубочковой зоне коры надпочечников. Увеличивает реабсорбцию натрия в клетках дистального сегмента.
Проникает в клетку через базальную мембрану, в цитоплазме соединяется с рецептором. Комплекс гормон-рецептор поступает в ядро, где альдостерон образует комплекс со стереоспецифичным для него хроматином. Стимулируется транскрипция определенного участка генетического кода. Синтезированная мРНК поступает в цитоплазму и активирует синтез:компонентов натриевого насоса ферментов его энергетического обеспечения
веществ, облегчающих вход натрия в клетку через апикальную мембрану (образующих натриевые каналы или увеличивающих время их открытого состояния)
АТРИАЛЬНЫЙ НАТРИЙУРЕТИЧЕСКИЙ ПЕПТИД (АНП)
1) уменьшает реабсорбцию натрия (в 90 раз) и хлора (в 50 раз), что повышает их экскрецию;
2) стимулирует клубочковую фильтрацию и снижает реабсорбцию воды, что увеличивает диурез;
3) подавляет секрецию ренина, ингибирует эффекты ангиотензина IIи альдостерона, т.е. является антагонистом ренин-ангиотензин-альдостероновой системы.
Норадреналин через бета-адренорецепторы юкстамедуллярных клеток стимулирует секрецию ренина, оказывающего вазоконстрикторное действие:
1) если уменьшается просвет vasafferens, ЭФД падает и фильтрация снижается;
2) если уменьшается просвет vasefferens, ЭФД повышается и фильтрация увеличивается.
Синдром Пархона, или Несахарный антидиабет
Елена Шведкина о состоянии, при котором в организме задерживается слишком много жидкости
Синдром Пархона — редкое заболевание. Оно характеризуется избыточной секрецией антидиуретического гормона (АДГ) из гипофиза или другого источника, что приводит к снижению концентрации ионов натрия в крови (гипонатриемии) и задержке жидкости в тканях, т. е. к водной интоксикации.
Синдром Пархона встречается не более чем в 1 % случаев всех выявленных гипонатриемий. Вообще, гипонатриемия выявляется у 15–20 % пациентов, госпитализированных в связи с неотложными показаниями, и в 20 % госпитализированных в критическом состоянии. Распространенность гипонатриемии среди амбулаторных пациентов намного ниже и составляет приблизительно 4–7 %. В Международной классификации болезней синдром Пархона имеет шифр Е22.2.
Комплекс симптомов синдрома Пархона впервые был выделен в отдельную патологию румынским ученым, эндокринологом Константином Пархоном в 1938 году, за что болезнь и получила свое именное название. Пархон сообщил о редком клиническом синдроме, по симптоматике противоположном несахарному диабету. Напомним, что при несахарном диабете имеет место полиурия (выделение до 15 литров мочи в сутки) и полидипсия (жажда), а при синдроме Пархона, напротив, жажда и полиурия отсутствуют. Отсюда появилось второе название синдрома Пархона — «несахарный антидиабет». Кроме того, Пархон первым связал синдром с избытком АДГ. В авторском описании заболевание характеризовалось олигурией, отсутствием жажды и появлением отеков. Впоследствии термином «синдром Пархона» стали обозначать идиопатическую форму синдрома неадекватной секреции АДГ.
В дальнейшем, в 1957 году, синдром гиперсекреции АДГ был детально описан группой ученых под руководством американского эндокринолога Фредерика Барттера у пациентов с бронхогенной карциномой.
Регуляция водного баланса в норме
В организме секрецию вазопрессина (АДГ) активируют:
В крови АДГ не связывается белками плазмы, он ассоциирован с тромбоцитами, которые выполняют таким образом транспортную функцию.
В тканях-мишенях есть два типа мембранных рецепторов к АДГ — V1 и V2. Стимуляция V1‑рецепторов, локализованных на мембране эндотелиальных и гладкомышечных клеток кровеносных сосудов, вызывает сужение сосудов. Стимуляция V2‑рецепторов клеток дистальных отделов почечных канальцев повышает реабсорбцию воды и концентрирование мочи. АДГ является единственным гормоном, способным стимулировать канальцевую реабсорбцию воды и при этом не задерживать натрий в организме. АДГ также стимулирует всасывание воды и в железах внешней секреции, и в желчном пузыре.
Этиология
Синдром гиперсекреции АДГ может развиваться при различных заболеваниях и приеме некоторых лекарственных средств. Так, при поражении центральной нервной системы развитие синдрома обусловлено увеличением выработки АДГ гипофизом. Злокачественные новообразования могут сами вырабатывать АДГ вне зависимости от гипоталамо-гипофизарного звена, при этом гиперсекреция АДГ развивается в рамках паранеопластического синдрома, однако чаще имеет легкую, стертую форму течения и выявляется достаточно поздно, поэтому не может стать маркером опухолевого роста на ранней стадии. Другая часто встречающаяся причина гиперпродукции АДГ — синдром приобретенного иммунодефицита (СПИД). При СПИДе синдром неадекватной продукции АДГ может быть следствием бактериальных либо вирусных инфекций легких и ЦНС. Синдром Пархона чаще развивается у пожилых людей и больных с хронической соматической патологией.
Основные причины гиперсекреции АДГ
| Поражение ЦНС | Инсульт Кровоизлияние Новообразования Инфекции Гидроцефалия Гипофизэктомия транссфеноидальным доступом Красная волчанка Острая перемежающаяся порфирия |
| Злокачественные новообразования | Мелкоклеточный рак легкого Рак глотки, тимома Рак поджелудочной железы Рак мочевого пузыря Лимфома, саркома Рак других органов (предстательной железы, двенадцатиперстной кишки, яичников, мезотелия) |
| Поражение дыхательной системы за счет стимуляции J-рецепторов | Инфекции (пневмонии, абсцесс, туберкулез) Бронхоэктазы Искусственная вентиляция легких |
| Прием лекарственных препаратов | Психотропные препараты (нейролептики, трициклические антидепрессанты, селективные ингибиторы обратного захвата серотонина, карбамазепин) Неврологические препараты (наркотические анальгетики, амфетамины) Ингибиторы ацетилхолинэстеразы Противоопухолевые препараты (винкристин, винбластин, циклофосфамид) Эндокринологические препараты (окситоцин, десмопрессин, клофибрат) |
| Инфекционные заболевания опосредованно через ИЛ-6 | Заболевания ЦНС и дыхательной системы СПИД |
| Идиопатические |
Патофизиология
В основе синдрома лежит дисбаланс жидкости в организме: поступление воды превышает её выведение. У большинства пациентов постоянно секретируются АДГ или АДГ-подобные пептиды, несмотря на гипоосмолярность плазмы. Гиперпродукция АДГ ведет к задержке воды, снижению осмолярности плазмы, почечной потере натрия и гипонатриемии, но низкий уровень натрия в плазме и гиперволемия не вызывают компенсаторного, адекватного снижения синтеза АДГ. Гиперволемия подавляет продукцию альдостерона, усугубляя тем самым потерю натрия.
В условиях гиперволемии усиливается секреция предсердного натрийуретического фактора, что также способствует выведению натрия. Таким образом, патофизиологическую основу синдрома неадекватной продукции АДГ составляют: потеря натрия с мочой; гипонатриемия, подавляющая центр жажды; гиперволемия, ведущая к водной интоксикации.
Клиническая картина
Синдром Пархона редко развивается самостоятельно, и в первую очередь пациента беспокоят проявления основного заболевания. Ведущие клинические проявления — симптомы нарушения сознания, редко (при выраженной гипонатриемии и водной интоксикации) возможны увеличение массы тела и образование отеков, обусловленные задержкой воды, вследствие олигурии. Выраженность клинических проявлений определяется степенью гипонатриемии.
Лабораторные исследования
Определяют концентрацию натрия в крови, осмоляльность крови и мочи, исследуют почечную экскрецию натрия. Диагностика синдрома Пархона основана на обнаружении гипонатриемии, гипоосмоляльности плазмы и гиперосмоляльности мочи (>300 моем/кг).
Дифференциальный диагноз
При проведении дифференциальной диагностики в первую очередь необходимо исключить заболевания печени, почек, сердца, надпочечниковую недостаточность и гипотиреоз. Наибольшие трудности возникают при попытке дифференцировать диагноз с синдромом идиопатических отеков — заболеванием, имеющим много клинически сходных симптомов, но иную патофизиологическую природу (патогенез связан с рядом нейрогенных, гемодинамических и гормональных изменений, ведущих к нарушению регуляции водно-солевого гомеостаза). Этот синдром характеризуется развитием периферических или распространенных отеков. АДГ повышен у всех больных с синдромом Пархона, тогда как при идиопатических отеках повышение АДГ наблюдается редко, также и гипонатриемия, и гиперволемия никогда не наблюдаются при идиопатических отеках.
Лечение
Основными целями лечения синдрома Пархона являются нормализация осмоляльности и концентрации натрия в плазме, устранение гипергидратации.
Для лечения острых и выраженных проявлений синдрома назначается гипертонический раствор хлорида натрия (3 %) в сочетании с диуретиком, скорость повышения концентрации натрия 0,5–1,0 ммоль/л в час до достижения концентрации 125 ммоль/л.
Для купирования легкой хронической гипонатриемии эффективной мерой является умеренное ограничение приема жидкости до 800–1000 мл/сут.
Прогноз
Прогноз в целом благоприятный, но зависит от характера основного заболевания и причины, вызвавшей неадекватную секрецию АДГ. Тяжелые формы синдрома Пархона могут приводить к летальному исходу в результате тяжелой водной интоксикации.
Какие гормоны регулируют реабсорбцию воды
Надпочечники – парный внебрюшинный орган, представлен мозговым веществом и корковым слоем. Кора надпочечников, включающая до 90% массы, представлена тремя зонами: наружной – клубочковой (z. glomerulosa), средней – пучковой (z. fasticulata), внутренней – сетчатой (z. reticularis). В корковом слое надпочечников вырабатывается около 50 стероидных соединений из холестерина, липопротеидов низкой плотности (ЛПНП), липопротеидов высокой плотности (ЛПВП) или из ацетата.
Клубочковая зона, составляющая около 15% ткани надпочечников, является местом продукции минералокортикоидов, в первую очередь альдостерона. Промежуточными этапами образования альдостерона являются прогестерон, ДОК, кортикостерон и 18-оксикортикостерон.
Клетки пучковой зоны, составляющие до 75% ткани коркового вещества, продуцируют глюкокортикоиды (в основном кортизол – гидрокортизон). Клетки сетчатой зоны вырабатывают не только кортизол, но и половые гормоны – эстрогены и андрогены. Промежуточными продуктами синтеза гормонов пучковой и сетчатой зон являются С-19-стероиды, обладающие андрогенной активностью.
В ряде случаев имеет место дополнительная эктопированная ткань коркового вещества надпочечников (в почках, селезенке, вдоль аорты и т. д.).
Окончательное формирование указанных зон коркового вещества надпочечников происходит к 3-х-летнему возрасту.
Стимуляторами клубочковой зоны коры надпочечников являются ангиотензин-II и в меньшей степени ангиотензин-III. Ангиотензин-II активирует продукцию альдостерона как на стадии включения холестерина в прегненолон, так и на поздних стадиях превращения кортикостерона в 18-гидроксикортикостерон. В то же время он является митогеном для клеток клубочковой зоны. Одним из дериватов ангиотензина-II является ангиотензин-III, обладающий слабой вазоконстрикторной активностью. Ангиотензиназы эндотелия сосудов завершают инактивацию ангиотензинов.
АКТГ обладает слабым тропным и митогенным действием на клубочковую зону в условиях нормы, но при гиперпродукции этого гормона резко возрастают активационные эффекты. Выраженным стимулирующим влиянием на клубочковую зону обладают мелатонин и серотонин, а также β-липотропин. При стрессе возникает усиление продукции минералокортикоидов под влиянием АКТГ, АДГ, ангиотензинов, катехоламинов.
Продукция минералокортикоидов подавляется натриуретическими пептидами (атриопептидами), эндогенными опиатами, дофамином.
Атриопептиды – естественные антагонисты минералокортикоидов и вазопрессина, продуцируются секреторными кардиомиоцитами предсердия, а также в легких, цнс, вегетативных ганглиях и других тканях. Атриопептиды оказывают дилататорный и гипотензивный эффекты, снижают реабсорбцию натрия в почках и увеличивают процессы фильтрации. Секреция атриопептидов возрастает при гиперволемии, гипертензии, растяжении предсердий, солевой нагрузке. Стимуляторами секреции атриопептидов являются глюкокортикоиды, минералокортикоиды, вазопрессин. Как компенсаторная реакция гиперпродукция атриопептидов возрастает при сердечной и почечной недостаточности.
Резкие нарушения эндокринных влияний со стороны надпочечников на метаболические процессы и, в частности, на водно-электролитный баланс имеют место в условиях гипер- и гипокортицизма.
В 15-30% случаев в основе гиперкортицизма лежит первичное поражение клеток коркового вещества надпочечников чаще опухолевой природы (глюкостерома), что обуславливает развитие синдрома Иценко-Кушинга. Злокачественные опухоли – глюкостеромы – возникают чаще у мужчин, у женщин опухоли аналогичной локализации носят доброкачественный характер. В ряде случаев формируется глюкоандростерома.
Гиперкортицизм, связанный с развитием адренокортикотропиномы гипофиза, именуется в России болезнью Иценко-Кушинга. С указанной патологией связаны до 50-80% случаев эндогенного гиперкортицизма. Синдром эктопической автономной секреции АКТГ составляет 5-15% эндогенного гиперкортицизма, возникает чаще у мужчин при бронхогенном раке легкого, карциноидах желудочно-кишечного тракта, при тимоме, β-инсуломе, раке щитовидной железы и т. д. Ятрогенный гиперкортицизм возникает при длительном лечении глюкокортикоидами заболеваний иммуноаллергической, онкогенной природы. Нарушения водно-электролитного обмена при гиперкортицизме характеризуются развитием гипернатриемии, гипокалиемии, отеками, гиперкальциемией, развитием интрацеллюлярного ацидоза и экстрацеллюлярного алкалоза. Указанные изменения связаны с избыточной потерей калия с мочой при одновременном усилении поступления в клетки натрия и водорода под влиянием глюкокортикоидов.
Нарушения водно-электролитного баланса при синдроме Иценко-Кушинга (первичном гиперкортицизме) сочетаются с системными нарушениями белкового, жирового, углеводного обменов, как и при болезни Иценко-Кушинга.
Последние характеризуются усилением катаболических реакций в лимфоидной, соединительной, мышечной, костной, хрящевой тканях, развитием отрицательного азотистого баланса. Глюкокортикоиды – контринсулярные гормоны, – в связи с чем возможны гипергликемия, глюкозурия, полиурия, полидипсия. Одновременно возникают перераспредение жиров, активируется атеросклеротический процесс.
Минералокортикоиды – альдостерон и дезоксикортикостерон – важнейшие регуляторы функции дистальных почечных канальцев и собирательных трубочек – обеспечивают задержку натрия, усиление секреции калия и протонов водорода. В то же время мишенями аналогичного действия минералокортикоидов являются слизистые оболочки желудочно-кишечного тракта, потовые, слюнные и молочные железы. Минералокортикоиды, являясь производными холестерина, достаточно легко проникают через липидный бислой цитоплазматических мембран клеток-мишеней, связываются с цитозольными рецепторами I типа, а затем проникают в ядро, вызывая дерепрессию определенных участков генома, синтез белков-переносчиков, обеспечивающих реабсорбцию натрия в обмен на экскрецию калия и водорода.
Неконкурентным антагонистом альдостерона является предсердный натрийуретический фактор.
Так называемые быстрые эффекты минералокортикоидов на водно-электролитный баланс обусловливаются их прямым действием на цитоплазматические мембраны клеток различных органов и тканей, в частности на фосфатидил-инозитоловые посредники. При этом чрезвычайно быстро (в течение 1-2 минут) возникает задержка ионов натрия с одновременной потерей протонов водорода и калия практически всеми клетками организма человека, что приводит к повышению их возбудимости и функциональной активности.
В связи с этим очевидны выраженные нарушения водно-электролитного баланса в условиях гиперальдостеронизма.
Гиперальдостеронизм может быть первичным (наследственным), связанным с аномалией структуры альдостеронсинтетазы. Значительно чаще встречается приобретенный первичный гиперальдостеронизм (синдром Конна).
Приобретенный первичный гиперальдостеронизм, или синдром Конна, впервые был описан в 1955 году. Причиной этой патологии в 85% случаев является гормонально активная опухоль клубочковой зоны коры надпочечников (альдостерома), реже (
в 9%) диффузная гиперплазия коры надпочечников,
в 6% случаев наблюдается карцинома и иногда опухоль с эктопической локализацией (яичник, кишечник, щитовидная железа). Заболевание наиболее часто возникает в возрасте 30-45 лет.
При всех формах первичного гиперальдостеронизма тормозится продукция ренина за счет активации волуморецепторов на фоне гиперволемии.
Симптоматика заболевания связана со свойственным гиперпродукции минералокортикоидов нарушением водно-электролитного баланса, т.е. чрезмерной задержкой натрия в органах-мишенях при одновременном усилении экскреции калия и ионов водорода.
Клиническая манифестация нарушений водно-электролитного баланса при синдроме Конна характеризуется развитием нервно-мышечных расстройств, симптоматики нефропатии и гипертензии.
К нервно-мышечным симптомам относятся мышечная слабость, судороги, парестезии, обусловленные чрезмерной потерей калия. Миастения проявляется в виде периодических приступов.
Потеря калия в условиях гиперальдостеронизма сопровождается развитием гипокалиемической нефропатии в 80% наблюдений, нарушением структуры и функции проксимальных и дистальных канальцев, снижением чувствительности V2-рецепторов к вазопрессину.
Чрезмерная задержка натрия в гладкомышечных элементах сосудистой стенки приводит к их частичной деполяризации, повышению возбудимости, развитию вазоконстрикции даже в ответ на действие физиологических концентраций вазоконстрикторов: адреналина, норадреналина, АДГ.
Одновременно возникают гидратация сосудистой стенки, снижение ее эластичности, повышение базального сосудистого тонуса. Все перечисленные факторы приводят к развитию гипертензии.
Задержка натрия и воды под влиянием минералокортикоидов способствует повышению объема циркулирующей крови, развитию внутриклеточной гидратации.
Вторичный гиперальдостеронизм – наиболее частая форма патологии. Вторичный гиперальдостеронизм носит симптоматический характер, возникает в случаях гиповолемии, гипоксии и ишемии почек, гипонатриемии и гиперкалиемии, при беременности, рениноме, а также при активации симпатоадреналовой системы в связи с возбуждением соответствующих рецепторов (волумо-, хемо-, осморецепторов), клеток ЮГА почек, а также ряда других органов и тканей. Пусковым механизмом вторичного гиперальдостеронизма является активация ренин-ангиотензиновой системы. В настоящее время очевидно наличие циркулирующей (системной) и тканевой (местной) ренин-ангиотензиновых систем.
Циркулирующая ренин-ангиотензиновая система включает следующие компоненты: ренин, ангиотензиноген, ангиотензины, ангиотензинпревращающий фермент. Ренин – протеолитический фермент, продуцируемый клетками ЮГА почек, расщепляет ангиотензиноген (α2-глобулин с ММ около 60 кД) и его в ангиотензин-I. Последний обладает незначительным вазоконстрикторным эффектом. Ангиотензин-I под влиянием ангиотензинпревращающего фермента (металлопротеиназы) последовательно переходит в ангиотензин-II, ангиотензин-III и ангиотензин-IV. Ангиотензин-II обладает наиболее выраженным вазоконстрикторным действием, влияя на соответствующие рецепторы сосудистой стенки, и стимулирует секрецию минералокортикоидов, задержку натрия и воды в организме, потерю калия и протонов.
Тканевая ренин-ангиотензиновая система, включающая экспрессию генов ренина, наличие ангиотензина-I, ангиотензинпревращающего фермента, ангиотензина-II, ангиотензиновых рецепторов, обнаружена в надпочечниках, головном мозге, сердце, кровеносных сосудах, почках. Причем в тканях возможно образование ангиотензина-II из ангиотензина-I без участия ангиотензинпревращающего фермента, а под влиянием химазы, катепсина, тканевого активатора плазминогена.
В тканях имеет место и прямой путь превращения ангиотензиногена в ангиотензин-II под влиянием ферментов катепсина Q, тонина, элластазы, тканевого активатора плазминогена.
Нарушения водно-электролитного баланса в условиях вторичного гиперальдостеронизма аналогичны таковым, возникающим при синдроме Конна, но выражены в меньшей мере. Это, прежде всего, чрезмерная задержка натрия и воды, потеря калия и протонов водорода в дистальных сегментах почек, слизистой желудочно-кишечного тракта.
Расстройства электролитного баланса при гиперальдостеронизме приводят к развитию отеков, задержке натрия и воды внутри клеток, формированию гипертензивного синдрома, гипертрофии миокарда. Длительная задержка натрия сопровождается усилением продукции атриопептидов; при этом в собирательных трубках увеличивается выделение натрия и воды, отеки спадают. Однако в дистальных канальцах атриопептиновые рецепторы представлены слабо, где эффекты альдостерона сохраняются в полной мере. Длительная потеря калия при гиперальдостеронизме обуславливает формирование гипокалиемической нефропатии и, соответственно, снижение чувствительности дистальных канальцев почек к АДГ. При этом возникает полиурия.
Гипокортицизм проявляется в виде надпочечниковой недостаточности. Различают острую и хроническую недостаточность надпочечников. Острая недостаточность развивается при тромбозе и эмболии сосудов надпочечников (синдром Уотерхауса-Фридериксена). Хроническая надпочечниковая недостаточность может быть первичной и вторичной. Первичная хроническая недостаточность надпочечников связана чаще с их аутоиммунным поражением, развитием туберкулеза, реже – опухолевого процесса (ангиомы, ганглионевромы), в ряде случаев связана с метастазированием опухолевых клеток в надпочечники или с грибковым, сифилитическим разрушением надпочечников.
Острая недостаточность надпочечников – критическое состояние, проявляющееся развитием коллапса, резкой адинамии, потерей сознания. Основные клинические проявления надпочечниковой недостаточности обусловлены тяжелыми нарушениями водно-электролитного баланса и углеводного обмена в связи с дефицитом глюко- и минералокортикоидов. При этом возникает резкое снижение реабсорбции натрия и хлоридов в дистальных сегментах почек и кишечнике, развиваются чрезмерная потеря натрия и полиурия. Снижение содержания натрия и воды в организме приводят, в частности, к падению базального сосудистого тонуса, развитию гипотонии различной степени тяжести. Достаточно весомый вклад в развитие клинических проявлений гипокортицизма вносит усиление реабсорбции ионов калия в дистальных сегментах почек и кишечнике и увеличение его концентрации в крови. Гиперкалиемия сопровождается нарушением сократительной способности миокарда вплоть до остановки сердца, развитием спастических сокращений кишечника и, соответственно, диареей, рвотой, абдоминальными болями.
При дефиците глюкокортикоидов – контринсулярных гормонов – усиливается гипогликемизирующее действие инсулина, уровень сахара в крови резко снижается вплоть до развития гипогликемического коматозного состояния.
Дефицит глюкокортикоидов при гипокортицизме сопровождается подавлением гемопоэза в костном мозге, эритропоэза, одновременно возникает гиперплазия лимфоидной ткани.
При хроническом гипокортицизме (болезнь Аддисона) возникает гиперпигментация кожи, что связано в определенной степени с гиперпродукцией проопиомеланокортина аденогипофиза, содержащего в своем составе меланоцитостимулирующий гормон (МСГ).
Нарушения метаболического статуса, в частности водно-солевого гомеостаза, при хроническом гипокортицизме выражены в значительно меньшей мере, чем при остро развивающейся патологии. Однако в основе расстройств водно-электролитного баланса лежат усиленная потеря натрия и воды при одновременной активации всасывания калия, протонов водорода в дистальных сегментах почек и в желудочно-кишечном тракте, приводящие к типичным системным функциональным расстройствам.