какие гормоны продуцируются клетками островков лангерганса
Какие гормоны продуцируются клетками островков лангерганса
Эндокринную функцию в поджелудочной железе выполняют скопления клеток эпителиального происхождения, получившие название островков Лангерганса и составляющие всего 1 —2 % массы поджелудочной железы — экзокринного органа, образующего панкреатический пищеварительный сок. Количество островков в железе взрослого человека очень велико и составляет от 200 тысяч до полутора миллионов.
В островках различают несколько типов клеток, продуцирующих гормоны: альфа-клетки образуют глюкагон, бета-клетки — инсулин, дельта-клетки — соматостатин, джи-клетки — гастрин и РР- или F-клетки — панкреатический полипептид. Помимо инсулина в бета-клетках синтезируется гормон амилин, обладающий противоположными инсулину эффектами. Кровоснабжение островков более интенсивно, чем основной паренхимы железы. Иннервация осуществляется постганлионарными симпатическими и парасимпатическими нервами, причем среди клеток островков расположены нервные клетки, образующие нейроинсулярные комплексы.
Инсулин синтезируется в эндоплазматическом ретикулуме бета-клеток вначале в виде пре-проинсулина, затем от него отщепляется 23-аминокис-лотная цепь и остающаяся молекула носит название проинсулина. В комплексе Гольджи проинсулин упаковывается в гранулы, в них осуществляется расщепление проинсулина на инсулин и соединительный пептид (С-пептид). В гранулах инсулин депонируется в виде полимера и частично в комплексе с цинком. Количество депонированного в гранулах инсулина почти в 10 раз превышает суточную потребность в гормоне. Секреция инсулина происходит путем экзоцитоза гранул, при этом в кровь поступает эквимолярное количество инсулина и С-пептида. Определение содержания последнего в крови является важным диагностическим тестом оценки секреторной способности (3-клеток.
Секреция инсулина является кальцийзависимым процессом. Под влиянием стимула — повышенного уровня глюкозы в крови — мембрана бета-клеток деполяризуется, ионы кальция входят в клетки, что запускает процесс сокращения внутриклеточной микротубулярной системы и перемещение гранул к плазматической мембране с последующим их экзоцитозом.
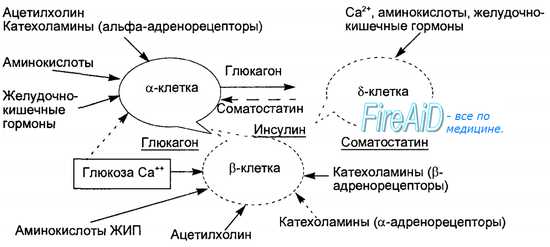
Секреторная функция разных клеток островков взаимосвязана, зависит от эффектов образуемых ими гормонов, в связи с чем островки рассматриваются как своеобразный «мини-орган» (рис. 6.21). Выделяют два вида секреции инсулина: базальную и стимулированную. Базальная секреция инсулина осуществляется постоянно, даже при голодании и уровне глюкозы крови ниже 4 ммоль/л.
Стимулированная секреция инсулина представляет собой ответ бета-клеток островков на повышенный уровень D-глюкозы в притекающей к бета-клеткам крови. Под влиянием глюкозы активируется энергетический рецептор бета-клеток, что увеличивает транспорт в клетку ионов кальция, активирует аденилатциклазу и пул (фонд) цАМФ. Через эти посредники глюкоза стимулирует выброс инсулина в кровь из специфических секреторных гранул. Усиливает ответ бета-клеток на действие глюкозы гормон двенадцатиперстной кишки — желудочный ингибиторный пептид (ЖИП). В регуляции секреции инсулина определенную роль играет и вегетативная нервная система. Блуждающий нерв и ацетилхолин стимулируют секрецию инсулина, а симпатические нервы и норадреналин через альфа-адренорецепторы подавляют секрецию инсулина и стимулируют выброс глюкагона.
Специфическим ингибитором продукции инсулина является гормон дельта-клеток островков — соматостатин. Этот гормон образуется и в кишечнике, где тормозит всасывание глюкозы и тем самым уменьшает ответную реакцию бета-клеток на глюкозный стимул. Образование в поджелудочной железе и кишечнике пептидов, аналогичных мосговым, например сомато-статина, подтверждает существование в организме единой APUD-системы. Секреция глюкагона стимулируется снижением уровня глюкозы в крови, гормонами желудочно-кишечного тракта (ЖИП гастрин, секретин, холе-цистокинин-панкреозимин) и при уменьшении в крови ионов Са2+. Подавляют секрецию глюкагона инсулин, соматостатин, глюкоза крови и Са2+. В эндокринных клетках кишечника образуется глюкагоноподобный пептид-1, стимулирующий всасывание глюкозы и секрецию инсулина после приема пищи. Клетки желудочно-кишечного тракта, продуцирующие гормоны, являются своеобразными «приборами раннего оповещения» клеток панкреатических островков о поступлении пищевых веществ в организм, требующих для утилизации и распределения участия панкреатических гормонов. Эта функциональная взаимосвязь нашла отражение в термине «гастро-энтеро-панкреатическая система».
Инсулин
Инсулином называется гормон, производимый бета-клетками островков Лангерганса поджелудочной железы. Название инсулина происходит от латинского insula – остров. Эффекты инсулина
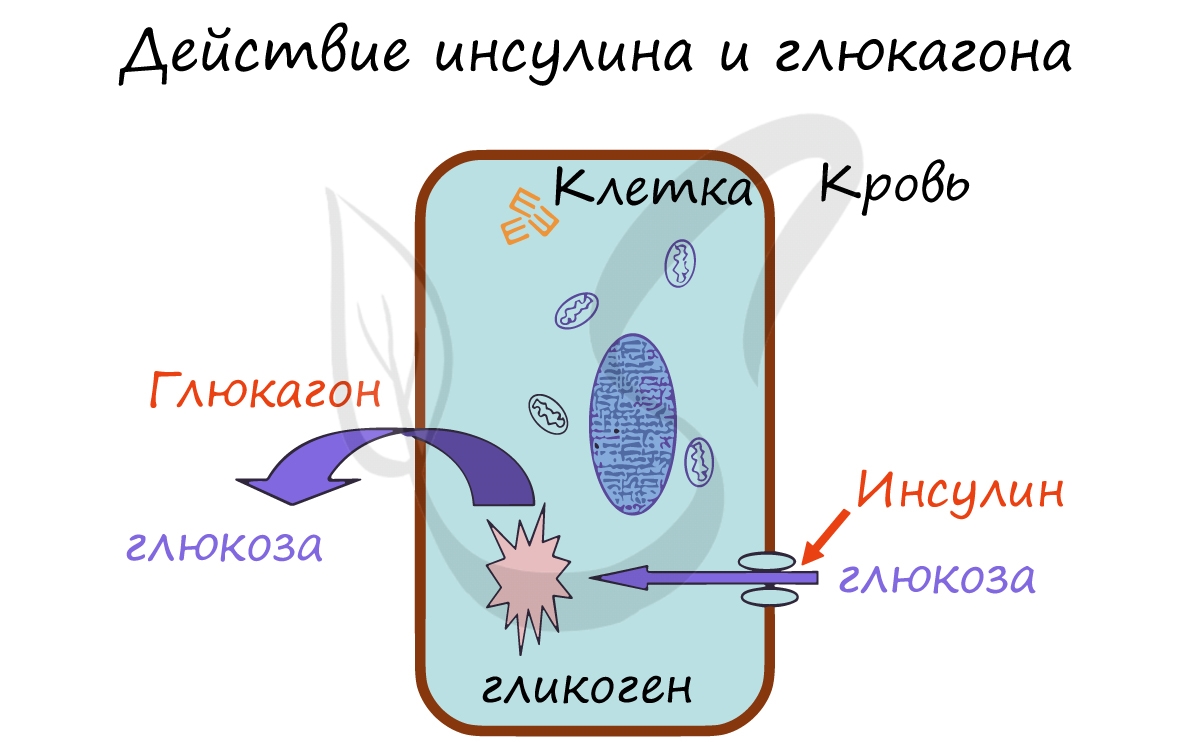
Несмотря на то, что инсулин вызывает множество эффектов в различных тканях человеческого тела, его основным эффектом является стимулирование перехода глюкозы из крови внутрь клеток, что приводит к снижению концентрации глюкозы в крови.
Другими эффектами инсулина являются стимулирование синтеза в печены и мышцах гликогена из глюкозы, увеличение создания жиров и белков, подавление активности ферментов, разрушающих жиры и белки. Таким образом, инсулин обладает анаболическим действием, поскольку усиливает образование жиров и белков, одновременно замедляя их распад.
Основной эффект инсулина заключается в усилении переноса глюкозы через клеточную мембрану внутрь клетки. Других гормонов, снижающих уровень глюкозы крови, в организме человека не существует. Основные эффекты инсулина проявляются в мышцах и жировой ткани, поэтому эти ткани называют инсулинозависимыми. Уровень глюкозы крови снижается при воздействии инсулина и повышается при воздействии т.н. гипергликемических гормонов (глюкагона, соматотропного гормона, глюкокортикоидов).
Дополнительными эффектами инсулина являются увеличение интенсивности образования гликогена, уменьшение образования глюкозы в печени, усиление поглощения клетками аминокислот, необходимых для синтеза белка. Одновременно инсулин уменьшает разрушение белков и жиров. Таким образом, общий эффект инсулина является анаболическим – направленным на формирование жировой и мышечной ткани.
Строение инсулина
Инсулин является полипептидным гормоном, состоящим из двух аминокислотных цепей: А- и В-цепи. Полипептидные цепи соединяются дисульфидными мостиками. Человеческий инсулин по структуре близок к свиному и бычьему, хотя и отличается от них одним и тремя аминокислотными остатками соответственно.
Открытие инсулина
Островки поджелудочной железы были открыты в 1869 году Паулем Лангергансом при микроскопическом исследовании структуры поджелудочной железы. В 1889 году Оскар Малиновски в Германии при удалении поджелудочной железы у собаки вызвал у нее симптомы сахарного диабета. В 1921 году Ф. Бантинг и Ч. Бест выделили из клеток островков поджелудочной железы инсулин, а Д. Коллип разработал методику его очистки.
В 1922 году инсулин впервые был введен пациенту, страдающему сахарным диабетом. Его лечебное действие показало, что такой вид терапии является наиболее эффективным. В последующие годы основные усилия ученых были направлены на организацию производства в больших количествах. В 1923 году была вручена Нобелевская премия за открытие и выделение инсулина. В последующем аминокислотная структура инсулина была полностью расшифрована Ф. Сенгером.
Синтез инсулина
В островковых клетках поджелудочной железы инсулин синтезируется в несколько этапов. На первом этапе происходит синтез молекулы предшественника инсулина – препроинсулина. На втором этапе от молекулы препроинсулина отделяется сигнальный пептид, после чего образуется проинсулин. После созревания происходит образование окончательной молекулы инсулина. На этапе созревания от молекулы проинсулина отделяется С-пептид, который не оказывает биологического действия. После отделения С-пептида формируется активная форма инсулина.
Выделение инсулина в кровь происходит при повышении уровня глюкозы в крови. Дополнительно регуляция выработки инсулина производится автономной нервной системы. Разрушение инсулина происходит в печени и почках при воздействии фермента инсулиназы.
Препараты инсулина
В настоящее время фармацевтическая промышленность производит значительное число препаратов инсулина, имеющих различные биологические эффекты. Выделяют человеческий, свиной инсулины, инсулин крупного рогатого скота. По степени очистки различают традиционные, монопиковые, монокомпонентные инсулины. По времени действия выделяют инсулины короткого и пролонгированного действия. Последние делятся на инсулины среднего, длительного и сверхдлительного срока действия. Есть также инсулины ультракороткого и депо-инсулины, выделяющиеся медленно из подкожной клетчатки.
Подбор схемы инсулинотерапии – сложное и очень ответственное мероприятие. От правильности выбора формы инсулина и схемы его дозирования зависит успешность достижения компенсации сахарного диабета и, как следствие, качество жизни пациента.
Типы сахарного диабета
В настоящее время выделяется два основных типа сахарного диабета, различающиеся по причине и механизму появления, а также по принципам лечения
Сахарный диабет 1 типа
Сахарный диабет 2 типа
Гестационный сахарный диабет при беременности
Гестационный сахарный диабет может развиваться при беременности (примерно в 4% случаев). В его основе лежит снижение способности по усвоению глюкозы
Гипогликемия
Гипогликемией называют патологическое состояние, характеризующееся снижением концентрации глюкозы в плазме крови ниже уровня 2,8 ммоль/л, протекающее с определенной клинической симптоматикой, либо менее 2,2 ммоль/л независимо от наличия или отсутствия клинических признаков
Кома при сахарном диабете
Информация о наиболее опасном осложнении сахарного диабета, требующем экстренной медицинской помощи,- коме. Описываются виды ком при сахарном диабете, их специфические признаки, тактика лечения
Синдром диабетической стопы
О диабете
Сахарный диабет — термин, объединяющий эндокринные заболеваний, характерной чертой которых является недостаточность действия гормона инсулина. Главным симптомом сахарного диабета является развитие гипергликемии – увеличения концентрации глюкозы в крови, имеющее стойкий характер
Симптомы диабета
Эффективность лечения сахарного диабета напрямую зависит от времени выявления этого заболевания. При сахарном диабете 2 типа заболевание может длительное время вызывать лишь незначительно выраженные жалобы, на которые пациент может не обращать внимания. Симптомы диабета могут быть стертыми, что затрудняет диагностику. Чем раньше поставлен правильный диагноз и начато лечение, тем меньше риск развития осложнений сахарного диабета
Анализы в СПб
Одним из важнейших этапов диагностического процесса является выполнение лабораторных анализов. Чаще всего пациентам приходится выполнять анализ крови и анализ мочи, однако нередко объектом лабораторного исследования являются и другие биологические материалы.
Консультация эндокринолога
Специалисты Северо-Западного центра эндокринологии проводят диагностику и лечение заболеваний органов эндокринной системы. Эндокринологи центра в своей работе базируются на рекомендациях Европейской ассоциации эндокринологов и Американской ассоциации клинических эндокринологов. Современные диагностические и лечебные технологии обеспечивают оптимальный результат лечения.
Анализ на гликогемоглобин
Гликогемоглобин (гликированный гемоглобин, гликозилированный гемоглобин, гемоглобин А1с) – соединение гемоглобина с глюкозой, образующееся в эритроцитах
Отзывы
Истории пациентов
Видеоотзывы: опыт обращения в Северо-Западный центр эндокринологии
Какие гормоны продуцируются клетками островков лангерганса
Поджелудочная железа (лат. páncreas) – это орган в брюшной полости размером с ладонь, расположенный между желудком и позвоночником.
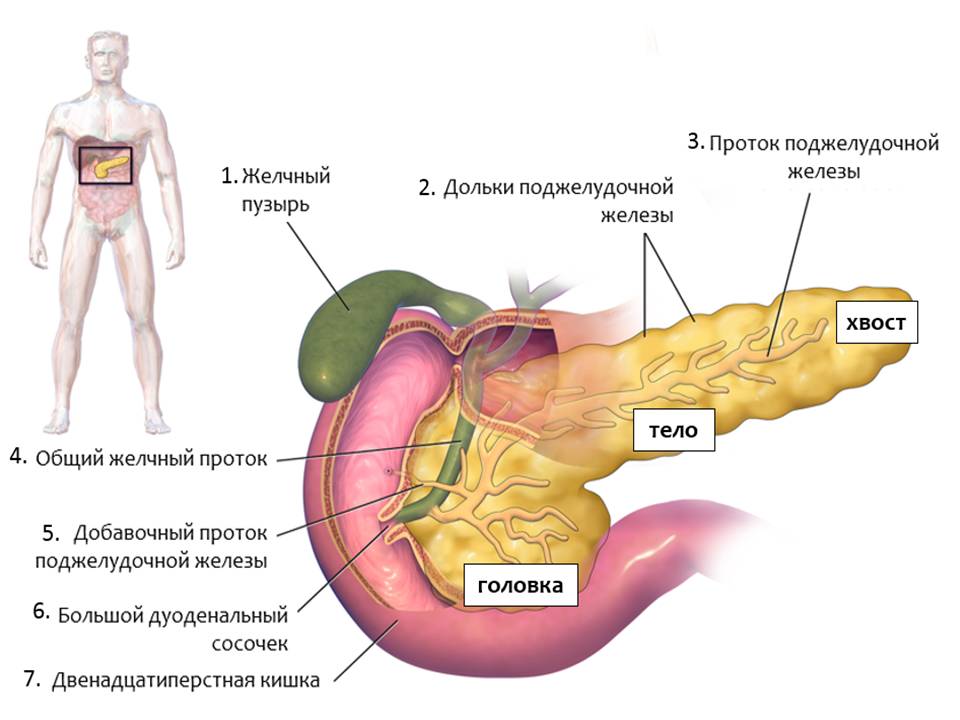
Рис. 1. Строение поджелудочной железы. Адапт. из Wikipedia
В поджелудочной железе выделяют три отдела: головку, тело, хвост (рис.1). Все отделы поджелудочной железы выполняют одинаковые функции, а именно:
Пищеварительные ферменты из поджелудочной железы попадают в кишечник через проток поджелудочной железы [3]. Проток поджелудочной железы[3] соединяется с общим желчным протоком [4], по которому идет желчь из желчного пузыря [1] и печени, и они впадают в двенадцатиперстную кишку[7] в области большого дуоденального сосочка[6]. Эта функция поджелудочной железы также называется экзокринная, то есть направленная наружу. Основная масса поджелудочной железы выполняет эту функцию.
Вторая функция поджелудочной железы – эндокринная функция, то есть направленная внутрь – это производство гормонов, контролирующих уровень глюкозы крови. Выполняют эту функцию отдельные группы клеток, их называют островки поджелудочной железы или островки Лангерганса. Во всей поджелудочной железе около 1 миллиона островков, что составляет 1-2% от общей массы поджелудочной железы. Они располагаются диффузно во всем объеме поджелудочной железы. В отличии от ферментов, которые синтезируются в проток поджелудочной железы и стекают в кишечник, клетки островков Лангерганса продуцируют гормоны непосредственно в кровь, а именно в мелкие кровеносные сосуды, проходящие через поджелудочную железу.
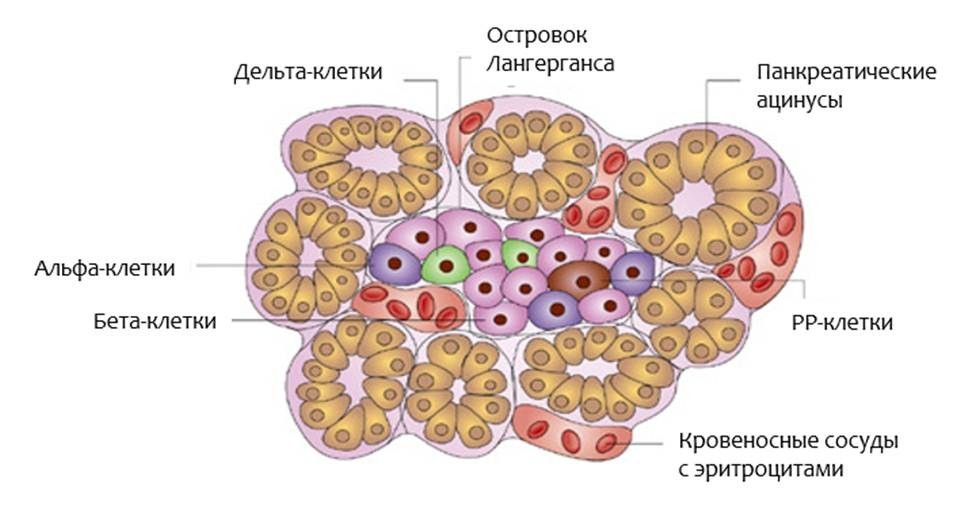
Если вы посмотрите на островок Лангерганса через микроскоп (рис.2), вы найдете в нем:
Бета-клетки содержат своего рода «встроенный» глюкометр. Если уровень глюкозы крови повышается, то они выпускают инсулин. Если уровень глюкозы крови снижается, то секреция инсулина прекращается. Если уровень глюкозы падает ниже нормального уровня, то альфа-клетки высвобождают глюкагон. Другие гормоны, вырабатывающиеся клетками островков Лангерганса, нужны для того, чтобы островковые клетки взаимодействовали друг с другом. Островки Лангерганса являются очень маленькими, примерно 0,1 мм в диаметре. Все островки взрослого человека содержат приблизительно 200 единиц инсулина. Объем их всех в сочетании не больше, чем кончик пальца. Инсулин является гормоном, который помогает организму усваивать и использовать глюкозу и другие питательные вещества. Он как «ключ, открывающий двери» для глюкозы внутрь клетки. Без инсулина, уровень глюкозы крови повышается (подробнее об инсулине в разделе Инсулин и его значение для организма).
Роль поджелудочной железы в развитии сахарного диабета
Для того чтобы разобраться в этом вопросе, рассмотрим каждый тип сахарного диабета отдельно.
Сахарный диабет 1 типа
При сахарном диабете 1 типа происходит гибель бета-клеток, следовательно, поджелудочная железа не производит или производит незначительное количество инсулина. Сахарный диабет 1 типа обычно развивается, когда иммунная система разрушает бета-клетки поджелудочной железы. Это называется аутоиммунный ответ. Собственная иммунная система воспринимает бета-клетки как инородные объекты, такие как бактерии или вирусы, и начинает их атаковать и разрушать. Когда более 90% бета-клеток разрушаются (этот процесс занимает от нескольких месяцев до максимум нескольких лет), организм начинает ощущать нехватку инсулина, и уровень глюкозы крови повышается. Тогда у человека появляются «большие» симптомы сахарного диабета, такие как жажда, учащенное мочеиспускание, похудание. Раньше этот тип сахарного диабета называли инсулин-зависимый сахарный диабет. Это значит, что для лечения необходим инсулин сразу, как только поставили диагноз.
На данный момент остается неизвестным, почему возникает этот аутоиммунный ответ. Генетически человеку может передаться склонность к аутоиммунным заболеваниям (сахарный диабет 1 типа является только одним из многих аутоиммунных заболеваний), но вот что именно служит пусковым механизмом, триггером сахарного диабета 1 типа, пока что недостаточно ясно. (Подробней об этом вы можете узнать в разделе Причины сахарного диабета 1 типа).
Сахарный диабет 2 типа
При сахарном диабете 2 типа способность поджелудочной железы вырабатывать инсулин не исчезает полностью. Но организм становится все более устойчивым (резистентным) к инсулину. То есть создается ситуация, когда нормальный уровень инсулина крови не может «открыть глюкозе дверь в клетку». Следовательно, если организм не реагирует на нормальный уровень инсулина крови, то поджелудочной железе приходится вырабатывать все больше и больше инсулина. И если на этот процесс никак не повлиять, то это приведет к истощению поджелудочной железы и абсолютной недостаточности инсулина.
Причины сахарного диабета 2 типа – это комплекс генетических факторов и условий окружающей среды. Генетически человек наследует группу генов предрасположенности к сахарному диабету 2 типа, и чаще всего у человека с СД 2 типа есть родственники с СД 2 типа. Также некоторые этнические группы имеют более высокую предрасположенность к этому заболеванию. Но разовьётся сахарный диабет 2 типа или нет зависит от самого человека, от его образа жизни. На это влияет характер питания, уровень физической активности и т.д. (Подробней об этом вы можете узнать в разделе Причины сахарного диабета 2 типа).
Таблетки, используемые для лечения сахарного диабета 2 типа, не содержат инсулин, они действуют либо путем увеличения чувствительности организма к инсулину, либо путем увеличения секреции инсулина из поджелудочной железы. Диета и снижение избыточного веса (если он есть), также являются основными компонентами лечения сахарного диабета 2 типа. Редко, когда инъекции инсулина необходимым на ранних стадиях сахарного диабета 2 типа. Но при истощении поджелудочной железы инсулинотерапия может стать необходимым компонентом лечения сахарного диабета 2 типа.
Гестационный сахарный диабет
Эта форма диабета возникает во время беременности и в большинстве случаев проходит после рождения ребенка.
В течение всей беременности плацента вырабатывает гормоны, которые препятствуют нормальной работе инсулина (они повышают резистентность к инсулину). Как правило, поджелудочная железа может просто увеличить количество производимого инсулина, и у женщины будет нормальный уровень глюкозы крови. Иногда, однако, поджелудочная железа не может компенсировать потребность организма в инсулине, и тогда у женщины повышается уровень глюкозы крови и развивается гестационный сахарный диабет.
Все беременные женщины должны быть обследованы на наличие гестационного сахарного диабета. Важно распознавать и лечить гестационный сахарный диабет как можно скорее, чтобы свести к минимуму риск осложнений у ребенка. (Подробней об этом вы можете узнать в разделе Гестационный сахарный диабет).
Какие гормоны выделяет поджелудочная железа?
Поджелудочная железа секретирует в кровь гормоны инсулин и глюкагон. Именно в хвосте поджелудочной железы сосредоточены так называемые островки Лангерганса, объединяющие клетки с эндокринной функцией.
Островками Лангерганса называют скопления эндокринных клеток, продуцирующих гормоны. Состоят из α-клеток, выделяющих глюкагон, и β-клеток, выделяющих инсулин. Оба эти гормона влияют на обмен углеводов, однако, действие у них противоположное.
Глюкагон напротив, способствует расщеплению гликогена в клетках и выходу глюкозы в кровь. В результате действия глюкагона сахар (глюкоза) в крови повышается. Запомните мнемоническое выражение: Глюкагон «Гонит» глюкозу в кровь.
Инсулин выделяется наиболее активно после приема пищи, когда в кровь всасываются моносахариды, аминокислоты, жирные кислоты. Выделение глюкагона активируется при голодании, когда для поддержания работы организма требуется повысить уровень глюкозы в крови.
В островках Лангерганса есть особые δ-клетки (дельта-клетки), которые секретируют гормон соматостатин. Соматостатин угнетает выработку гормона роста (соматотропного гормона гипофиза) и синтез ферментов в экзокринной части поджелудочной железы, синтез инсулина и глюкагона α и β клетками.
P.S.S. Для вас готов следующий случайный вопрос. Мы сами не знаем, но вас ждет что-то интересное!
© Беллевич Юрий Сергеевич 2018-2021
Текст и опубликованные материалы являются интеллектуальной собственностью Беллевича Юрия Сергеевича. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов вопроса и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Какие гормоны продуцируются клетками островков лангерганса
РОЛЬ ЩИТОВИДНОЙ, ПАРАЩИТОВИДНЫХ ЖЕЛЕЗ И ЭНДОКРИННЫХ КЛЕТОК ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ В РЕГУЛЯЦИИ ВОДНО-ЭЛЕКТРОЛИТНОГО ОБМЕНА В НОРМЕ И ПАТОЛОГИИ
Роль тиреоидных гормонов в регуляции баланса воды и электролитов
Клетки фолликулярного эпителия щитовидной железы синтезируют преимущественно тироксин и в значительно меньшей степени трийодтиронин. Около 87% йодированных гормонов крови приходится на тироксин и лишь 13% – на трийодтиронин. Последний в основном образуется в тканях в процессе дейодирования тироксина под влиянием дейодиназ.
Тиреокальцитонин и кокальцигенин продуцируются парафолликулярными С-клетками щитовидной железы. Кальцитонин является физиологическим антагонистом паратиреокренина и обеспечивает снижение уровня кальция в крови. Кокальцигенин вызывает развитие тахикардии и гипотензии.
Спектр биологических эффектов тироксина и трийодтиронина чрезвычайно широк, а рецепторы к этим гормонам имеются практически во всех органах и тканях. Тиреоидные гормоны оказывают положительные хроно- и инотропные эффекты на сердце, вызывают развитие липолиза, ускорение газообмена в легких, увеличение кровотока, фильтрации в почках и, соответственно, диуреза, стимулируют окислительно-восстановительные реакции во многих органах и тканях. Выраженные нарушения метаболического статуса, в частности водно-электролитного баланса, возникают в условиях функционального гипо- и гипертиреоза.
Следует отметить, что синдромы дисфункции щитовидной железы в ряде случаев сочетаются с развитием дисплазии. Примерно у 10% больных с гипо- или гипертиреоидным состоянием гормональный дисбаланс связан с нарушением транспорта гормонов, тканевой конверсией Т4 в Т3, или их рецепции «клетками-мишенями».
Гипертиреоз в 95% случаев носит первичный характер и лишь в 5% является следствием дисфункции гипоталамо-гипофизарной системы. Наиболее частыми причинами гипертиреоза являются воспалительно-деструктивные процессы в щитовидной железе аутоиммунной, инфекционной природы, развитие доброкачественных и злокачественных опухолей железы. В ряде случаев гипертиреоз возникает как следствие нарушений экологии или ятрогенных вмешательств. Формирование диффузного токсического зоба (болезнь фон Базедова) связывают с развитием системного или мультиорганного аутоиммунного заболевания, встречается примерно у 1% населения в различных странах. Ведущим патогенетическим фактором болезни Базедова является продукция тиреостимулирующих антител класса Ig G, связывающихся с рецепторами тиреоцитов для ТТГ. Важнейшими элементами болезни Базедова являются наличие диффузного токсического зоба, миокардиопатии и экзофтальма, а также тяжелые нарушения всех обменных процессов.
Поражение сердца при указанной патологии характеризуется тахикардией, мерцательной аритмией, интенсивным поступлением кальция в миокардиоциты, приводящим к развитию сердечной недостаточности.
Гиперпродукция гормонов щитовидной железы различного генеза сопровождается определенными изменениями функции различных органов и систем с соответствующим нарушением водно-электролитного баланса. Так, при гипертиреозах возникает усиление потери жидкости с выдыхаемым воздухом в связи с развитием гипервентиляции легких. В то же время отмечаются гипосекреция желудочного сока, усиление перистальтики и ускорение эвакуации пищи, склонность к поносам, снижение мочевыделительной функции почек, некоторое увеличение объема циркулирующей крови за счет выброса депонированной крови и активации гемопоэза.
Различают первичный, вторичный и третичный гипотиреоз. Первичный гипотиреоз может быть врожденным или приобретенным, проявляться выраженными нарушениями психоинтеллектуального и общесоматического развития (кретинизм, синдром Фагге). Первичный гипотиреоз как следствие поражения щитовидной железы развивается в 95% случаев, гипотиреоз гипоталамо-гипофизарного происхождения – в 5% наблюдений.
Первичный приобретенный гипотиреоз имеет полиэтиологическую природу. Различают хронический аутоиммунный тиреоидит (болезнь Хашимото), надпочечниковую микседему, ятрогенный гипотиреоз, эндемический йоддефицитный зоб и другие формы патологии.
Поздняя форма приобретенного гипотиреоза у подростков и взрослых (синдром Галла, кретиноидное состояние) характеризуется развитием микседемы, менее глубокими и зачастую обратимыми метаболическими и функциональными расстройствами.
Характерными особенностями нарушения водно-электролитного баланса при дефиците тиреоидных гормонов являются снижение продукции предсердного натрийуретического фактора, задержка натрия и воды в организме, замедление распада гликозаминогликанов в тканях, что приводит к повышению их гидрофильности. При этом возникает скопление воды в коже, подкожной клетчатке, голосовых связках, языке, ряде внутренних органов, что проявляется слизистым отеком, утолщением кожи, огрубением лица, увеличением языка, низким хриплым тембром. Одновременно развивается водянка серозных полостей, расширяются границы сердца, подавляется обмен веществ, возникает гипотермия. В основе развития микседемы во многих случаях лежат аутоиммунные механизмы. К числу метаболических расстройств при ранней форме гипотиреоза относят желтуху новорожденных, замедление роста костей, ожирение, гиперхолестеринемию, снижение обменных процессов.
В ряде случаев гипотиреоз сочетается с клинически выраженными признаками гипокортицизма, что, естественно, проявляется интенсивной потерей натрия и воды, избыточной задержкой калия и протонов в дистальных сегментах почек, развитием гипонатриемии, гиперкалиемии и далее гипотонии, гипергликемии, расстройством функций желудочно-кишечного тракта.
Паратиреокринин (паратирин) и тиреокальцитонин как важнейшие регуляторы кальций-фосфорно-магниевого обмена в норме и патологии
Регуляция кальций-фосфорного обмена обеспечивается различными органами, тканями, эндокринными железами. Основными регуляторами обмена кальция являются гормоны паращитовидных и щитовидной желез.
Паратиреокринин синтезируется главными клетками паращитовидных желез в виде препрогормона, его процессинг обеспечивается ферментом фурином. Стимуляция секреции гормона возникает в ответ на снижение содержания в крови ионизированного (свободного) кальция, магния, а также на фоне гиперфосфатемии.
Секреция паратгормона подавляется под влиянием активной формы витамина D (кальцитриола). Дополнительную стимулирующую роль в паратиреоидной секреции гормона играет активация β-адренергических и гистаминергических влияний на Н2-рецепторы. Секреция готового гормона ингибируется через α-адренорецепторы. Физиологическим антагонистом паратгормона является кальцитонин – гормон С-клеток щитовидной железы.
Биологические эффекты паратирина в здоровом организме проявляются в виде активации остеокластов и усиления мобилизации кальция из костной ткани при одновременной стимуляции остеобластов и, соответственно, остеогенеза. Тем не менее на фоне действия паратирина в условиях нормы эффект развития остеолиза преобладает над остеосинтезом. Паратирин увеличивает всасывание кальция и магния в желудочно-кишечном тракте, в дистальных канальцах нефронов, стимулирует образование кальцитриола (активной формы витамина D), усиливает экскрецию фосфатов с мочой, снижает реабсорбцию сульфатов, бикарбонатов, аминокислот, хлоридов в почках. В связи с этим паратирин в избыточных концентрациях вызывает развитие выделительного ацидоза.
Тиреокальцитонин (кальцитонин) – гормон С-клеток щитовидной железы, входящих в так называемую АПУД-систему. Гормон селективно рецептируется клетками костной ткани, восходящего сегмента петли Генле в почках, слизистой желудочно-кишечного тракта. Биологические эффекты кальцитонина проявляются в подавлении остеолиза, реабсорбции кальция, фосфатов, натрия, калия и магния в почках.
Содержание кальция в условиях нормы в крови составляет 0,09-0,10 г/л или 2,2-2,6 ммоль/л. Содержание фосфатов в крови в норме составляет 9-13 мМ/л.
Выраженные нарушения баланса кальция, магния, фосфора возникают при гипо- и гиперпаратиреозах.
Гипопаратиреоз является ведущим патогенетическим фактором развития гипокальциемии и судорожного синдрома. Однако формирование гипокальциемии и тетании имеет место при алкалозах, нарушении всасывания кальция в кишечнике, при патологии почек и т.д. Гипокальциемия в условиях абсолютной или относительной недостаточности паратгормона нередко сочетается с гиперфосфатемией.
Гипокальциемия может носить острый или хронический характер. Острая гипокальциемия может возникать в результате ятрогенных причин и после удаления паращитовидных желез в процессе тиреоидэктомии, при переливании цитратной крови, под влиянием ряда кальций-связывающих препаратов (гепарин, ЭДТА), в полиурическую стадию острой почечной недостаточности, при диареи.
Хроническая гипокальциемия возникает в условиях наследственного или приобретенного гипопаратиреоза, при периферической резистентности органов-мишеней к действию гормона, а также при быстрой потере внеклеточного кальция. Последнее имеет место, в частности, при синдроме массированного цитолиза (гепатолиз, гемолиз, прием цитостатиков, шок, почечная недостаточность, интоксикации различного генеза).
Гипокальциемия патогенетически связана с развитием гиперфосфатемии, которая возникает при всех указанных формах патологии, приводящих к абсолютной или относительной недостаточности кальция.
Гиперкальциемия встречается значительно чаще гипокальциемии как проявление первичного гиперпаратиреоза, почечной недостаточности, гипервитаминоза D, продуцирующих полипептид, ассоциированный с геном паратиреокринина.
Первичный гиперпаратиреоз (болезнь Реклингаузена) связан с усилением продукции паратирина, характеризуется развитием фиброзно-кистозной остеодистрофии. Под влиянием паратирина возникает усиление мобилизации кальция из костной ткани, что приводит к деформации костей, патологическим переломам, оссалгиям.
Первичный гиперпаратиреоз характеризуется гиперкальциемией, гиперкальциурией, гипофосфатемией, высокой активностью щелочной фосфатазы остеокластического происхождения в крови.
Гиперкальциемия сопровождается развитием нефрокальциноза, снижением чувствительности рецепторов нефронов к действию АДГ и, соответственно, развитием симптоматики несахарного диабета в виде полиурии, гипоизостенурии, полидипсии. Гиперкальциемия нередко сочетается с развитием уролитиаза, калькулезного холецистита, язвенной болезни желудка и 12-перстной кишки, кальцификацией сосудов, гипертензией.
К проявлениям гиперкальциемии относятся тошнота, рвота, анорексия, утомляемость, слабость, депрессия, ухудшение памяти. Острая тяжелая форма гиперкальциемии может быть причиной развития комы.
Роль инсулина в регуляции водно-солевого гомеостаза в условиях нормы и патологии
Инсулин является важнейшим гормоном регуляции углеводного обмена и в то же время играет важную роль в метаболизме жиров, белков и, соответственно, в формировании водно-солевого гомеостаза.
Источником синтеза инсулина являются В-клетки островков Лангерганса, составляющиеся около 75% указанных структур и около 1% всех клеток поджелудочной железы. Синтез инсулина усиливается глюкозой, рибозой, фруктозой, аргинином, лейцином, а подавляется на фоне гипогликемии, гипоаминоацидемии, а также под влиянием катехоламинов.
Стимулирующим влиянием на синтез инсулина обладают контринсулярные гормоны: АКТГ, СТГ, тиреоидные гормоны, глюкагон. Однако на фоне действия избыточных концентраций указанных гормонов достаточно быстро возникает абсолютная или относительная недостаточность инсулина в связи с истощением В-клеток или антагонизирующим инсулину действием гормонов на периферические органы и ткани.
В соответствии с чувствительностью к действию инсулина все органы и ткани условно делятся на три категории:
1) инсулинзависимые (кожа, жировая, соединительная, мышечная, костная ткани, лимфоидные клетки костного мозга, сосудистая стенка, лейкоциты крови, желудочно-кишечный тракт);
2) инсулиннезависимые (центральная нервная система, сетчатка глаза, эритроциты);
3) органы со смешанным типом регуляции (сердце, печень, почки).
Касаясь биологических эффектов инсулина, следует отметить, что гормон увеличивает проницаемость клеточных мембран для глюкозы, аминокислот, жирных кислот, кетоновых тел, натрия, калия, фосфора.
В жировой ткани инсулин активирует пиноцитоз, обеспечивающий переход межклеточной жидкости в липоциты.
Инсулин активирует процессы гликогенеза, фосфорилирования глюкозы, окисления глюкозы и продуктов ее превращения в пентозном цикле и цикле Кребса. Инсулин обладает выраженным анаболическим эффектом.
Дефицит инсулина в организме приводит к тяжелым метаболическим сдвигам, проявляющимся прежде всего в виде гипергликемии, глюкозурии, полиурии и полидипсии. Как известно, указанный симптомокомплекс возникает при первичном сахарном диабете I и II типов, а также вторичном симптоматическом сахарном диабете.
Сахарный диабет I типа – наследственная форма патологии, связанная с аутоиммунным поражением В-клеток островков Лангерганса.
Сахарный диабет II типа – заболевание с полигенным типом наследования, в основе которого чаще всего лежит снижение чувствительности клеток-мишеней инсулинзависимых тканей к инсулину или рецепторов В-клеток островков Лангерганса к глюкозе.
Вторичный симптоматический сахарный диабет формируется при панкреатитах не аутоиммунной природы, поликистозе, гемохроматозе поджелудочной железы, избыточной продукции контринсулярных гормонов, при болезни и синдроме Иценко-Кушинга, феохромоцитоме, глюкагономе, гипертиреозе, акромегалии и гигантизме, тяжелых стрессорных ситуациях и т.д.
В условиях абсолютного или относительного дефицита инсулина снижается проницаемость мембран клеток для глюкозы, подавляется метаболизм глюкозы в пентозном цикле и цикле Кребса, усиливается мобилизация глюкозы в кровь за счет активации ферментов фосфорилазы и глюкозо-6-фосфатазы. Нарушение вовлечения ацетил-СоА в цикл трикарбоновых кислот приводит к избыточному образованию кетоновых тел, промежуточных продуктов распада жиров и белков в тканях. С мочой выделяется большее количество осмотически активных соединений: глюкозы, кетоновых тел, электролитов (натрия и калия); возникают полиурия, обезвоживание, которые частично компенсируются полидипсией. Полиурия может достигать 3–10 л в сутки. Однако следует отметить, что полиурия возникает у 73% больных, полидипсия – у 64%, нарастающая слабость – у 64%. Большинство нелеченых больных теряют в весе. Дефицит инсулина, как правило, сочетается с подавлением секреторной активности слюнных желез, желудка при одновременном формировании диареи. Частый стул и обезвоживание организма способствуют развитию кетоацидоза, поскольку вместе с кишечным содержимым удаляется значительное количество щелочно-реагирующих электролитов (натрия, калия, кальция, магния).
Тяжелыми осложнениями сахарного диабета являются метаболические расстройства (лактацидоз, кетоацидоз – чаще при сахарном диабете I типа), приводящие к развитию коматозных состояний. В ряде случаев возможно развитие гиперосмолярного или гипогликемического коматозных состояний. Прогрессирующее нарушение метаболизма углеводов, белков, жиров и, соответственно, водно-солевого гомеостаза сопровождается универсальным поражением сосудов различных органов и тканей – развитием диабетической ангиопатии. Тяжелые расстройства васкуляризации и трофики тканей при сахарном диабете определяют формирование таких осложнений, как инфаркт миокарда, гипертония, диабетическая энцефалопатия, офтальмопатия, нефропатия и других форм патологии.