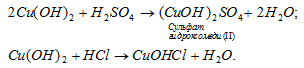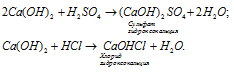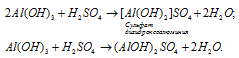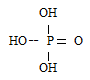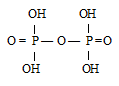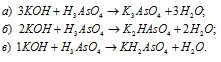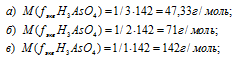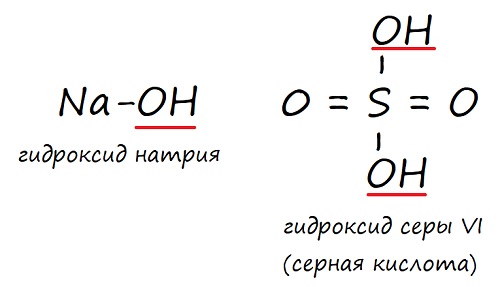какие гидроксиды образуют основные соли
Решение задач по химии на строение и свойства гидроксидов, солей и оксидов
Задача 165.
Какие из указанных гидроксидов могут образовать основные соли: а) Cu(OH)2; б) Ca(OH)2; в) LiOH; г) Al(OH)3; д) KOH.
Решение:
а) Гидроксид меди (II) Cu(OH)2 – двухкислотный гидроксид, поэтому может образовать основные соли, например сульфат гидроксомеди (II) или хлорид гидроксомеди (II), например:
Ответ: а), б), г).2
Задача 166.
Ангидридом какой кислоты является Р2О5: а) фосфористой; б) двуфосфорной; в) ортофосфорной?
Решение:
Оксид фосфора Р2О5 является ангидридом ортофосфорной кислоты Н3РО4 и двуфосфорной кислоты Н4Р2О7. При взаимодействии с водой оксид фосфора (V) образует ортофосфорную и полифосфоные кислоты (в кристаллическом состоянии выделена только простейшая двуфосфорная кислота):
Структурная формула ортофосфорной кислоты H3PO4:
Структурная формула двуфосфорной кислоты Н4Р2О7:
Таким образом, двуфосфорная кислота представляет собой продукт соединения двух тетраэдров РО4-.
Ангидридом фосфористой кислоты H3PO3 является оксид фосфора (III) Р2О3, который под действием холодной воды медленно взаимодействует с ней, образуя кислоту:
Ответ: а; б.
Задача 167.
Ангидридом какой кислоты можно считать С12О7: а) хлорной; б) хлорноватой; в) хлорноватистой?
Решение:
а) Оксид хлора (VII) С12О7 можно считать ангидридом хлорной кислоты HClO4, потому что если нагреть хлорную кислоту в присутствии Р2О5, отнимающим воду, то образуется оксид хлора (VII):
Оксид хлора (VII) С12О7 c водой не смешивается, их взаимодействие происходит на границе раздела фаз, при этом образуется хлорная кислота:
В соединениях С12О7 и HClO4 атом хлора находится в своей степени окисления +7.
б) Ангидрид хлорноватой кислоты HClO3 не известен. При действии концентрированной серной кислоты на соль хлорноватой кислоты KClO3 вместо него выделяется жёлто-бурый газ с характерным запахом – оксид хлора (IV) ClO2.
в) Ангидридом хлорноватистой кислоты HOCl можно считать оксид хлора (I) Cl2O, потому что в водных растворах кислоты устанавливается два равновесия:
Ответ: а).
Ответ: б), в).
Задача 169.
В реакции нейтрализации гидроксида калия ортомышьяковой кислотой эквивалентная масса последней оказалась равной 142 г/моль. Какая соль при этом образовалась: а) ортоарсенат калия; б) гидроортоарсенат калия; в) дигидроортоарсенат калия?
Решение:
Мольная масса ортомышьяковой кислоты равнв 142г/моль.
Уравнения реакций образования :
Так как по условию задачи эквивалентная масса кислоты равна 142г/моль, что соответствует реакции в), то образовалась соль – дигидроортоарсенат калия.
Ответ: в).
Ответ: в).
а) ВаСI2 – хлорид бария – соль соляной кислоты HCl, её соли называются хлоридами.
в) Ва(ClO3)2 – хлорат бария – соль хлорноватой кислоты HClO3.
г) Ва(СIО2)2 – хлорит бария – соль хлористой кислоты HClO2, её соли называются хлоритами.
Ответ: в).
б) Основная соль образуются при неполном замещении гидроксогрупп основания на кислотный остаток. Основная соль может быть образована металлом, валентность которого равна двум или больше в тех случаях, когда для реакции взято в избытке основание, например:
Ответ: б).
Задача 173.
Какая соль образуется при взаимодействии 1 моля гидроксида цинка и 2 молей ортофосфорной кислоты: а) ортофосфат цинка; б) дигидроортофосфат цинка; в) ортофосфат гидроксоцинка; г) гидроортофосфат цинка?
Решение:
а) Уравнение реакции получения ортофосфата цинка:
б) Уравнение реакции получения дигидроортофосфата цинка:
в) Уравнение реакции получения ортофосфата гидроксоцинка:
г) Уравнение реакции получения гидроортофосфата цинка:
Таким образом, из 1 моля гидроксида цинка и 2 молей орптофосфорной кислоты образуется 1 моль дигидроортофосфата цинка.
Ответ: б).
Задача 174.
Какое взаимодействие приведет к получению нормальной соли из хлорида гидроксомагния: a) MgOHCl + NaOH; б) MgOHClO3 + NaOH; в) MgOHClO3 + HCl; г) MgOHCl + HCl?
Решение:
а) В водных растворах MgOHCl и NaOH как сильные электролиты распадаются на ионы:
б) В водных растворах MgOHClO3 и NaOH как сильные электролиты распадаются на ионы:
Ионы Mg2+, OH-, ClO3- и Na+ не связываются друг с другом и с ионами H+ с образованием осадка, газа или слабого электролита, поэтому данная реакция не идёт.
в) В водных растворах MgOHCjO3 и HCl как сильные электролиты распадаются на ионы:
г) В водных растворах MgOHCl и HCl как сильные электролиты распадаются на ионы:
Решение задач по химии на строение и свойства гидроксидов, солей и оксидов
Задача 165.
Какие из указанных гидроксидов могут образовать основные соли: а) Cu(OH)2; б) Ca(OH)2; в) LiOH; г) Al(OH)3; д) KOH.
Решение:
а) Гидроксид меди (II) Cu(OH)2 – двухкислотный гидроксид, поэтому может образовать основные соли, например сульфат гидроксомеди (II) или хлорид гидроксомеди (II), например:
Ответ: а), б), г).2
Задача 166.
Ангидридом какой кислоты является Р2О5: а) фосфористой; б) двуфосфорной; в) ортофосфорной?
Решение:
Оксид фосфора Р2О5 является ангидридом ортофосфорной кислоты Н3РО4 и двуфосфорной кислоты Н4Р2О7. При взаимодействии с водой оксид фосфора (V) образует ортофосфорную и полифосфоные кислоты (в кристаллическом состоянии выделена только простейшая двуфосфорная кислота):
Структурная формула ортофосфорной кислоты H3PO4:
Структурная формула двуфосфорной кислоты Н4Р2О7:
Таким образом, двуфосфорная кислота представляет собой продукт соединения двух тетраэдров РО4-.
Ангидридом фосфористой кислоты H3PO3 является оксид фосфора (III) Р2О3, который под действием холодной воды медленно взаимодействует с ней, образуя кислоту:
Ответ: а; б.
Задача 167.
Ангидридом какой кислоты можно считать С12О7: а) хлорной; б) хлорноватой; в) хлорноватистой?
Решение:
а) Оксид хлора (VII) С12О7 можно считать ангидридом хлорной кислоты HClO4, потому что если нагреть хлорную кислоту в присутствии Р2О5, отнимающим воду, то образуется оксид хлора (VII):
Оксид хлора (VII) С12О7 c водой не смешивается, их взаимодействие происходит на границе раздела фаз, при этом образуется хлорная кислота:
В соединениях С12О7 и HClO4 атом хлора находится в своей степени окисления +7.
б) Ангидрид хлорноватой кислоты HClO3 не известен. При действии концентрированной серной кислоты на соль хлорноватой кислоты KClO3 вместо него выделяется жёлто-бурый газ с характерным запахом – оксид хлора (IV) ClO2.
в) Ангидридом хлорноватистой кислоты HOCl можно считать оксид хлора (I) Cl2O, потому что в водных растворах кислоты устанавливается два равновесия:
Ответ: а).
Ответ: б), в).
Задача 169.
В реакции нейтрализации гидроксида калия ортомышьяковой кислотой эквивалентная масса последней оказалась равной 142 г/моль. Какая соль при этом образовалась: а) ортоарсенат калия; б) гидроортоарсенат калия; в) дигидроортоарсенат калия?
Решение:
Мольная масса ортомышьяковой кислоты равнв 142г/моль.
Уравнения реакций образования :
Так как по условию задачи эквивалентная масса кислоты равна 142г/моль, что соответствует реакции в), то образовалась соль – дигидроортоарсенат калия.
Ответ: в).
Ответ: в).
а) ВаСI2 – хлорид бария – соль соляной кислоты HCl, её соли называются хлоридами.
в) Ва(ClO3)2 – хлорат бария – соль хлорноватой кислоты HClO3.
г) Ва(СIО2)2 – хлорит бария – соль хлористой кислоты HClO2, её соли называются хлоритами.
Ответ: в).
б) Основная соль образуются при неполном замещении гидроксогрупп основания на кислотный остаток. Основная соль может быть образована металлом, валентность которого равна двум или больше в тех случаях, когда для реакции взято в избытке основание, например:
Ответ: б).
Задача 173.
Какая соль образуется при взаимодействии 1 моля гидроксида цинка и 2 молей ортофосфорной кислоты: а) ортофосфат цинка; б) дигидроортофосфат цинка; в) ортофосфат гидроксоцинка; г) гидроортофосфат цинка?
Решение:
а) Уравнение реакции получения ортофосфата цинка:
б) Уравнение реакции получения дигидроортофосфата цинка:
в) Уравнение реакции получения ортофосфата гидроксоцинка:
г) Уравнение реакции получения гидроортофосфата цинка:
Таким образом, из 1 моля гидроксида цинка и 2 молей орптофосфорной кислоты образуется 1 моль дигидроортофосфата цинка.
Ответ: б).
Задача 174.
Какое взаимодействие приведет к получению нормальной соли из хлорида гидроксомагния: a) MgOHCl + NaOH; б) MgOHClO3 + NaOH; в) MgOHClO3 + HCl; г) MgOHCl + HCl?
Решение:
а) В водных растворах MgOHCl и NaOH как сильные электролиты распадаются на ионы:
б) В водных растворах MgOHClO3 и NaOH как сильные электролиты распадаются на ионы:
Ионы Mg2+, OH-, ClO3- и Na+ не связываются друг с другом и с ионами H+ с образованием осадка, газа или слабого электролита, поэтому данная реакция не идёт.
в) В водных растворах MgOHCjO3 и HCl как сильные электролиты распадаются на ионы:
г) В водных растворах MgOHCl и HCl как сильные электролиты распадаются на ионы:
Решение задач по химии на строение и свойства гидроксидов, солей и оксидов
Задача 165.
Какие из указанных гидроксидов могут образовать основные соли: а) Cu(OH)2; б) Ca(OH)2; в) LiOH; г) Al(OH)3; д) KOH.
Решение:
а) Гидроксид меди (II) Cu(OH)2 – двухкислотный гидроксид, поэтому может образовать основные соли, например сульфат гидроксомеди (II) или хлорид гидроксомеди (II), например:
Ответ: а), б), г).2
Задача 166.
Ангидридом какой кислоты является Р2О5: а) фосфористой; б) двуфосфорной; в) ортофосфорной?
Решение:
Оксид фосфора Р2О5 является ангидридом ортофосфорной кислоты Н3РО4 и двуфосфорной кислоты Н4Р2О7. При взаимодействии с водой оксид фосфора (V) образует ортофосфорную и полифосфоные кислоты (в кристаллическом состоянии выделена только простейшая двуфосфорная кислота):
Структурная формула ортофосфорной кислоты H3PO4:
Структурная формула двуфосфорной кислоты Н4Р2О7:
Таким образом, двуфосфорная кислота представляет собой продукт соединения двух тетраэдров РО4-.
Ангидридом фосфористой кислоты H3PO3 является оксид фосфора (III) Р2О3, который под действием холодной воды медленно взаимодействует с ней, образуя кислоту:
Ответ: а; б.
Задача 167.
Ангидридом какой кислоты можно считать С12О7: а) хлорной; б) хлорноватой; в) хлорноватистой?
Решение:
а) Оксид хлора (VII) С12О7 можно считать ангидридом хлорной кислоты HClO4, потому что если нагреть хлорную кислоту в присутствии Р2О5, отнимающим воду, то образуется оксид хлора (VII):
Оксид хлора (VII) С12О7 c водой не смешивается, их взаимодействие происходит на границе раздела фаз, при этом образуется хлорная кислота:
В соединениях С12О7 и HClO4 атом хлора находится в своей степени окисления +7.
б) Ангидрид хлорноватой кислоты HClO3 не известен. При действии концентрированной серной кислоты на соль хлорноватой кислоты KClO3 вместо него выделяется жёлто-бурый газ с характерным запахом – оксид хлора (IV) ClO2.
в) Ангидридом хлорноватистой кислоты HOCl можно считать оксид хлора (I) Cl2O, потому что в водных растворах кислоты устанавливается два равновесия:
Ответ: а).
Ответ: б), в).
Задача 169.
В реакции нейтрализации гидроксида калия ортомышьяковой кислотой эквивалентная масса последней оказалась равной 142 г/моль. Какая соль при этом образовалась: а) ортоарсенат калия; б) гидроортоарсенат калия; в) дигидроортоарсенат калия?
Решение:
Мольная масса ортомышьяковой кислоты равнв 142г/моль.
Уравнения реакций образования :
Так как по условию задачи эквивалентная масса кислоты равна 142г/моль, что соответствует реакции в), то образовалась соль – дигидроортоарсенат калия.
Ответ: в).
Ответ: в).
а) ВаСI2 – хлорид бария – соль соляной кислоты HCl, её соли называются хлоридами.
в) Ва(ClO3)2 – хлорат бария – соль хлорноватой кислоты HClO3.
г) Ва(СIО2)2 – хлорит бария – соль хлористой кислоты HClO2, её соли называются хлоритами.
Ответ: в).
б) Основная соль образуются при неполном замещении гидроксогрупп основания на кислотный остаток. Основная соль может быть образована металлом, валентность которого равна двум или больше в тех случаях, когда для реакции взято в избытке основание, например:
Ответ: б).
Задача 173.
Какая соль образуется при взаимодействии 1 моля гидроксида цинка и 2 молей ортофосфорной кислоты: а) ортофосфат цинка; б) дигидроортофосфат цинка; в) ортофосфат гидроксоцинка; г) гидроортофосфат цинка?
Решение:
а) Уравнение реакции получения ортофосфата цинка:
б) Уравнение реакции получения дигидроортофосфата цинка:
в) Уравнение реакции получения ортофосфата гидроксоцинка:
г) Уравнение реакции получения гидроортофосфата цинка:
Таким образом, из 1 моля гидроксида цинка и 2 молей орптофосфорной кислоты образуется 1 моль дигидроортофосфата цинка.
Ответ: б).
Задача 174.
Какое взаимодействие приведет к получению нормальной соли из хлорида гидроксомагния: a) MgOHCl + NaOH; б) MgOHClO3 + NaOH; в) MgOHClO3 + HCl; г) MgOHCl + HCl?
Решение:
а) В водных растворах MgOHCl и NaOH как сильные электролиты распадаются на ионы:
б) В водных растворах MgOHClO3 и NaOH как сильные электролиты распадаются на ионы:
Ионы Mg2+, OH-, ClO3- и Na+ не связываются друг с другом и с ионами H+ с образованием осадка, газа или слабого электролита, поэтому данная реакция не идёт.
в) В водных растворах MgOHCjO3 и HCl как сильные электролиты распадаются на ионы:
г) В водных растворах MgOHCl и HCl как сильные электролиты распадаются на ионы:
Какие гидроксиды образуют основные соли
Основания и гидроксиды.
Для того, чтобы разбираться в классификации, сначала нужно понять, что такое основание и чем оно отличается от других веществ. Перечислим несколько оснований:
NaOH – гидроксид натрия
Ca(OH)2 – гидроксид кальция
Fe(OH)2 – гидроксид железа
Все три примера относятся к основаниям, но в названии значится, что это гидроксиды. В чем разница между этими понятиями?
Гидроксиды – это вещества, в состав которых какой-либо элемент имеет связь с гидроксильной группой (‒ОН). Но не все гидроксиды – это основания: кислоты, например, тоже являются гидроксидами.
Таким образом, все основания – это гидроксиды, но не все гидроксиды – это основания. Ввиду того, что группа гидроксидов очень разнообразна, её принято делить на три подгруппы.
Таб. «Классификация гидроксидов»
Гидроксид
Основный
Амфотерный
Кислотный
В состав входят гидроксогруппа (-ы) и металл в степени окисления «+1» или «+2» за исключением Zn(OH)2, Be(OH)2, Sn(OH)2, Pb(OH)2
В состав входят гидроксогруппы и металл в степени окисления «+3» или «+4», а также Zn(OH)2, Be(OH)2, Sn(OH)2, Pb(OH)2
В состав входят гидроксогруппа (-ы) и неметалл, либо гидроксогруппа (-ы) и металл в степени окисления «+5», «+6» или «+7»
Э – элемент. К основным гидроксидам так же относят гидроксид аммония – NH4OH, хотя правильнее его записывать как гидрат аммония – NH3·H2O.
Амфотерные гидроксиды имеют промежуточный характер между основными и кислотными, поэтому имеют обе формы написания.
Перевод формулы амфотерного гидроксида из основной формы в кислотную.
Возьмём любой амфотерный гидроксид: Al(OH)3;
Поменяем порядок элементов на кислотную форму (водород → элемент → кислород) без учета индексов основной формы: HAlO;
Расставим степени окисления:
Молекула должна быть электронейтральной (количество положительных и отрицательных зарядов должно быть равным), для этого кислорода должно быть в два раза больше, поэтому после него ставим индекс «2»: HAlO2
Согласно этой формуле после кислорода придется поставить индекс «1,5», но индексы могут быть выражены только целыми числами, поэтому сначала приведем количество положительных зарядов к четному значению, домножив элемент с нечетной степенью окисления (водород) на 2, получим формулу: H2ZnO, она пока всё равно не является электронейтральной, сумма её зарядов может быть выражена следующим уравнением: +2+2‒2 = +2, а должно быть = 0
H2
Чтобы количество отрицательных зарядов тоже стало равно четырем, количество кислорода нужно умножить вдвое, поставив после него индекс «2». Получается формула H2ZnO2
Таб. «Общие формулы амфотерных гидроксидов в зависимости от степени окисления металла в них»
Классификация основных гидроксидов (оснований) по количеству гидроксо-групп.
Основания
Однокислотные
Двукислотные
Однокислотные основания при диссоциации образуют лишь один гидроксид ион:
Двукислотные основания при диссоциации образуют два гидроксид-иона:
Основные гидроксиды не могут быть трёхкислотными или четырёхкислотными, так как в них металл будет иметь степень окисления «+3» или «+4», а это уже будет не основанием, а амфотерным гидроксидом.
Почему количество гидроксильных групп называется кислотностью? Потому что на нейтрализацию оснований требуется протон водорода из кислоты. Для нейтрализации однокислотных оснований потребуется один протон водорода, а на нейтрализацию двукислотного основания – два протона водорода и так далее. Например:
Молекулярное уравнение (МУ): NaOH + HCl = NaCl + H2O
Полное ионное уравнение (ПИУ): Na + + OH ‒ + H + + Cl ‒ = Na + + Cl ‒ + H2O
Сокращенное ионное уравнение (СИУ): OH ‒ + H + = H2O
На нейтрализацию однокислотного основания потребовался один протон водорода из соляной кислоты.
Классификация оснований по силе
Основания также можно поделить на сильные и слабые. Сильные диссоциируют очень быстро, даже двухосновные распадаются на ионы на столько быстро, что можно не учитывать ступенчатость этого процесса:
Слабые основания диссоциируют очень медленно, ступенчато:
Fe(OH)2 ↔ FeOH + + OH ‒ (первая ступень)
FeOH + ↔ Fe 2+ + OH ‒ (вторая ступень)
Сильные основания растворимы или малорастворимы (исключение: гидроксид аммония будучи растворимым остаётся слабым основанием) и называются щелочами. Слабые основания нерастворимы.
Таб. «Сильные и слабые основания»
Основания
Сильные (щелочи)
Слабые
Нерастворимы (искл. NH4OH)
Гидроксиды металлов IA-подгруппы, а также кальция, стронция и бария
Классификация оксидов, оснований, кислот и солей
Классификация оксидов
Солеобразующие оксиды:
2). Кислотные оксиды – это оксиды, которым соответствуют кислоты. К кислотным оксидам относятся оксиды неметаллов (кроме несолеобразующих – безразличных), а также оксиды металлов побочных подгрупп с валентностью от V до VII:
оксид углерода(IV) CO2; оксид серы(IV) SO2; оксид серы(VI) SO3; оксид кремния(IV) SiO2; оксид фосфора(V) P2O5; ксид хрома(VI) CrO3; ксид марганца(VII) Mn2O7; оксид азота NO2; ксиды хлора Cl2O5 и Cl2O3.
3). Амфотерные оксиды – это оксиды, которым соответствуют основания и кислоты. Образуются переходными металлами. Металлы в амфотерных оксидах обычно проявляют степень окисления от +3 до +4, за исключением ZnO, BeO, SnO, PbO: оксид цинка ZnO; оксид хрома(III) Cr2O3; оксид алюминия Al2O3; оксид олова(II) SnO; оксид олова(IV) SnO2; оксид свинца(II) PbO; оксид свинца(IV) PbO2; оксид титана(IV) TiO2; оксид марганца(IV) MnO2; оксид железа(III) Fe2O3; оксид бериллия BeO.
Несолеобразующие оксиды
1). Несолеобразующие оксиды – это оксиды безразличные к кислотам и основаниям. К ним относятся оксиды неметаллов с валентностью I и II:
оксид углерода(II) CO; оксид азота(II) NO; оксид азота(I) N2O; оксид кремния(II) SiO, оксид серы(I) S2O; оксид водорода H2O.
Основания. Классификация оснований
Основаниями называют гидроксиды, которые диссоциируют (распадаются) на гидроксильную группу и положительно заряженный катион. Общая формула оснований — Э(OН)m, где m – степень окисления металла.
Классификация оснований по силе:
Классификация оснований по растворимости
Более приемлемой является классификация оснований по растворимости их в воде.
1) Растворимые основания. Щёлочи – это основания растворимые в воде. К щелочам относят гидроксиды щелочных и щелочноземельных металлов: LiOH, NaOH, KOH, RbOH, CsOH, CaOH)2, Sr(OH)2, Ba(OH)2.
Классификация оснований по числу гидроксильных групп (ОН):
Кислоты. Классификация кислот
Кислота – это сложное вещество, в молекуле которого имеется один или несколько атомов водорода и кислотный остаток. Кислоты классифицируют по таким признакам: а) по наличию или отсутствию кислорода в молекуле и б) по числу атомов водорода.
а) Классификация кислот по наличию или отсутствию кислорода в молекуле:
б) Классификация кислот по числу атомов водорода:
Другие классификации кислот:
По устойчивости:
Устойчивые кислоты (H2SO4);
Неустойчивые кислоты (H2CO3).
По принадлежности к классам химических соединений:
Неорганические кислоты: (HBr); (H2SO4);
Органические кислоты: (HCOOH,CH3COOH).
По летучести:
Летучие кислоты: (HNO3,H2S);
Нелетучие кислоты: (H2SO4).
По растворимости в воде:
Растворимые кислоты (H2SO4);
Нерастворимые кислоты (H2SiO3).
По содержанию атомов металлов:
Металлосодержащие кислоты (HMnO4, H2TiO3);
Не металлосодержащие кислоты (HNO3, HCN).
Солями называются вещества, в которых атомы металла связаны с кислотными остатками. Исключением являются соли аммония, в которых с кислотными остатками связаны не атомы металла, а частицы NH4+, например, (NH4)2SO4 – сульфат аммония.
Классификация солей:
2). Кислые соли.
Кислые соли — это продукты частичного замещения катионов водорода в кислотах на катионы металла (NaHCO3, KH2PO4, K2HPO4). Они образуются при нейтрализации основания избытком кислоты (то есть в условиях недостатка основания или избытка кислоты).
4). Комплексные соли.
Комплексные соли — соли, имеющие сложные катионы или анионы, в которых связь образована по донорно-акцепторному механизму. Комплексные ионы, соединяясь с другими ионами, образуют комплексные соли, например, K4[Fe(CN)6], [Ag(NH3)2]Cl, K2[PtCl6], (Na2[Zn(OH)4]) и др.
Классификация солей по числу присутствующих в структуре катионов и анионов
Вывыделяют следующие типы солей:
1). Простые соли.
Простые соли — это соли, состоящие из одного вида катионов и одного вида анионов (NaCl).
2). Двойные соли.
Двойные соли — это соли, содержащие два различных типа катионов. примером двойных солей являются (KAl(SO4)2 . 12H2O) (алюмокалиевые квасцы), KAl(SO4)2 (сульфат алюминия-калия), MgK2(SO4)2, AgK(CN)2. Двойные соли существуют только в твердом виде.
3). Смешанные соли.
Смешанные соли — это соли, в составе которых присутствует два различных аниона (Ca(OCl)Cl), Fe(NH4)2(SO4)2 [сульфат диаммония-железа(II)], LiAl(SiO3)2 (метасиликат алюминия-лития), Ca(ClO)Cl (хлорид-гипохлорит кальция), Na3CO3(HCO3) (гидрокарбонат-карбонат натрия), Na2IO3(NO3) (нитрат-иодат натрия)