какие гидроксиды не взаимодействуют со щелочами
Задания 32. Характерные химические свойства неорганических веществ
CE7BF8
С какими из перечисленных ниже веществ будет взаимодействовать раствор сульфата меди (II)?
1) гидроксид калия (раствор)
3) нитрат бария (раствор)
5) оксид углерода (IV)
7) фосфат натрия (раствор)
Ответ: 1237
Пояснение:
Сульфат меди (II) CuSO4 – растворимая в воде соль синего цвета, взаимодействует с растворимыми основаниями, кислотами и солями с образованием осадков или газов. Кроме того, сульфат меди вступает с металлами, стоящими в электрохимическом ряду напряжений металлов до меди, т.е. с теми, которые способны заместить медь в соли. Следовательно, из предложенного списка сульфат меди реагирует
— с гидроксидом калия KOH с образованием синего осадка Cu(OH)2:
— железом, так как оно стоит перед медью в электрохимическом ряду напряжений металлов. В результате реакции выделяется медь, железо окисляется до степени окисления +2:
— фосфатом натрия с образованием не растворимого в воде голубого осадка – фосфата меди (II):
ACE94D
Какие гидроксиды не взаимодействуют со щелочами?
Ответ:134
Пояснение:
Амфотерные гидроксиды – сложные вещества, в зависимости от условий проявляющие либо кислотные, либо основные свойства, т.е. амфотерные гидроксиды реагируют с кислотами и щелочами.
Среди представленных ответов амфотерными гидроксидами являются гидроксид хрома (III) и гидроксид цинка.
ACE94D
Какие гидроксиды не взаимодействуют со щелочами?
Ответ:134
Пояснение:
Амфотерные гидроксиды – сложные вещества, в зависимости от условий проявляющие либо кислотные, либо основные свойства, т.е. амфотерные гидроксиды реагируют с кислотами и щелочами.
Среди представленных ответов амфотерными гидроксидами являются гидроксид хрома (III) и гидроксид цинка.
F33AAC
При обычной температуре магний не взаимодействует с
1) водой в присутствии кислорода
2) растворами щелочей
Ответ: 125
Пояснение:
В присутствии кислорода Mg окисляется до MgO, т.е. металл становится покрытым оксидной пленкой. Оксид магния MgO превращается в гидроксид Mg(OH)2 в горячей воде:
Сульфид магния MgS образуется непосредственно из простых веществ при температуре 800 o C:
Mg + S = MgS (t = 800 o C)
С разбавленными и концентрированными растворами HNO3 и H2SO4 Mg реагирует при комнатной температуре. Поскольку Mg – металл, стоящий в ряду активностей металлов до водорода, в зависимости от концентрации азотной кислоты азот восстанавливается до различных степеней окисления:
Реакция Mg с разбавленным раствором серной кислоты:
Mg является основным металлом, поэтому не реагирует с основаниями, т.е. с NaOH реакция не проходит.
C5C6B5
При комнатной температуре хром взаимодействует с
Ответ: 13
Пояснение:
В электрохимическом ряду напряжений металлов хром находится до водорода, поэтому он вытесняет водород из растворов неокисляющих кислот:
Концентрированные азотная и серная кислоты пассивируют хром. Хром может растворяться в них лишь при сильном нагревании, образуя соли хрома (III) и продукты восстановления кислоты:
В измельченном раскаленном состоянии хром реагирует с водой, образуя оксид хрома (III) и водород:
С азотом хром реагирует при температуре выше 1000 o C с образованием нитридов:
С водородом не взаимодействует
4DF082
Установите соответствие между реагирующими веществами и продуктами их взаимодействия.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
ПРОДУКТЫ ВЗАИМОДЕЙСТВИЯ
Ответ: А-1, Б-4, В-3, Г-6
Пояснение:
А) MgO + SO2 = MgSO3 – реакция соединения (из двух сложных веществ образуется одно более сложное)
Б) MgO + SO3 = MgSO4 – реакция соединения (из двух сложных веществ образуется одно более сложное)
В) MgO + H2SO3 = MgSO3 + H2O– реакция обмена (два сложных вещества – реагенты – обмениваются своими составными частями)
Г) MgO + H2SO4 = MgSO4 + H2O – реакция обмена (два сложных вещества – реагенты – обмениваются своими составными частями)
B40780
Установите соответствие между названием оксида и формулами веществ, с которыми он может взаимодействовать.
Характерные химические свойства оснований и амфотерных гидроксидов
Содержание:
Первое знакомство с основаниями состоялось при изучении взаимодействия воды с активными металлами и с оксидами активных металлов. В состав оснований входит одновалентная группа атомов OH (гидроксогруппа). Следовательно, основаниям можно дать следующее определение:
Основания – сложные вещества, в состав которых входят атомы металлов, соединенные с одной или нескольким группами атомов OH.
Общая формула оснований выглядит следующим образом: Ме (ОН)x, где Ме – металл; x – индекс.
Номенклатура оснований
Название оснований включает в себя слово «гидроксид», названия металла и его валентности. Более того, для элементов с постоянной валентностью она не указывается.
Название основания = «Гидрооксид» + название Me + валентность (в скобках)
Классификация оснований
Все основания можно классифицировать по различным признакам. Рассмотрим это в нижеприведенной таблице.
Из таблицы мы видим, что наблюдается большое различие по некоторым признакам. В зависимости от этого, различные группы оснований, обладают не схожими химическими свойствами.
Химические свойства щелочей (Щ)
NaOH + HCl → NaCl + H2O
Химические свойства нерастворимых оснований
Химические свойства амфотерных гидроксидов
К амфотерным гидроксидам относятся сложные вещества, способные проявлять свойства кислот либо оснований при определенных условиях.
Формулы данных соединений можно представить в виде оснований и в виде кислот.
Какие гидроксиды не взаимодействуют со щелочами?
Какие гидроксиды не взаимодействуют со щелочами?
1) Fe(OH)2 2) Cr(OH)3 3) Mg(OH)2 4) Ca(OH)2 5) Zn(OH)2.
С щелочами взаимодействует?
С щелочами взаимодействует.
Как гидроксид железа(III) взаимодействует с концентрированными раствороми щелочей и кислотами?
Как гидроксид железа(III) взаимодействует с концентрированными раствороми щелочей и кислотами.
Гидроксиды Al и Mg получают при взаимодействии их солей со щелочами?
Гидроксиды Al и Mg получают при взаимодействии их солей со щелочами.
Почему : 1) при получении гидроксида Al нельзя брать избыток щелочи 2) это условие не обязательно при получении гидроксида Mg.
Найти степень окисления Al0 Zn0 CuO NO KOH CaOH BaOH MgOH BaSO4 ZnCl AgS KMnO4 HClO H3PO4 HNO3 HCl?
Найти степень окисления Al0 Zn0 CuO NO KOH CaOH BaOH MgOH BaSO4 ZnCl AgS KMnO4 HClO H3PO4 HNO3 HCl.
Амфотерными являются те оксиды, которые : 1) взаимодействуют только с кислотами 2) взаимодействуют только с щелочами 3) взаимодействуют и с кислотами и с щелочами 4) не взаимодействуют ни с кислотами ни с щелочами.
Сходство между анилином и аммиаком позволяется во взаимодействии?
Сходство между анилином и аммиаком позволяется во взаимодействии.
Г) гидроксидом меди (II).
Взаимодействует ли титан с щелочами?
Взаимодействует ли титан с щелочами?
С какими веществами взаимодействуют кислоты соли щелочи вода?
С какими веществами взаимодействуют кислоты соли щелочи вода.
Чаще всего 2, 3, 6 переменная.
C6H12O6 + 6O2 = 6CO2 + 6H2O n(CO2) = n(C6H12O6) * 6 = 5 * 6 = 30 моль ; (по уравнению реакции) ; V(CO2) = n(CO2) * Vm = 30 * 22, 4 = 672 л.
1) FeCl3 + 3NaOH = Fe(OH)3↓ + 3NaCl 2) Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑.
Классификация неорганических веществ
Среди простых веществ выделяют металлы и неметаллы. Среди сложных: оксиды, основания, кислоты и соли. Классификация неорганических веществ построена следующим образом:
Большинство химических свойств мы изучим по мере продвижения по периодической таблице Д.И. Менделеева. В этой статье мне хотелось бы подчеркнуть ряд принципиальных деталей, которые помогут в дальнейшем при изучении химии.
Оксиды
Все оксиды подразделяются на солеобразующие и несолеобразующие. Солеобразующие имеют соответствующие им основания и кислоты (в той же степени окисления (СО)!) и охотно вступают в реакции солеобразования. К ним относятся, например:
Солеобразующие оксиды, в свою очередь, делятся на основные, амфотерные и кислотные.
Основным оксидам соответствуют основания в той же СО. В химических реакциях основные оксиды проявляют основные свойства, образуются исключительно металлами. Примеры: Li2O, Na2O, K2O, Rb2O CaO, FeO, CrO, MnO.
Основные оксиды взаимодействуют с водой с образованием соответствующего основания (реакцию идет, если основание растворимо) и с кислотными оксидами и кислотами с образованием солей. Между собой основные оксиды не взаимодействуют.
Li2O + H2O → LiOH (основный оксид + вода → основание)
Здесь не происходит окисления/восстановления, поэтому сохраняйте исходные степени окисления атомов.
Эти оксиды действительно имеют двойственный характер: они проявляют как кислотные, так и основные свойства. Примеры: BeO, ZnO, Al2O3, Fe2O3, Cr2O3, MnO2, PbO, PbO2, Ga2O3.
С водой они не взаимодействуют, так как продукт реакции, основание, получается нерастворимым. Амфотерные оксиды реагируют как с кислотами и кислотными оксидами, так и с основаниями и основными оксидами.
ZnO + KOH + H2O → K2[Zn(OH)4] (амф. оксид + основание = комплексная соль)
ZnO + N2O5 → Zn(NO3)2 (амф. оксид + кисл. оксид = соль; СО азота сохраняется в ходе реакции)
Fe2O3 + HCl → FeCl3 + H2O (амф. оксид + кислота = соль + вода; обратите внимание на то, что СО Fe = +3 не меняется в ходе реакции)
Проявляют в ходе химических реакций кислотные свойства. Образованы металлами и неметаллами, чаще всего в высокой СО. Примеры: SO2, SO3, P2O5, N2O3, NO2, N2O5, SiO2, MnO3, Mn2O7.
Кислотные оксиды вступают в реакцию с основными и амфотерными, реагируют с основаниями. Реакции между кислотными оксидами не характерны.
SO2 + Na2O → Na2SO3 (кисл. оксид + осн. оксид = соль; сохраняем СО S = +4)
SO3 + Li2O → Li2SO4 (кисл. оксид + осн. оксид = соль; сохраняем СО S = +6)
P2O5 + NaOH → Na3PO4 + H2O (кисл. оксид + основание = соль + вода)
Реакции несолеобразующих оксидов с основаниями, кислотами и солеобразующими оксидов редки и не приводят к образованию солей. Некоторые из несолеобразующих оксидов используют в качестве восстановителей:
FeO + CO → Fe + CO2 (восстановление железа из его оксида)
Основания
Основания классифицируются по количеству гидроксид-ионов в молекуле на одно-, двух- и трехкислотные.
Так же, как и оксиды, основания различаются по свойствам. Все основания хорошо реагируют с кислотами, даже нерастворимые основания способны растворяться в кислотах. Также нерастворимые основания при нагревании легко разлагаются на воду и соответствующий оксид.
Mg(OH)2 → (t) MgO + H2O (при нагревании нерастворимые основания легко разлагаются)
Если в ходе реакции основания с солью выделяется газ, выпадает осадок или образуется слабый электролит (вода), то такая реакция идет. Нерастворимые основания с солями почти не реагируют.
Ba(OH)2 + NH4Cl → BaCl2 + NH3 + H2O (в ходе реакции образуется нестойкое основание NH4OH, которое распадается на NH3 и H2O)
KOH + BaCl2 ↛ реакция не идет, так как в продуктах нет газа/осадка/слабого электролита (воды)
В растворах щелочей pH > 7, поэтому лакмус окрашивает их в синий цвет.
Al(OH)3 + HCl → AlCl3 + H2O (амф. гидроксид + кислота = соль + вода)
Al(OH)3 + KOH → K[Al(OH)4] (амф. гидроксид + основание = комплексная соль)
При нагревании до высоких температур комплексные соли не образуются.
Кислоты
Кислоты отлично реагируют с основными оксидами, основаниями, растворяя даже те, которые выпали в осадок (реакция нейтрализации). Также кислоты способны вступать в реакцию с теми металлами, которые стоят в ряду напряжений до водорода (то есть способны вытеснить его из кислоты).
Zn + HCl → ZnCl2 + H2↑ (реакция идет, так как цинк стоил в ряду активности левее водорода и способен вытеснить его из кислоты)
Cu + HCl ↛ (реакция не идет, так как медь расположена в ряду активности правее водорода, менее активна и не способна вытеснить его из кислоты)
Все кислоты подразделяются на сильные и слабые. Напомню, что мы составили подробную таблицу сильных и слабых кислот (и оснований!) в теме гидролиз. В реакции из сильной кислоты (соляной) можно получить более слабую, например, сероводородную или угольную кислоту.
В завершении подтемы кислот предлагаю вам вспомнить названия основных кислот и их кислотных остатков.
Блиц-опрос по теме Классификация неорганических веществ
Свойства оснований, амфотерных гидроксидов, кислот и солей. Ионный обмен и диссоциация
Теория к заданию 31 из ЕГЭ по химии
Химические свойства оснований и амфотерных гидроксидов
Основания — это сложные вещества, состоящие из атомов металла и одной или нескольких гидроксогрупп ($–OH$).
Свойства щелочей — гидроксидов щелочных и щелочноземельных металлов
1. Водные растворы щелочей мылкие на ощупь, изменяют окраску индикаторов: лакмуса — в синий цвет, фенолфталеина — в малиновый.
2. Водные растворы диссоциируют:
3. Взаимодействуют с кислотами, вступая в реакцию обмена:
$NaOH+HCl=NaCl+H_2O$ — реакция нейтрализации.
Многокислотные основания могут давать средние и основные соли:
4. Взаимодействуют с кислотными оксидами, образуя средние и кислые соли в зависимости от основности кислоты, соответствующей этому оксиду:
5. Взаимодействуют с амфотерными оксидами и гидроксидами:
6. Взаимодействуют с растворимыми в воде солями, если образуется осадок или газ:
Нерастворимые основания ($Cr(OH)_3, Mn(OH)_2$ и др.) взаимодействуют с кислотами и разлагаются при нагревании:
Амфотерные оксиды и гидроксиды.
| $H_2ЭO_2$ Кислотная форма | —-$ЭO$—- $BeO, ZnO, GeO, SnO, PbO, …$ | $Э(OH)_2$ Основная форма |
| $H_3ЭO_3$ Кислотная ортоформа $НЭO_2$ Кислотная метаформа | —-$Э_2O_3$—- $Al_2O_3, Ga_2O_3, In_2O_3, Tl_2O_3,$ $Cr_2O_3, Fe_2O_3, Sb_2O_3, …$ | $Э(OH)_3,$ чаще $Э_2O_3·nH_2O,ЭO(OH)$ Основная форма |
| $H_4ЭO_4$ Кислотная ортоформа $Н_2ЭO_3$ Кислотная метаформа | —-$ЭO_2$—- $GeO_2,SnO_2, PbO_2, VO_2, TiO_2, …$ | $Э(OH)_4,$ чаще $ЭO·nH_2O,ЭO(OH)_2$ Основная форма |
Химические свойства амфотерных соединений
1. Взаимодействуя с сильными кислотами, они обнаруживают основные свойства:
2. Взаимодействуя со щелочами — сильными основаниями, они обнаруживают кислотные свойства:
$Zn(OH)_2+2NaOH=Na_2[Zn(OH)_4]$ — комплексная соль;
$Al(OH)_3+NaOH=Na[Al(OH)_4]$ — комплексная соль.
Комплексными называют соединения, в которых хотя бы одна ковалентная связь образовалась по донорно-акцепторному механизму.
Химические свойства кислот
Кислотами называются сложные вещества, молекулы которых состоят из атомов водорода, способных замещаться на атомы металла, и кислотных остатков.
Классификация кислот.
Разделение кислот на группы по различным признакам представлено в таблице.
| Признаки классификации | Группы кислот | Примеры |
| Наличие кислорода в кислотном остатке | а) кислородные б) бескислородные | $H_3PO_4, HNO_3$ $H_2S, HCl, HBr$ |
| Основность | а) одноосновные б) двухосновные в) трехосновные | $HCl, HNO_3$ $H_2S, H_2SO_4$ $H_3PO_4$ |
| Растворимость в воде | а) растворимые б) нерастворимые | $H_2SO_4, H_2S, HNO_3$ $H_2SiO_3$ |
| Летучесть | а) летучие б) нелетучие | $H_2S, HCl, HNO_3$ $H_2SO_4, H_2SiO_3, H_3PO_4$ |
| Степень электролитической диссоциации | а) сильные б) слабые | $H_2SO_4, HCl, HNO_3$ $H_2S, H_2SO_3, H_2CO_3$ |
| Стабильность | а) стабильные б) нестабильные | $H_2SO_4, H_3PO_4, HCl$ $H_2SO_3, H_2CO_3, H_2SiO_3$ |
Свойства кислот
Кислый вкус, воздействие на индикаторы, электрическая проводимость, взаимодействие с металлами, основными и амфотерными оксидами, основаниями и солями, образование сложных эфиров со спиртами — эти свойства являются общими для неорганических и органических кислот.
1. В воде кислоты диссоциируют на катионы водорода и анионы кислотных остатков, например:
Растворы кислот изменяют цвет индикаторов: лакмуса — в красный, метилового оранжевого — в розовый, цвет фенолфталеина не изменяют.
2. Растворы кислот реагируют с металлами, стоящими в электрохимическом ряду напряжений левее водорода, при соблюдении ряда условий, важнейшим из которых является образование в результате реакции растворимой соли:
3. Неорганические и органические кислоты взаимодействуют с основными и амфотерными оксидами при условии, что образуется растворимая соль:
4. И те, и другие кислоты вступают в реакцию с основаниями. Многоосновные кислоты могут образовывать как средние, так и кислые соли (это реакции нейтрализации):
5. Реакция между кислотами и солями идет только в том случае, если образуется осадок или газ:
Продукты взаимодействия простых веществ с азотной и серной кислотами.
| $<\text"Простые вещества">/<\text"Кислоты">$ | $Mg$ | $Al$ | $Zn$ | $Fe$ |
| $HNO_3$ разбавленная | $Mg(NO_3)_2$ $NH_4NO_3$ $N_2$ | $Al(NO_3)_3$ $NH_4NO_3$ $N_2$ | $Zn(NO_3)_2$ $NH_4NO_3$ $N_2$ | $Fe(NO_3)_3$ $NH_4NO_3$ $N_2$ |
| $HNO_3$ концентрированная | $Mg(NO_3)_2$ $N_2O$ | пассивирует | $Zn(NO_3)_2$ $N_2O$ | пассивирует |
| $H_2SO_4$ разбавленная | $MgSO_4$ $H_2$ | $Al_2(SO_4)_3$ $H_2$ | $ZnSO_4$ $H_2$ | $FeSO_4$ $H_2$ |
| $H_2SO_4$ концентрированная горячая | $MgSO_4$ $H_2S$ | $Al_2(SO_4)_3$ $H_2S$ | $ZnSO_4$ $H_2S$ $S$ | $Fe_2(SO_4)_3$ $SO_2$ $S$ |
| $<\text"Простые вещества">/<\text"Кислоты">$ | $Cr$ | $Cu$ | $P$ | $S$ |
| $Fe(NO_3)_3$ $NH_4NO_3$ $N_2$ | $Cr(NO_3)_3$ $NO$ | $Cu(NO_3)_2$ $NO$ | $H_3PO_4$ $NO$ | $H_2SO_4$ $NO$ |
| пассивирует | пассивирует | $Cu(NO_3)_2$ $N_2O$ | $H_3PO_4$ $N_2O$ | $H_2SO_4$ $N_2O$ |
| $FeSO_4$ $H_2$ | $CrSO_4$ $H_2$ | — | — | — |
| $Fe_2(SO_4)_3$ $SO_2$ $S$ | $Fe_2(SO_4)_3$ $SO_2$ | $CuSO_4$ $SO_2$ | $H_3PO_4$ $SO_2$ | $SO_2$ $H_2O$ |
Химические свойства солей: средних, кислых, основных, комплексных
Соли — это класс химических соединений, состоящих из ионов металла и ионов кислотного остатка.
Номенклатура солей
| Название кислоты | Формула | Название солей | Формула (пример) |
| Азотистая | $HNO_2$ | Нитриты | $KNO_2$ |
| Азотная | $HNO_3$ | Нитраты | $Al(NO_3)_3$ |
| Хлороводородная (соляная) | $ HCl$ | Хлориды | $FeCl_3$ |
| Сернистая | $ H_2SO_3$ | Сульфиты | $K_2SO_3$ |
| Серная | $H_2SO_4$ | Сульфаты | $Na_2SO_4$ |
| Сероводородная | $H_2S$ | Сульфиды | $FeS$ |
| Фосфорная | $H_3PO_4$ | Фосфаты | $Ca_3(PO_4)_2$ |
| Угольная | $H_2CO_3$ | Карбонаты | $CaCO_3$ |
| Кремниевая | $H_2SiO_3$ | Силикаты | $Na_2SiO_3$ |
Растворимость солей
По растворимости в воде соли делятся на растворимые ($Р$), нерастворимые ($Н$) и малорастворимые ($М$). Для определения растворимости солей пользуются таблицей растворимости кислот, оснований и солей в воде. Если таблицы под рукой нет, то можно воспользоваться правилами. Их легко запомнить.
Классификация солей
Из всех химических соединений соли являются наиболее многочисленным классом веществ. Это твердые вещества, они отличаются друг от друга по цвету и растворимости в воде.
В начале XIX в. шведский химик И. Берцелиус сформулировал определение солей как продуктов реакций кислот с основаниями или соединений, полученных заменой атомов водорода в кислоте металлом. По этому признаку различают соли средние, кислые и основные.
Средние, или нормальные, соли — это продукты полного замещения атомов водорода в кислоте на металл.
Именно с этими солями вы уже знакомы и знаете их номенклатуру. Например:
$Na_2CO_3$ — карбонат натрия,
$CuSO_4$ — сульфат меди (II) и т. д.
Диссоциируют такие соли на катионы металла и анионы кислотного остатка:
Кислые соли — это продукты неполного замещения атомов водорода в кислоте на металл.
Названия этих солей складываются из названий средних солей с прибавлением приставки гидро-, например:
$Mg(HSO_4)_2$ — гидросульфат магния.
Диссоциируют кислые соли следующим образом:
Основные соли — это продукты неполного замещения гидроксогрупп в основании на кислотный остаток.
Последние диссоциируют так:
Свойства солей
Типичные реакции солей.
Первые две реакции обмена были подробно рассмотрены ранее.
Третья реакция также является реакцией обмена. Она протекает между растворами солей и сопровождается образованием осадка, например:
Четвертая реакция солей связана с положением металла в электрохимическом ряду напряжений металлов.
Второе правило ряда напряжений: каждый металл вытесняет из растворов солей все другие металлы, расположенные правее его в ряду напряжений. Это правило соблюдается при выполнении следующих условий:
а) обе соли (и реагирующая, и образующаяся в результате реакции) должны быть растворимыми;
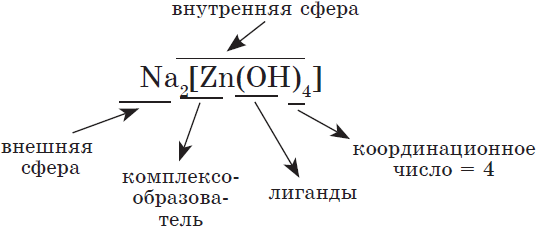
Комплексные соединения
При взаимодействии со щелочами амфотерных оксидов и гидроксидов в растворе образуются комплексные соли, состав которых может быть отражен формулой
Комплексными называют соединения, в которых хотя бы одна ковалентная связь образовывалась по донорно-акцепторному механизму.
В переводе с латинского complexus означает «сочетание». Действительно, очень многие комплексные соединения получают из двух или трех веществ, например:
Комплексные, или, как их еще называют, координационные соединения, построены так: в центре находится атом или ион (он называется комплексообразователем), а вокруг него — атомы, молекулы или ионы, образовавшие с ним ковалентные связи по донорно-акцепторному механизму (называются лигандами). Это могут быть анионы кислот, молекулы небольшого размера ($H_2O, NH_3, CO$), имеющие атомы с неподеленными электронными парами.
Например, строение тетрагидроксоалюмината натрия:
и уравнение его диссоциации:
Комплексные соединения играют большую роль в жизнедеятельности живых организмов. Почти все ферменты, гормоны, хлорофилл растений и гемоглобин животных, лекарства представляют собой комплексные соединения.
Электролитическая диссоциация в водных растворах. Слабые и сильные электролиты
Электролиты и неэлектролиты
Из уроков физики известно, что растворы одних веществ способны проводить электрический ток, а других — нет.
Вещества, растворы которых проводят электрический ток, называются электролитами.
Растворы сахара, спирта, глюкозы и некоторых других веществ не проводят электрический ток.
Вещества, растворы которых не проводят электрический ток, называются неэлектролитами.
Электролитические диссоциация и ассоциация
Почему же растворы электролитов проводят электрический ток?
Шведский ученый Сванте Аррениус, изучая электропроводность различных веществ, пришел в 1877 г. к выводу, что причиной электропроводности является наличие в растворе ионов, которые образуются при растворении электролита в воде.
Процесс распада электролита на ионы называется электролитической диссоциацией.
С. Аррениус, который придерживался физической теории растворов, не учитывал взаимодействия электролита с водой и считал, что в растворах находятся свободные ионы. В отличие от него, русские химики И. А. Каблуков и В. А. Кистяковский применили к объяснению электролитической диссоциации химическую теорию Д. И. Менделеева и доказали, что при растворении электролита происходит химическое взаимодействие растворенного вещества с водой, которое приводит к образованию гидратов, а затем они диссоциируют на ионы. Они считали, что в растворах находятся не свободные, не «голые» ионы, а гидратированные, т.е. «одетые в шубку» из молекул воды.
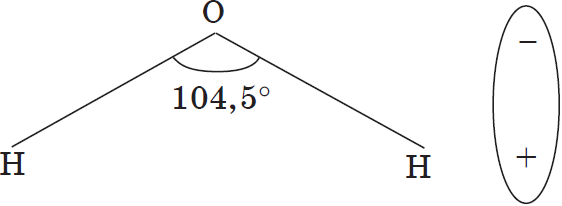
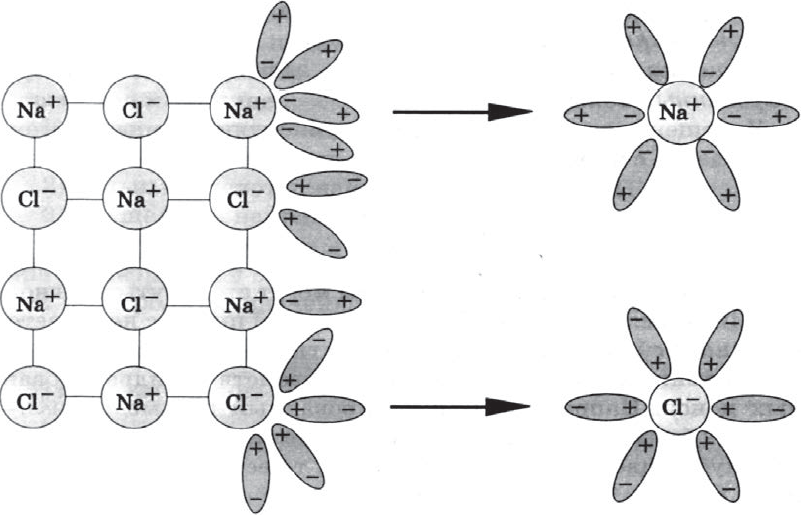
Как правило, легче всего диссоциируют вещества с ионной связью и соответственно с ионной кристаллической решеткой, так как они уже состоят из готовых ионов. При их растворении диполи воды ориентируются противоположно заряженными концами вокруг положительных и отрицательных ионов электролита.
Между ионами электролита и диполями воды возникают силы взаимного притяжения. В результате связь между ионами ослабевает, и происходит переход ионов из кристалла в раствор. Очевидно, что последовательность процессов, происходящих при диссоциации веществ с ионной связью (солей и щелочей), такова:
а) ориентация молекул (диполей) воды около ионов кристалла;
б) гидратация (взаимодействие) молекул воды с ионами поверхностного слоя кристалла;
в) диссоциация (распад) кристалла электролита на гидратированные ионы.
Упрощенно происходящие процессы можно отразить с по мощью следующего уравнения:
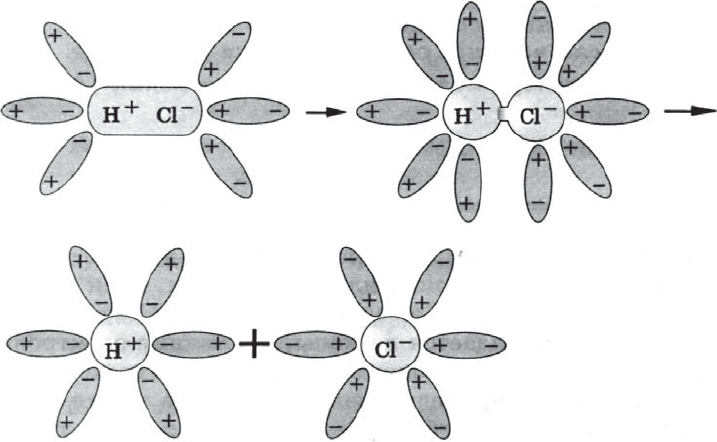
а) ориентация молекул воды вокруг полюсов молекул электролита;
б) гидратация (взаимодействие) молекул воды с молекулами электролита;
в) ионизация молекул электролита (превращение ковалентной полярной связи в ионную);
г) диссоциация (распад) молекул электролита на гидратированные ионы.
Упрощенно уравнение диссоциации соляной кислоты можно отразить с помощью следующего уравнения:
Степень электролитической диссоциации
Степень диссоциации — это отношение числа частиц, распавшихся на ионы ($N_g$), к общему числу растворенных частиц ($N_р$):
По степени электролитической диссоциации электролиты делятся на сильные и слабые.
Сильные и слабые электролиты
Сильные электролиты — это электролиты, которые при растворении в воде практически полностью диссоциируют на ионы. У таких электролитов значение степени диссоциации стремится к единице.
К сильным электролитам относятся:
1) все растворимые соли;
Слабые электролиты — это такие электролиты, которые при растворении в воде почти не диссоциируют на ионы. У таких электролитов значение степени диссоциации стремится к нулю.
К слабым электролитам относятся:
Константа диссоциации
В растворах слабых электролитов вследствие их неполной диссоциации устанавливается динамическое равновесие между недиссоциированными молекулами и ионами. Например, для уксусной кислоты:
Можно применить к этому равновесию закон действующих масс и записать выражение константы равновесия:
Константу равновесия, характеризующую процесс диссоциации слабого электролита, называют константой диссоциации.
Константа диссоциации характеризует способность электролита (кислоты, основания, воды) диссоциировать на ионы. Чем больше константа, тем легче электролит распадается на ионы, следовательно, тем он сильнее. Значения констант диссоциации для слабых электролитов приводятся в справочниках.
Основные положения теории электролитической диссоциации
1. При растворении в воде электролиты диссоциируют (распадаются) на положительные и отрицательные ионы.
Ионы — это положительно или отрицательно заряженные частицы, в которые превращаются атомы или группы атомов одного или нескольких химических элементов в результате отдачи или присоединения электронов.
В растворах ионы беспорядочно передвигаются в различных направлениях.
2. Причиной диссоциации электролита в водных растворах является его гидратация, т.е. взаимодействие электролита с молекулами воды и разрыв химической связи в нем.
В результате такого взаимодействия образуются гидратированные, т.е. связанные с молекулами воды, ионы.
Следовательно, по наличию водной оболочки ионы делятся на гидратированные (в растворах и кристаллогидратах) и негидратированные (в безводных солях).
3. Под действием электрического тока положительно заряженные ионы движутся к отрицательному полюсу источника тока — катоду и поэтому называются катионами, а отрицательно заряженные ионы движутся к положительному полюсу источника тока — аноду и поэтому называются анионами.
Следовательно, существует еще одна классификация ионов — по знаку их заряда. Сумма зарядов катионов ($Н^<+>, Na^<+>, NH_4^<+>, Cu^<2+>$) равна сумме зарядов анионов ($Cl^<–>, OH^<–>, SO_4^<2−>$), вследствие чего растворы электролитов ($HCl, (NH_4)_2SO_4, NaOH, CuSO_4$) остаются электронейтральными.
4. Электролитическая диссоциация — процесс обратимый для слабых электролитов.
Наряду с процессом диссоциации (распад электролита на ионы) протекает и обратный процесс — ассоциация (соединение ионов). Поэтому в уравнениях электролитической диссоциации вместо знака равенства ставят знак обратимости, например:
5. Не все электролиты в одинаковой мере диссоциируют на ионы. Степень диссоциации зависит от природы электролита и его концентрации.
6. Химические свойства растворов электролитов определяются свойствами тех ионов, которые они образуют при диссоциации.
Реакции ионного обмена
Свойства растворов слабых электролитов обусловлены молекулами и ионами, образовавшимися в процессе диссоциации, которые находятся в динамическом равновесии друг с другом.
Свойства растворов сильных электролитов определяются свойствами ионов, которые образуются при их диссоциации.
Свойства кислот можно разделить на три группы.
Первая группа объединяет общие свойства кислот, определяемые наличием в их растворах ионов водорода. Это вкус, окраска индикаторов, взаимодействие с металлами, основными оксидами, щелочами, основаниями. Приведем соответствующие сокращенные ионные уравнения:
— с металлами, стоящими в ряду напряжений металлов левее водорода:
— с основными оксидами:
— с нерастворимыми основаниями:
Ко второй группе относятся реакции, определяемые свойствами кислотных остатков. Это специфические для каждой кислоты реакции: образование малорастворимых, иногда окрашенных солей.
Третью группу составляют реакции, протекание которых обусловлено такими свойствами кислот, как сила кислоты, ее растворимость в воде, прочность молекулы, летучесть. Сильная кислота вытесняет слабую:
Как известно, высокая скорость многих химических реакций в растворах электролитов объясняется тем, что они протекают не между молекулами, а между ионами.
Реакции, протекающие между ионами, называют ионными реакциями.
Реакции ионного обмена в водных растворах могут протекать:
1) необратимо, до конца;
2) обратимо, т.е. протекать одновременно в двух противоположных направлениях.
Как вам известно, реакции обмена между сильными электролитами в растворах протекают до конца или практически необратимы, когда ионы, соединяясь друг с другом, образуют вещества:
б) малодиссоциирующие (слабые электролиты);
Приведем несколько примеров молекулярных и сокращенных ионных уравнений:
Реакция необратима, потому что один из ее продуктов уходит из сферы реакции в виде нерастворимого вещества.
Реакция нейтрализации необратима, т.к. образуется малодиссоциирующее вещество — вода.
Если среди исходных веществ и среди продуктов реакции имеются слабые электролиты или малорастворимые вещества, то такие реакции являются обратимыми, т.е. до конца не протекают. В обратимых реакциях равновесие смещается в сторону образования наименее растворимых или наименее диссоциированных веществ.
Если исходные вещества — сильные электролиты, которые при взаимодействии не образуют нерастворимых или малодиссоциирующих веществ или газов, то такие реакции не протекают: при смешивании растворов образуется смесь ионов.