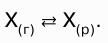какие газы плохо растворяются в воде
Растворимость в воде жидкостей и газов
Жидкости и газы тоже растворяются в воде. Среди них различают: хорошо растворимые, плохо растворимые и практически нерастворимые. Винный спирт хорошо растворим в воде, а вода — в спирте. Обе эти жидкости взаимно растворяются в любых отношениях.
Практически нерастворимыми в воде жидкостями можно считать растительное масло и керосин.
К числу хорошо растворимых газов относится хлористый водород HCl. Это бесцветный газ, немного тяжелее воздуха, с резким запахом. О его растворимости в воде можно судить по следующему опыту. В первой склянке находится хлористый водород, во второй склянке — вода. Если в трубку вдуть немного воздуха, то под его давлением из второй склянки часть воды поднимется по трубке, выльется в первую склянку и растворит в себе значительное количество газа — хлористого водорода.
Вследствие этого давление в сосуде станет меньше атмосферного, вода поднимется из нижнего сосуда в верхний по трубке и станет бить фонтаном и после того, как вдувание воздуха прекратилось.
Углекислый газ, кислород тоже растворяются в воде, но значительно хуже, чем хлористый водород. Некоторые газы практически не растворимы в воде. К их числу относится водород.
Чтобы узнать, как изменяется растворимость газов при повышении температуры, проделаем следующий опыт.
Небольшую колбу наполним свежей холодной водой, в которой, как известно, растворено некоторое количество воздуха. Закроем колбу пробкой, через которую проходит трубка воронки, и дольём в воронку столько воды, чтобы можно было погрузить в нее открытым концом пробирку, наполненную водой. При нагревании колбы из воды выделяются пузырьки воздуха и собираются в пробирке.
Следовательно, растворимость воздуха в воде уменьшается при повышении температуры.
То же наблюдается и при нагревании растворов других газов.
Растворимость газов в воде уменьшается при повышении температуры.
При изготовлении фруктовых вод их насыщают углекислым газом под давлением и хранят в толстостенных, плотно закупоренных бутылках. Когда же откупорят бутылку, давление в ней уменьшается, становится равным атмосферному, вследствие этого часть углекислого газа выделяется из раствора: вода как будто кипит в открытой бутылке.
Растворимость газов в воде уменьшается при понижении давления.
Источник: Д.М. Кирюшкин, учебник уроков по химии для 7 класса средней школы.
9.12. Растворимость газов в жидкостях
Вы здесь
Воздух несколько растворим в воде; при комнатной температуре (20°С) и давлении 1 атм в 1 л воды растворяется 19,0 мл воздуха. (Количество растворенного в воде воздуха уменьшается с повышением температуры.) При увеличении давления вдвое растворимость воздуха также увеличивается вдвое. Такую пропорциональность между растворимостью воздуха и его давлением отражает закон Генри*, который можно сформулировать следующим образом: при постоянной температуре парциальное давление одного из компонентов раствора в газовой фазе, находящейся в равновесии с раствором, пропорционально концентрации данного компонента в растворе (в области низкой концентрации).
Это соответствует утверждению, что растворимость газа в жидкости пропорциональна парциальному давлению данного газа.
Пример 9.5.
Распределение растворенного вещества между двумя растворителями
Если водный раствор иода взболтать с хлороформом, то большая часть иода перейдет в хлороформ. Отношение концентрации иода в этих двух фазах, называемое коэффициентом распределения, остается постоянным в области малых концентраций растворенного вещества в каждой фазе. Для иода в хлороформе и в воде при комнатной температуре этот коэффициент равен 250; отсюда следует, что при взбалтывании раствора иода в хлороформе с водой или раствора иода в воде с хлороформом при достижении равновесия концентрация иода в фазе хлороформа будет в 250 раз превышать концентрацию иода в водной фазе.
Из рассмотрения различных равновесий следует, что коэффициент распределения растворенного вещества между двумя растворителями равен отношению растворимостей данного вещества (в виде кристаллической, жидкой или газообразной фазы) в двух растворителях, если растворимости невелики.
* Закон открыт английским химиком Уильямом Генри (1775—1836).
** Атмосферный азот содержит 98,8% N2 и 1,2% Аr.
Растворенные в воде газы: источники, свойства, вред, способы очистки
Растворенные в воде газы: источники, свойства, вред, способы очистки
Водный раствор дает щелочную реакцию
С кислотами образует соли аммония
Взаимодействуя с металлами (без присутствия воды), образует соли (амиды)
В воде соли подвергаются гидролизу
При повышении температуры до 1200°÷1300°С аммиак разлагается (горит в атмосфере кислорода)
В реакции с метаном аммиак образует синильную кислоту
Молекулы аммиака могут образовывать комплексные соединения металлов, образуя лиганды.
CuSО4+4NH3→[ Cu(NH3)4]SО4
Ni(NO3)3+6NH3→[ Ni(NH3)6](NO3)3
При горении на воздухе аммиак образует свободный азот
4NH3 + 3O2 → 2N2 + 6H2O
Восстанавливает металлы из оксидов
2NH3 + 3CuO → 3Cu + N2 + H2O
H2S = Н+ + HS- = 2Н+ + S2-
В одном объеме воды может растворяться 2,91 (20 °С) объема сероводорода. Хорошо растворим в спирте.
При взаимодействии с воздухом сероводородная вода мутнеет из-за выделения серы вследствие окисления сероводорода кислородом воздуха.
На воздухе горит синим пламенем. Температура воспламенения
2H2S + 3O2 = 2H2O + 2SO2 (при избытке кислорода),
2H2S + O2 = 2H2O + 2S (при недостатке кислорода).
При концентрациях в пределах от 4,3% до 45,5% по объему газовоздушная смесь взрывоопасна. При нагреве свыше 400°С разлагается на Н2 и S. Водный раствор – слабая кислота, которая взаимодействует с металлами и их окислами. В воде легко окисляется галогенами и кислородом.
Вступает в реакцию со щелочами
H2S + 2NaOH = Na2S + H2O (обычная соль, при избытке NaOH)
H2S + NaOH = NaHS + H2O (кислая соль, при отношении 1:1)
Является сильным восстановителем.
H2SO4 + H2S = 2H2O +SO2+S
2H2S + SO2 = 2Н2О + 3S
H2S + I2 = 2HI + S
В реакциях с другими окислителями, образуется сера или SO42−
2H2S + SO2 = 2Н2О + 3S
3H2S + 4HCIO3 = 3Н2SО4 + 4HCI
Химическая формула : Rn (Radon)
Источником загрязнения вод могут являться : В природе образуется непрерывно при распаде урана, радия, тория, актиния и др. Распространен в подземных водах и природных газах, часто встречается в воздухе (особенно в подземных полостях, пещерах, подвалах). Значительными источниками образования радона являются граниты, шлаки. Повышенной содержание наблюдается в зонах геологических разломов. В помещения поступает, в основном, из строительных материалов.
Физические и химические свойства : Тяжелее воздуха в 7,6 раз (плотность 9,73г/л). Радиоактивен, не имеет запаха и цвета. В воде растворимость 460мл/л (понижается при повышении температуры), в жирах и органических растворителях растворимость выше в десятки раз. Подвержен адсорбции силикагелем, активированным углем. Флюоресцирует (голубым цветом), выделяет тепло. Изотопы нестабильны (период полураспада не выше 92 часов). Наиболее активный благородный газ. Может вступать в реакцию с фтором. ПДК в питьевой воде – 60Бк/кг.
Растворимость в воде, л/м3 : При 0°С – 510, при 20°С – 224, при 50°С – 130, при 100°С – 0.
Отрицательное воздействие на организм : Провоцирует рак легких. Повышает дозу поглощенной радиации. Способствует появлению учащенного сердцебиения, одышки, бессоннице, мигрени. При вдыхании больших количеств вызывает наркотическое опьянение.
Способы дегазации : аэрация- дегазация, адсорбция, мембранная фильтрация.
СН4 + 3[O] → HCOOH + H2O
Активно провоцирует парниковый эффект. Реагирует с парами воды (в присутствии катализатора NiAl2O3 при температуре 800—900 °C или без него при температуре 1400—1600 °C) с образованием синтез-газа:
С галогенами вступает в реакции замещения:
СН4 + CI2 → CH3CI + HCI
CH3CI + CI2 → CH2CI2 + HCI
CH2CI2 + CI2 → CHCI3 + HCI
CHCI3 + CI2 → CCI4 + HCI
Предел воспламеняемости газовоздушной смеси, об.% : 4,4÷17.
Растворимость в воде, л/м3 : При 0°С – 56, при 20°С – 33, при 100°С – 17. При увеличении давления растворимость растет.
Отрицательное воздействие на организм : Большие концентрации метана в воздухе (свыше 25÷30%) приводят к удушью. Незначительно воздействует на центральную нервную систему, вызывая наркотическое отравление. Четвертый класс опасности.
Способы дегазации : аэрация-дегазация, адсорбция, мембранная фильтрация.

 |  |  | ||
 |
[14.10.2021] |  | ||
 |  |  |