какие диуретики можно при хбп
Выбор препарата для диуретической терапии: взгляд клинического фармаколога
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Диуретики — это лекарственные средства, применяемые для усиления образования мочи, выведения из организма избыточного количества воды и устранения отеков. В обзорной статье представлены клинико-фармакологические подходы к диуретической терапии, данные о применении основных классов диуретиков. Основное внимание в статье сосредоточено на эффективности и профиле безопасности петлевых диуретиков и наиболее современного препарата из данной группы — торасемида, обладающего дополнительными свойствами. Обусловленная способностью блокировать альдостероновые рецепторы возможность торможения миокардиального фиброза под действием торасемида может обеспечивать этому препарату дополнительные преимущества с точки зрения замедления прогрессирования хронической сердечной недостаточности и увеличения выживаемости больных. Эффективность и профиль безопасности торасемида практически не меняются даже при существенном снижении скорости клубочковой фильтрации. Торасемид — вероятная альтернатива фуросемиду в лечении отечно-асцитического синдрома, в т. ч. резистентного к диуретикам, у больных циррозом печени. Торасемид отличается лучшей по сравнению с другими петлевыми диуретиками переносимостью. Торасемид, очевидно, следует рассматривать как наиболее предпочтительный препарат для лечения большинства вариантов отечного синдрома, в т. ч. резистентного к стандартным вариантам диуретической терапии.
Для цитирования: Максимов М.Л., Ермолаева А.С., Кучаева А.В. Выбор препарата для диуретической терапии: взгляд клинического фармаколога. РМЖ. 2018;1(II):115-119.
1 Kazan State Medical Academy, branch of the Russian Medical Academy of Continuous Professional Education
2 Sechenov University, Moscow
Diuretics are the drugs used to enhance diuresis, remove excess amounts of water from the body and eliminate edema.
The review presents clinical and pharmacological approaches to diuretic therapy, data on the use of the main classes of diuretics. The article focuses on the efficasy and safety of loop diuretics, and the latest drug from this group — torasemide, which has additional advantages. Due to the ability of torasemide to block aldosterone receptors thus inhibiting myocardial fibrosis, this drug may provide additional benefits in terms of slowing the progression of chronic heart failure and increasing patient survival. The efficasy and safety of torasemide are practically not affected even by a significant decrease in the glomerular filtration rate. Torasemide is a probable alternative to furosemide in the treatment of edematous-ascitic syndrome, including the one resistant to diuretics, in patients with liver cirrhosis. Torasemide is better tolerated than other loop diuretics. Torasemide, obviously, should be considered as the drug of choice for the treatment of most variants of edematous syndrome, including those resistant to standard diuretic therapy.
В статье с позиции клинического фармаколога обоснован выбор препарата для диуретической терапии. Основное внимание сосредоточено на эффективности и профиле безопасности петлевых диуретиков и наиболее современного препарата из данной группы — торасемида, обладающего дополнительными свойствами.
Введение
Классификация диуретиков
Принципы рациональной терапии и выбор диуретического препарата
Правила назначения диуретиков при ХСН
Терапия начинается только при наличии симптомов недостаточности кровообращения и признаках задержки жидкости.
Назначение диуретиков должно происходить на фоне уже применяемой терапии ингибиторами ангиотензинпревращающего фермента (АПФ) и бета-адреноблокаторами.
Мочегонная терапия осуществляется только в ежедневном режиме. Прерывистые курсы мочегонной терапии приводят к гиперактивации нейрогормональных систем и росту уровня нейрогормонов.
Назначение диуретиков идет «от слабейшего к сильнейшему».
При достижении клинического эффекта (уменьшение клинических проявлений НК, увеличение толерантности к физическим нагрузкам) начинается титрация «на понижение».
Тиазидные диуретики обладают высоким профилем безопасности только в комбинации с ингибиторами АПФ, блокаторами рецепторов ангиотензина (БРА) и бета-адреноблокаторами. В современных схемах роль тиазидных диуретиков в лечении ХСН умеренна. Следует особо помнить, что при низкой скорости клубочковой фильтрации (СКФ) и клинической картине хронической почечной недостаточности (ХПН) тиазидные диуретики неэффективны.
В лечении ХСН преимущество отдается петлевым диуретикам с большим периодом полувыведения (Т ½) и плейотропными эффектами. Комбинация диуретиков у пациентов с ХСН возможна только в ситуации, когда нет ХПН, а уровень калия — нормальный или пониженный. Строго обязателен лабораторный контроль уровня калия и креатинина. При уровне калия более 5,0–5,5 ммоль/л доза уменьшается на 50%. При более значимом отклонении от нормы — более 5,5 ммоль/л — проводится коррекция дозы вплоть до отмены препарата. После снижения дозы на 50% повторное увеличение дозы возможно спустя 1 мес. при условии стойкой нормокалиемии. При стабильном состоянии и отсутствии колебаний уровня креатинина контроль уровня калия должен осуществляться 1 раз в 3–6 мес. Необходимо помнить, что сочетание ингибиторов АПФ и калийсберегающих диуретиков всегда должно рассматриваться как приводящее к гиперкалиемии [11–13].
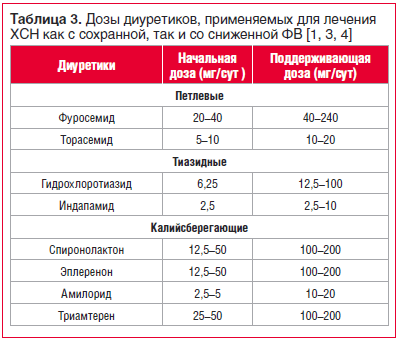
В таблице 3 представлены рекомендуемые начальные и поддерживающие дозы диуретиков, применяемых для лечения ХСН с сохранной и сниженной фракцией выброса (ФВ) [1, 3, 4].
Петлевые диуретики
Возможности применения торасемида в клинической практике
Только для зарегистрированных пользователей
Достоинства и недостатки нефропротективной стратегии (обзор литературы)
Рассмотрены показания и противопоказания к нефропротекции, являющейся альтернативой иммуносупрессивной терапии и представляющей собой комплекс методов лечения и профилактики прогрессирования хронической болезни почек, механизмы реализации нефропротективны
Indications and contra-indications to nefroprotection are examined which is the alternative of immunosupressive therapy, and which is a complex of methods of treatment and preventive maintenance of progression of chronic renal diseases, mechanisms of nefroprotective methods application, and selection of nefroprotectors combination.
Нефропротекция, часто являющаяся альтернативой иммуносупрессивной терапии, представляет собой комплекс методов лечения и профилактики прогрессирования хронической болезни почек (ХБП).
Нефропротекция: показания и противопоказания
Накоплен успешный опыт применения нефропротективной стратегии при диабетической нефропатии (ДН), нефросклерозе при гипертонической болезни, морбидном ожирении и метаболическом синдроме, а также при мезангиопролиферативном нефрите (IgA-нефропатии) и мембранозном нефрите [1, 2]. Удовлетворительного ответа на нефропротекцию можно ожидать у больного с протеинурией более 0,5 г/л, контролируемой артериальной гипертензией (АГ) и с креатинином крови, не превышающим 300 мкмоль/л без тенденции к быстрому увеличению [1, 3, 4].
Нефропротективные методы не должны применяться при острой почечной недостаточности (ОПН) и хронической терминальной почечной недостаточности, когда единственным жизнеобеспечивающим методом лечения является заместительная почечная терапия. Нефропротекция не эффективна при диффузных заболеваниях почек высокой активности (первичные и вторичные быстропрогрессирующие нефриты, острый лекарственный тубулоинтерстициальный нефрит), когда показаны высокие дозы глюкокортикостероидов и цитостатиков, плазмаферез. Нефропротективные методы нередко уступают по результативности этиотропной (антибактериальной, противовирусной) терапии нефропатий с установленной этиологией — диффузный нефрит при подостром инфекционном эндокардите, ВИЧ-ассоциированные нефропатии, HCV-позитивный криоглобулинемический мезангиокапиллярный нефрит, HBV-позитивная мембранозная нефропатия, малярийная нефропатия, паратуберкулезный нефрит, паранеопластические нефропатии.
Механизмы реализации нефропротективных методов
Нефропротективные методы неспецифичны: они воздействуют на общие неиммунные механизмы прогрессирования ХБП с целью стабилизации скорости клубочковой фильтрации (СКФ), снижения смертности больных ХБП как от терминальной уремии, так и от экстраренальных проявлений ХБП, в первую очередь — от сердечно-соcудистой патологии. Нефропротективная стратегия направлена на ингибицию протеинурического ремоделирования тубулоинтерстиция с прогрессирующим тубулоинтерстициальным фиброзом. Одновременно она замедляет ремоделирование эндотелия почечных сосудов (фокальный гломерулосклероз), а также тормозит концентрическую гипертрофию миокарда левого желудочка (ГЛЖ) [3, 5, 6]. Нефропротекция отличается от иммуносупрессивной и этиотропной терапии универсальным подходом, а также меньшей тяжестью и большей обратимостью побочных эффектов.
Крайне важно, что при ХБП у нефропротективного и кардиопротективного эффектов имеются ряд общих механизмов реализации и целевых показателей: снижение протеинурии, нормализация АГ, дислипидемии, анемии, фосфорно-кальциевого обмена, инсулинорезистентности (ИР), гиперсимпатикотонии, гиперурикемии.
Снижение протеинурии
По данным ряда исследований [5–7], снижение протеинурии является независимым предиктором стабилизации функции почек и ремиссии хронического нефрита. Наиболее выраженный антипротеинурический эффект характерен для ингибиторов АПФ (иАПФ) и блокаторов АТ1-рецепторов ангиотензина (БРА) и реализуется вследствие подавления ренин-ангиотензин-альдостероновой системы (РААС) и коррекции эндотелиальной дисфункции.
При нефросклерозе при гипертонической болезни (ГБ) также обнаружена прямая зависимость между степенью снижения протеинурии и риском исхода в терминальную ХПН, cердечно-сосудистую смертность. При ДН снижение протеинурии с поддержанием ее на уровне остаточной в течение 12 месяцев вдвое уменьшает риск исхода в терминальную ХПН. По данным метаанализа, как при ДН, так и при недиабетических нефропатиях риск исхода в терминальную стадию ХБП коррелирует со степенью снижения протеинурии.
Коррекция артериальной гипертензии
Коррекция артериальной гипертензии является ключевым фактором нефропротекции. Во II–IV стадиях ХБП нормализация артериального давления (АД) снижает общую и сердечно-сосудистую смертность, а также уменьшает частоту исхода в терминальную ХПН. Корреляция нефропротективного эффекта с антигипертензивным обнаружена при нефропатиях, протекающих с гиперфильтрацией, — ДH, метаболическом синдроме. При нормализации АД у больных ДН риск исхода в терминальную ХПН снижается в 3–5 раз [2]. По данным многих исследований [8–10] коррекция АГ тормозит скорость прогрессирования ХБП и исход в терминальную уремию только в том случае, когда сопровождается снижением протеинурии. Степень снижения АД при ХБП должна быть тем выраженнее, чем выше исходная протеинурия [11].
Комбинированная нефропротекция
Для достижения нефропротективного эффекта часто требуются превышающие среднетерапевтические дозы блокаторов РААС, антагонистов кальция (АК), бета-1-адреноблокаторов (БАБ), диуретиков, статинов, аллопуринола, что при монотерапии может привести к нестабильности гемодинамики, водно-электролитного обмена, острому повреждению почек, печени, других органов. Тем более что по мере увеличения стадии ХБП со снижением почечного клиренса лекарств нарастает риск токсических и гемодинамических побочных эффектов. Так, использовать нефропротективные эффекты метформина и глитазонов возможно в полной мере только в 1-й стадии ХБП [12]. На более поздних стадиях ХБП увеличивается риск лактацидоза, гипергидратации. По той же причине даже на ранних стадиях ХБП должны применяться низкие дозы аллопуринола (до 300 мг/сут), которые нормализуют уровень мочевой кислоты лишь у половины больных [13]. Применение более высоких доз при ХБП приводит к некротизирующему васкулиту с острым тубулоинтерстициальным нефритом и токсическим гепатитом. В 3–4 стадиях ХБП учащаются побочные мио- и гепатотоксические эффекты статинов и фибратов, хотя начиная с 2–3 стадии ХБП максимально высок риск сердечно-сосудистых осложнений и гиполипидемическая терапия рекомендуется независимо от уровня липидов крови [14–16]. Терапия ХБП блокаторами РААС должна проводиться под контролем содержания креатинина и калия в сыворотке крови, особенно начиная с 3-й стадии ХБП и у больных пожилого возраста. Наряду с известными обратимыми формами преренальной ОПН, ассоциированной с двусторонним стенозом почечных артерий, приводятся описания необратимой ОПН, осложняющей длительное применение блокаторов РААС (late onset renal failure from angiotensin blockade — LORFFAB) [17].
Комбинированная нефропротекция (multidrug подход), воздействующая одновременно на разные механизмы прогрессирования ХБП и использующая как основной, так и плейотропные эффекты препарата, часто позволяет добиться цели быстрее и с большей безопасностью вследствие применения более низких доз за счет синергизма препаратов.
По данным P. Ruggenenty и соавт. [7], при комбинированной терапии ХБП скорость утраты СКФ замедлилась более чем в 8 раз по сравнению с монотерапией иАПФ. При исследовании STENO-2 [18], включавшем больных инсулинонезависимым сахарным диабетом (ИНСД), при достижении одновременного контроля за гликемией, АГ и дислипидемией риск развития ДН уменьшился в 2 раза, а риск сердечно-сосудистых осложнений снизился в 1,5 раза.
За счет использования в комбинации с иАПФ низких доз тиазидов (в расчете на гипотиазид — 12,5–25 мг в сут) индуцированные тиазидами осложнения (гипокалиемия, вторичная активация РААС, негативное влияние на инсулинорезистентность, липидный и пуриновый обмен, кислотно-основное состояние крови (КОС)) нейтрализуются блокаторами РААС, а доза последних в комбинации может быть уменьшена [19]. Высокоэффективна комбинация блокаторов РААС с индапамидом [20, 21]. Комбинация иАПФ или БРА с антагонистами кальция II–III поколения (амлодипином, верапамилом МВ, лацидипином, нитрендипином) позволяет увеличить контроль за АД высокого риска в 2 раза и дополнительно снизить протеинурию, не увеличивая дозу блокаторов РААС [22–24].
Присоединение БАБ или карведилола повышает эффективность блокаторов РААС в отношении распространенной при ХБП трудноконтролируемой гипертензии с гиперрениемией и гиперсимпатикотонией [25, 26]. Уникальным является антиангинальный и антиаритмический эффекты БАБ и их влияние на кардиомиопатию с ХСН. Дополнительное усиление антипротеинурического и кардиопротективного эффектов дает присоединение к антиадренергическим средствам метаболических препаратов — активных метаболитов витамина D (кальцитриола, парикальцитола), препаратов железа и эритропоэтина [27, 28].
Несмотря на неспецифичность нефропротекции, выбор комбинации нефропротективных препаратов не должен быть случайным [4]. Он определяется формой и стадией ХБП (табл. 1). Так, периндоприл с индапамидом или трандолаприл в сочетании с верапамилом МВ замедляют развитие ДН вследствие максимального влияния на протеинурию [2]. Аналогичный нефропротективный эффект при недиабетических нефропатиях, по данным исследований REIN и AASK, обеспечивается рамиприлом, что связывают с его нормализующим действием на проницаемость гломерулярного фильтра и апоптоз [5]. Телмисартан, наиболее липофильный БРА, по антипротеинурическому эффекту не уступает рамиприлу, но реже приводит к осложнениям. Содержащие SH-группу иАПФ (каптоприл, зофеноприл) или комбинация БРА с дигидропиридиновыми АК и статинами наиболее эффективны для вторичной профилактики острого инфаркта миокрада и острого нарушения мозгового кровообращения у больных ХБП. Другим основанием для индивидуальной комбинированной терапии ХБП является преодоление резистентности к блокаторам РААС (табл. 2). Резистентность к блокаторам РААС, формирующаяся у 15–20% больных ХБП на 2–3 месяце лечения, проявляется рецидивом протеинурии и АГ с ускорением темпа прогрессирования ХБП, ГЛЖ и фиброза миокарда. Выбор препарата, присоединяемого к иАПФ, зависит от причин и механизмов формирования резистентности. Так, на феномен «ускользания» альдостерона от действия блокаторов РААС эффективно влияют спиронолактоны (Верошпирон, эплеренон) [29]. Феномен «ускользания» ренина от блокаторов РААС нейтрализуется БАБ, активными аналогами витамина D (кальцитриол, парикальцитол), особенно полно блокируют почечную продукцию ренина его прямые ингибиторы — алискирен (Расилез) [30].
Заключение
Нефропротекция результативна при диабетической и недиабетических нефропатиях на разных стадиях хронической болезни почек.
Нефропротекивный эффект может сопровождаться кардиопротекцией.
Наиболее эффективна и безопасна комбинированная нефропротекция — с использованием блокаторов РААС, диуретиков, антагонистов кальция II–III поколения, бета-1-адреноблокаторов, а также препаратов, нормализующих липидный, фосфорно-кальциевый, пуриновый обмен и эритропоэз.
Литература
А. Ю. Николаев, доктор медицинских наук, профессор
ГБОУ ДПО РМАПО МЗ РФ, Москва
Фармакотерапия артериальной гипертонии у больных с хронической болезнью почек в реальной клинической практике
Провести анализ антигипертензивной терапии у больных с хронической болезнью почек (ХБП) 3-5 стадий в условиях нефрологического отделения многопрофильного стационара и оценить соответствие назначений современным рекомендациям.
Материалы и методы
В ретроспективном исследовании антигипертензивную терапию оценивали у 258 больных артериальной гипертонией и ХБП 3-5 стадий, находившихся на лечении в отделении нефрологии Краевой клинической больницы г. Барнаула.
Среднее число одновременно назначенных антигипертензивных лекарственных средств составило 3,1±0,1. Частота назначения основных групп препаратов была следующей: β-адреноблокаторов – 72,5%, антагонистов кальция – 57,8%, тиазидных и тиазидоподобных диуретиков – 55,8%, петле- вых диуретиков – 27,9%, калийсберегающих диуретиков – 1,9%, ингибиторов ангиотензин- превращающего фермента – 40,7%, блокаторов ангиотензиновых рецепторов – 31,0%, агонистов центральных имидазолиновых рецепторов – 20,5%, a-адреноблокаторов – 12,8%. Общая частота назначения блокаторов ренин-ангиотензиновой системы (РАС) соста- вила 69,4% и уменьшалась по мере снижения скорости клубочковой фильтрации и увеличения протеинурии. Более половины пациентов, не получавших блокаторов РАС, не имели явных противопоказаний для их назначения.
В реальной клинической практике возможности нефропротективной терапии используются далеко не в полной мере, особенно у больных с ХБП 4-5 стадий и с высокой и очень высокой протеинурией.
Концепция хронической болезни почек (ХБП) была сформулирована экспертами Национального почечного фонда США в 2002 г. и к настоящему времени получила признание мирового медицинского сообщества. Распространенность ХБП сопоставима с таковой социально значимых заболеваний, таких как гипертоническая болезнь, сахарный диабет, ожирение и метаболический синдром. Признаки повреждения почек и/или снижение скорости клубочковой фильтрации (СКФ) выявляют, как минимум, у каждого десятого представителя общей популяции [1]. Артериальная гипертония (АГ) часто сопутствует ХБП и является важнейшим фактором ее прогрессирования, а адекватный контроль артериального давления (АД) замедляет развитие терминальной почечной недостаточности [15].
По данным проспективных рандомизи рованных исследований использование препаратов, подавляющих ренин-ангиотензиновую систему (РАС), у больных с ХБП ведет к достоверному снижению протеинурии и скорости прогрессирования заболевания 11. Поэтому блокаторы РАС, в том числе ингибиторы ангиотензинпревращающего фермента (АПФ) и блокаторы рецепторов ангиотензина II (БРА), считают основным компонентом нефропротективной стратегии и препаратами выбора для лечении АГ при ХБП 1.
Однако существует ряд противопоказаний к применению блокаторов РАС, а препараты этого класса могут вызывать определенные нежелательные лекарственные реакции, поэтому их нельзя назначать всем больным с ХБП. В связи с этим представляет интерес проведение фармакоэпидемиологических исследований для определения частоты применения блокаторов РАС при ХБП в реальной клинической практике.
Целью нашего фармакоэпидемиологического исследования было определить особенности фармакотерапии АГ у больных с ХБП в рамках оказания специализированной медицинской помощи и оценить соответствие назначений современным клиническим рекомендациям.
Материалы и методы
В ретроспективное исследование включали больных с ХБП 3-5 стадий и АГ, находившихся на лечении в отделении нефрологии КГБУЗ “Краевая клиническая больница» г. Барнаула. Не включали пациентов, получавших заместительную почечную терапию. На основании историй болезни пациентов анализировали анамнез, клинический диагноз, длительность пребывания в отделении, данные объективного, клинических и лабораторных исследований. По листам назначений регистрировали общее число антигипертензивных препаратов, их международные непатентованные названия, сроки назначения и отмены
Статистическая обработка полученного материала проведена с использованием Microsoft Office Excel 2010. Данные представлены в виде М±m.
Результаты
В ретроспективное исследование было включено 258 больных с ХБП 3-5 стадий и АГ, среди которых преобладали женщины (57,4%). Возраст больных варьировался от 18 до 79 лет (в среднем 55,4±0,8 года). Длительность пребывания в отделении составляла от 7 до 25 дней (в среднем 12,8±0,1 дней). Основные характеристики больных и их распределение по нозологиям приведены в табл. 1 и 2.
| Заболевания | n, % |
|---|---|
| Хронический гломерулонефрит | 87 (33,7) |
| Хронический пиелонефрит | 59 (22,9) |
| Нефропатия сложного генеза | 42 (16,3) |
| Поликистоз почек | 23 (8,9) |
| Гипертоническая болезнь, первичный нефроангиосклероз | 16 (6,2) |
| Хронический гломерулонефрит в сочетании с хроническим пиелонефритом | 11 (4,3) |
| Диабетическая нефропатия | 9 (3,5) |
| Хронический тубулоинтерстициальный нефрит | 5 (1,9) |
| Подагрическая нефропатия | 2 (0,8) |
| Вторичный нефросклероз в исходе острой почечной недостаточности | 2 (0,8) |
| Вторичный амилоидоз | 1 (0,4) |
| Ишемическая нефропатия | 1 (0,4) |
Для лечения АГ использовали следующие группы антигипертензивных лекарственных средств (ЛС): диуретики, антагонисты кальция, ингибиторы АПФ, БРА, β-адреноблокаторы, a-адреноблокаторы и агонисты центральных имидазолиновых рецепторов. У 92,3% больных проводилась комбинированная антигипертензивная терапия (табл. 3). Среднее число одновременно назначенных антигипертензивных ЛС составило 3,1±0,1. На фоне проводимой терапии АД достоверно (р ТАБЛИЦА 3. Объем антигипертензивной терапии в исследуемой группе больных
Частота назначения различных групп антигипертензивных препаратов представлена в табл. 4. Чаще всего пациентам назначали β-адреноблокаторы (72,5%), при этом частота их применения увеличивалась по мере нарастания тяжести ХБП – от 65,1% при 3а стадии до 86,5% при 5 стадии. Вторую позицию по частоте применения заняли антагонисты кальция (57,8%). Частота их применения также увеличивалась по мере нарастания тяжести ХБП – от 34,9% при 3а стадии до 82,7% при 5 стадии. На третьем месте оказались тиазидные и тиазидоподобные диуретики (55,8%). Их чаще применяли при ХБП 3б стадии (64,2%) и реже – при ХБП 4, 3а и 5 стадий (58,1%, 52,4% и 42,1%, соответственно). Чет вер тое место заняли ингибиторы АПФ (40,7%). Чаще всего их назначали пациентам с ХБП 3а и 3б стадий (49,2% и 54,3%, соответственно). Частота назначения ингибиторов АПФ заметно снижалась при ХБП 4 и 5 стадий (30,7% и 23,1%, соответственно). БРА занимали пятую позицию по частоте назначения (31,0%) и, как и ингибиторы АПФ, наиболее часто применялись при ХБП 3а и 3б стадий (39,7% и 39,5%, соответственно). Частота назначения БРА у больных ХБП 4 и 5 стадий снижалась до 25,8% и 13,5%, соответственно. Петлевые диуретики использовали у 27,9% больных (шестое место). Частота их назначения варьировалась от 22,2% при ХБП 3а стадии до 36,5% при ХБП 5 стадии. Агонисты центральных имидазолиновых рецепторов и a-адреноблокаторы заняли седьмую и восьмую позицию (20,5% и 12,8%, соответственно). Частота их назначения была самой низкой при ХБП 3а и 3б стадии и существенно возрастала при ХБП 4 и 5 стадий. Калийсберегающие диуретики (только спиронолактон) назначали редко (1,9%), в основном при ХБП 3а и 3б стадий (при наличии нефротического синдрома или застойной сердечной недостаточности).
| Группы препаратов | ХБП 3а стадии (n=63 | ХБП 3б стадии (n=81) | ХБП 4 стадии (n=62) | ХБП 5 стадии (n=52) | ХБП (n=258) |
|---|---|---|---|---|---|
| Бета-адреноблокаторы | 41 (65,1) | 54 (66,7) | 47 (75,8) | 45 (86,5) | 187 (72,5) |
| Антагонисты кальция | 22 (34,9) | 41 (50,6) | 43 (69,4) | 43 (82,7) | 149 (57,8) |
| Тиазидные и тиазидоподобные диуретики | 33 (52,4) | 52 (64,2) | 36 (58,1) | 22 (42,1) | 144 (55,8) |
| Ингибиторы АПФ | 31 (49,2) | 44 (54,3) | 19 (30,7) | 12 (23,1) | 105 (40,7) |
| Блокаторы рецепторов ангиотензина II | 25 (39,7) | 32 (39,5) | 16 (25,8) | 7 (13,5) | 80 (31,0) |
| Блокаторы РАС в целом | 55 (87,3) | 73 (90,1) | 35 (56,5) | 17 (32,7) | 179 (69,4) |
| Петлевые диуретики | 14 (22,2) | 25 (30,9) | 14 (22,6) | 19 (36,5) | 72 (27,9) |
| Агонисты центральных имидазолиновых рецепторов | 5 (7,9) | 14 (17,3) | 20 (32,3) | 14 (26,9 | 53 (20,5) |
| Альфа-адреноблокаторы | 5 (7,9) | 7 (8,6) | 11 (17,7) | 10 (19,2) | 33 (12,8) |
| Калийсберегающие диуретики | 2 (3,2) | 2 (2,5) | 1 (1,6) | 0 | 5 (1,9) |
Мы проанализировали также частоту назначения отдельных антигипертензивных ЛС. Среди β-адреноблокаторов чаще всего назначали бисопролол (76,5% назначений), реже – метопролол (21,9%), бетаксолол (3,2%) и небиволол (0,5%). Среди антагонистов кальция лидером по частоте назначения оказался амлодипин (57,7%), реже применялись препараты нифедипина в продленных формах (44,3%) и лерканидипин (1,3%). В группе тиазидных/тиазидоподобных диуретиков преобладало назначение индапамида (95,1%), реже применяли гидрохлоротиазид (4,9%). Среди петлевых диуретиков наиболее часто назначали торасемид (72,2%), реже – фуросемид (29,2%). Среди ингибиторов АПФ лидером был фозиноприл (70,5%), реже применяли эналаприл (17,1%), периндоприл (8,6%), лизиноприл (1,9%), квинаприл (1,0%). В группе БРА в 75,0% случаев назначали лозартан, реже – телмисартан (26,3%), вальсартан (2,5%) и кандесартан (1,3%). Из агонистов центральных имидазолиновых рецепторов применялся в основном моксонидин (88,9%), реже – рилменидин (14,8%). Среди a-адреноблокаторов назначали доксазозин (87,9%) и тамсулозин (12,1%).
| Степень протеинуриии | CКФ, мл/мин/1,73 м 2 | Ингибиторы АПФ (n, %) | БРА (n, %) | Все блокаторы РАС (n, %) |
|---|---|---|---|---|
| Оптимальная или незначительно повышенная (А1) | 17 (23,9) | 29 (40,9) | ||
| ≥30 (n=46) | 28 (60,9) | 13 (28,3) | 40 (87,0) | |
| Всего (n=117) | 42 (35,9) | 30 (25,6) | 69 (59,0) |
Обсуждение
В соответствии с современными рекомендациями препаратами первой линии для лечения АГ у больных с ХБП являются блокаторы РАС [1-5,12]. Однако, в нашем исследовании ни ингибиторы АПФ, ни БРА не были лидерами по частоте назначения. Их применяли реже, чем β-адреноблокаторы, антагонисты кальция, а также тиазидные и тиазидоподобные диуретики. Общая частота назначения блокаторов РАС (69,4%) все равно была ниже частоты применения β-адреноблокаторов. Это вряд ли можно считать оправданным, поскольку дополнительные показания для назначения последних, такие как стенокардия, перенесенный инфаркт миокарда, нарушения ритма сердца и др., имелись только у 14,7% больных. Высокую частоту назначения антагонистов кальция и тиазидных/тиазидоподобных диуретиков можно объяснить тем, что эти классы препаратов широко используются для комбинированной терапии АГ, в том числе рациональным признается их сочетание с блокаторами РАС 3. Однако, тиазидные/тиазидоподобные диуретики не должны применяться при снижении СКФ
Заключение
Проведенное нами исследование показало, что стационарная практика фармакотерапии АГ при ХБП 3-5 стадий в реальной клинической практике в целом соответствует современным рекомендациям. Однако, частота назначения блокаторов РАС остается недостаточной, а возможности нефропротекции используются далеко не в полной мере, особенно у больных ХБП 4-5 стадий и при высокой и очень высокой протеинурии.


_575.gif)
.gif)