какие диуретики можно при хпн
Выбор препарата для диуретической терапии: взгляд клинического фармаколога
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Диуретики — это лекарственные средства, применяемые для усиления образования мочи, выведения из организма избыточного количества воды и устранения отеков. В обзорной статье представлены клинико-фармакологические подходы к диуретической терапии, данные о применении основных классов диуретиков. Основное внимание в статье сосредоточено на эффективности и профиле безопасности петлевых диуретиков и наиболее современного препарата из данной группы — торасемида, обладающего дополнительными свойствами. Обусловленная способностью блокировать альдостероновые рецепторы возможность торможения миокардиального фиброза под действием торасемида может обеспечивать этому препарату дополнительные преимущества с точки зрения замедления прогрессирования хронической сердечной недостаточности и увеличения выживаемости больных. Эффективность и профиль безопасности торасемида практически не меняются даже при существенном снижении скорости клубочковой фильтрации. Торасемид — вероятная альтернатива фуросемиду в лечении отечно-асцитического синдрома, в т. ч. резистентного к диуретикам, у больных циррозом печени. Торасемид отличается лучшей по сравнению с другими петлевыми диуретиками переносимостью. Торасемид, очевидно, следует рассматривать как наиболее предпочтительный препарат для лечения большинства вариантов отечного синдрома, в т. ч. резистентного к стандартным вариантам диуретической терапии.
Для цитирования: Максимов М.Л., Ермолаева А.С., Кучаева А.В. Выбор препарата для диуретической терапии: взгляд клинического фармаколога. РМЖ. 2018;1(II):115-119.
1 Kazan State Medical Academy, branch of the Russian Medical Academy of Continuous Professional Education
2 Sechenov University, Moscow
Diuretics are the drugs used to enhance diuresis, remove excess amounts of water from the body and eliminate edema.
The review presents clinical and pharmacological approaches to diuretic therapy, data on the use of the main classes of diuretics. The article focuses on the efficasy and safety of loop diuretics, and the latest drug from this group — torasemide, which has additional advantages. Due to the ability of torasemide to block aldosterone receptors thus inhibiting myocardial fibrosis, this drug may provide additional benefits in terms of slowing the progression of chronic heart failure and increasing patient survival. The efficasy and safety of torasemide are practically not affected even by a significant decrease in the glomerular filtration rate. Torasemide is a probable alternative to furosemide in the treatment of edematous-ascitic syndrome, including the one resistant to diuretics, in patients with liver cirrhosis. Torasemide is better tolerated than other loop diuretics. Torasemide, obviously, should be considered as the drug of choice for the treatment of most variants of edematous syndrome, including those resistant to standard diuretic therapy.
В статье с позиции клинического фармаколога обоснован выбор препарата для диуретической терапии. Основное внимание сосредоточено на эффективности и профиле безопасности петлевых диуретиков и наиболее современного препарата из данной группы — торасемида, обладающего дополнительными свойствами.
Введение
Классификация диуретиков
Принципы рациональной терапии и выбор диуретического препарата
Правила назначения диуретиков при ХСН
Терапия начинается только при наличии симптомов недостаточности кровообращения и признаках задержки жидкости.
Назначение диуретиков должно происходить на фоне уже применяемой терапии ингибиторами ангиотензинпревращающего фермента (АПФ) и бета-адреноблокаторами.
Мочегонная терапия осуществляется только в ежедневном режиме. Прерывистые курсы мочегонной терапии приводят к гиперактивации нейрогормональных систем и росту уровня нейрогормонов.
Назначение диуретиков идет «от слабейшего к сильнейшему».
При достижении клинического эффекта (уменьшение клинических проявлений НК, увеличение толерантности к физическим нагрузкам) начинается титрация «на понижение».
Тиазидные диуретики обладают высоким профилем безопасности только в комбинации с ингибиторами АПФ, блокаторами рецепторов ангиотензина (БРА) и бета-адреноблокаторами. В современных схемах роль тиазидных диуретиков в лечении ХСН умеренна. Следует особо помнить, что при низкой скорости клубочковой фильтрации (СКФ) и клинической картине хронической почечной недостаточности (ХПН) тиазидные диуретики неэффективны.
В лечении ХСН преимущество отдается петлевым диуретикам с большим периодом полувыведения (Т ½) и плейотропными эффектами. Комбинация диуретиков у пациентов с ХСН возможна только в ситуации, когда нет ХПН, а уровень калия — нормальный или пониженный. Строго обязателен лабораторный контроль уровня калия и креатинина. При уровне калия более 5,0–5,5 ммоль/л доза уменьшается на 50%. При более значимом отклонении от нормы — более 5,5 ммоль/л — проводится коррекция дозы вплоть до отмены препарата. После снижения дозы на 50% повторное увеличение дозы возможно спустя 1 мес. при условии стойкой нормокалиемии. При стабильном состоянии и отсутствии колебаний уровня креатинина контроль уровня калия должен осуществляться 1 раз в 3–6 мес. Необходимо помнить, что сочетание ингибиторов АПФ и калийсберегающих диуретиков всегда должно рассматриваться как приводящее к гиперкалиемии [11–13].
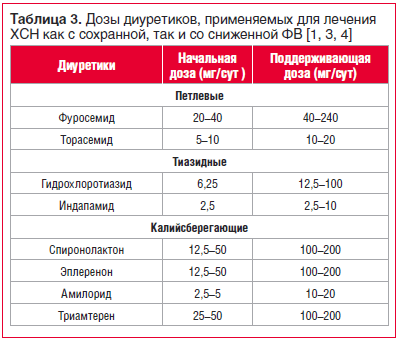
В таблице 3 представлены рекомендуемые начальные и поддерживающие дозы диуретиков, применяемых для лечения ХСН с сохранной и сниженной фракцией выброса (ФВ) [1, 3, 4].
Петлевые диуретики
Возможности применения торасемида в клинической практике
Только для зарегистрированных пользователей
Университет
Назначая мочегонные препараты, специалисты исходят преимущественно из собственного клинического опыта. При этом известно, что применение диуретиков у имеющих признаки задержки жидкости чревато побочными эффектами (дегидратация, гипокалиемия, нарушения ритма сердца). Особенно сложно контролировать результаты лечения врачам амбулаторной практики: существенную часть ответственности за прием препаратов они вынужденно делегируют пациентам и их родственникам.
Предлагаемый алгоритм назначения диуретической терапии при СЗЖ создан на основании исследований, рекомендаций, клинического опыта и призван оптимизировать ведение этой сложной категории больных в амбулаторных условиях.
Основные правила назначения мочегонных препаратов при СЗЖ Терапия мочегонными препаратами должна начинаться только при наличии симптомов и признаков задержки жидкости, к которым относятся:
• появление или усиление одышки инспираторного характера, тахипноэ (ЧДД >16 в минуту);
• пароксизмальное ночное удушье;
• пароксизмальный ночной кашель (в отсутствие ХОБЛ);
• необходимость поднимать изголовье, чтобы спать (возможно ортопноэ);
• появление периферических отеков;
• скопление жидкости в полостях (асцит, гидроторакс, гидроперикард);
• увеличение веса на 2 кг за 1 неделю;
• набухание и пульсация шейных вен (венный пульс);
• влажные хрипы в легких;
• увеличение прямого размера печени;
• рентгенологические признаки застоя в малом кругу кровообращения (венозная гипертензия);
• повышенное давление наполнения левого желудочка.
Если перечисленные признаки и симптомы развились в течение 1–3 дней, сопровождаются тахикардией, гипотонией, то подобное состояние должно расцениваться как острая декомпенсация сердечной деятельности.
В этом случае предлагаемый алгоритм неприменим и, как правило, рациональное ведение больного в амбулаторных условиях не представляется возможным.
Если СЗЖ появился в результате хронической сердечной недостаточности, то диуретики надо назначать в комбинации с терапией иАПФ (при их непереносимости антагонистами рецепторов к ангиотензину II, бета-адреноблокаторами и антагонистами минералокортикоидных рецепторов (АМКР)).
Диуретики при СЗЖ следует использовать непрерывно, мочегонную терапию проводить ежедневно. Прерывистые курсы диуретиков провоцируют гиперактивацию нейрогормональных систем и могут способствовать прогрессированию СЗЖ.
Важно ежедневное взвешивание. Максимально допустимое снижение веса — 1 кг/сут, в амбулаторных условиях — не более 0,5 кг/сут. Дегидратация и избыточный диурез более опасны, чем сам отечный синдром.
Назначение и титрование дозы диуретиков на повышение требуют обязательного контроля уровня электролитов крови, скорости клубочковой фильтрации (СКФ), продолжительности интервала QT не реже 1 раза в неделю. После стабилизации состояния определять уровни калия и креатинина/СКФ можно 1 раз в 3–6 месяцев.
При достижении клинического эффекта (уменьшение проявлений СЗЖ, увеличение толерантности к физическим нагрузкам) необходимо начинать титрование дозы мочегонного «на понижение» с ежедневным контролем веса. Если состояние пациента стабилизируется, разрешено даже отменить диуретик (больного регулярно наблюдать). При назначении активной диуретической терапии важно помнить об особенностях водно-солевого режима. Оптимальный диурез достигается, если лечение проводят на фоне диеты с обычным количеством натрия при легком снижении объема выпиваемой жидкости (1–1,2 л/сут). Т. е. целесообразно не резко уменьшать потребление соли, а лишь ограничить жидкость.
Алгоритм назначения мочегонных препаратов
Если СЗЖ приводит к незначительному ограничению физической активности пациента, что соответствует II ФК ХСН, для принятия решения о выборе диуретических средств необходимо оценить функцию почек и принимаемую базовую терапию (рис.).

Достижение положительного диуреза с помощью ТД сопряжено с более высокой вероятностью гипотонии, чем использование ПД. Снижение АД является независимым фактором негативного прогноза у больных с ХСН — основной причиной СЗЖ.
Следует особо отметить, что даже при умеренно выраженной хронической болезни почек (ХБП) эффективность ТД уменьшается, а снижение СКФ менее 30 мл/мин/ 1,73 м2 является абсолютным противопоказанием к их назначению.
Все перечисленное в значительной степени сужает роль ТД в современных схемах лечения СЗЖ. Они могут быть включены в состав комбинированной диуретической терапии при неэффективности больших доз ПД.
При выявлении клинически выраженного СЗЖ возможно продолжение приема ТД, если они были назначены в составе комбинированной антигипертензивной терапии у пациента с АГ при сохранении САД > 140 мм рт. ст. и СКФ > 60 мл/мин/1,73 м2. Однако в этой ситуации для устранения признаков задержки жидкости необходимо присоединить ПД в стартовых дозах. СКФ рассчитывают по формуле MDRD. СКФ = 186 (креатинин (в мкмоль/л) / 88) – 1,154 (возраст (в годах) – 0,203) (для женщин результат умножают на 0,742). Расчет клиренса эндогенного креатинина (КК) может быть проведен по формуле Кокрофта–Голта (Сосkcrоft–Gаult): КК = (140 – возраст) вес (в кг) / креатинин 1,22 (для мужчин); КК = (140 – возраст) вес / креатинин 1,03 (для женщин).
Терапия ТД требует на первых этапах ежедневного контроля электролитов из-за высокого риска развития гипокалиемии, что сложно организовать в амбулаторных условиях.
Если у пациента имеются значительные ограничения физической активности или клиническая картина СЗЖ проявляется в покое (III–IV ФК), то необходимо начать мочегонную терапию со стартовых доз ПД (табл.).
Преимущество стоит отдавать ПД с большим периодом полувыведения и предсказуемой абсорбцией из ЖКТ. Удлинение интервала высвобождения молекул мочегонного препарата, достигаемое благодаря использованию особой матрицы, снижает пик концентрации препарата в крови и увеличивает время максимальной концентрации препарата. В связи с этим при применении таких препаратов (торасемид замедленного высвобождения) развивается более мягкий и предсказуемый диуретический эффект, в меньшей степени ухудшающий качество жизни. Кроме того, торасемид замедленного высвобождения уменьшает риск развития у пациента пикообразного натрийуреза, который может привести к поражению почечных канальцев, а также компенсаторной активации САС и РААС, что снижает результат диуретической терапии.
При неэффективности стартовых доз ПД они должны быть удвоены, но превышать максимально допустимые нельзя. Если в качестве стартового препарата выбран фуросемид, то предпочтительно перейти на торасемид из-за более высокой биодоступности у больных с отечным синдромом (соотношение доз торасемида к фуросемиду составляет примерно 1:4). Если высокие дозы ПД не приводят к купированию проявлений СЗЖ, то рекомендовано присоединить ингибитор карбоангидразы — ацетазоламид. Этот препарат, помимо мочегонного действия, обладает способностью изменять рН мочи в кислую сторону и может привести к восстановлению чувствительности к ПД. Обычно соблюдается следующая схема: ацетазоламид 250 мг 2–3 раза в сутки 3–4 дня (1 раз в 2–3 недели). Если терапия не привела к значительному улучшению состояния больного и у него сохраняется ограничение физической активности на уровне II–IV ФК, требуется назначение или увеличение доз АМКР вплоть до максимальных.
• Увеличение доз АМКР при СЗЖ допускается до 200 мг/сут для верошпирона. Доза препарата должна быть разделена на 2 приема: утром и в обед.
• Увеличение доз АМКР допускается только в ситуации, когда ХБП не тяжелее 3-й стадии, а уровень калия нормальный или пониженный.
• Строго обязателен лабораторный контроль калия и креатинина (СКФ). При уровне калия более 5,0–5,5 ммоль/л доза АМКР уменьшается вдвое. При снижении СКФ < 10 мл/мин/ 1,73 м2 требуется отмена АМКР.
• При более значимом отклонении уровня калия от нормы — более 5,5 ммоль/л — проводится коррекция дозы вплоть до отмены препарата, назначается диета с низким содержанием калия.
• После снижения дозы на 50% повторное увеличение дозы АМКР возможно спустя 1 месяц при условии стойкой нормокалиемии.
• При стабильном состоянии и отсутствии колебаний уровня креатинина контроль уровня калия должен осуществляться 1 раз в 3 месяца.
• Необходимо помнить, что сочетание иАПФ и АМКР всегда должно рассматриваться как потенциально приводящее к гиперкалиемии. Неэффективность всех перечисленных мероприятий требует оценки возможных причин рефрактерности к диуретической терапии. Причинами отечного синдрома, рефрактерного к комбинированной диуретической терапии могут быть:
• замедление всасывания диуретиков (преимущественно фуросемида) в ЖКТ у пациентов с асцитом и анасаркой;
• неконтролируемый прием NaCl;
• текущая терапия НПВС;
• прогрессирование почечной недостаточности;
Следующий этап лечения СЗЖ должен включать внутривенное болюсное или капельное введение диуретиков (фуросемида), а при необходимости и комбинацию ПД и ГХТ.
Вполне вероятно, что в данной ситуации на первый план выходит низкое системное АД. В этом случае важно не дальнейшее наращивание диуретической терапии, а усиление плазмотока через почку, что достигается введением прессорных аминов.
Также высока вероятность потребности в немедикаментозных методах борьбы с СЗЖ — гемодиализ, ультрафильтрация и др. На этом этапе продолжать амбулаторное ведение больного нереально, тактика его дальнейшего лечения выходит за рамки настоящего алгоритма.
Очевидно, что в представленном алгоритме не рассмотрены все возможные клинические ситуации. Он не отменяет необходимости индивидуального подхода с учетом основного и сопутствующего заболеваний, условий проживания пациента и опыта лечащего врача. Однако обозначает основные направления для поиска рациональных решений при ведении больных с синдромом задержки жидкости в амбулаторной практике.
Александр Бова, доктор мед. наук, профессор, заслуженный врач Республики Беларусь,
Сергей Трегубов,ассистент кафедры военно-полевой терапии БГМУ
Медицинский вестник, 6 августа 2014
Медикаментозная терапия поражений почек, обусловленных нарушениями обмена пуринов
Рассмотрены подходы к медикаментозному лечению пациентов с заболеваниями почек, обусловленными нарушениями обмена пуринов. Описаны лекарственные средства, применяемые для патогенетического лечения подагрической нефропатии.
Approaches to drug treatment of patients with renal diseases caused by purines metabolism disorders, are examined. Medications used for pathogenic treatment of gouty nephropathy are described.
Пуриновый обмен представляет собой сложный каскад биохимических реакций, в котором принимают участие многие ферментные системы. Содержание пуринов в организме складывается из их поступления с продуктами питания и эндогенного синтеза. Большая часть солей мочевой кислоты — уратов — образуется эндогенно в процессе метаболизма нуклеиновых кислот, однако существуют и другие пути биосинтеза этих веществ. Во всех вариантах важнейшим промежуточным звеном является инозиновая кислота, которая в дальнейшем подвергается гидролизу. Образующийся гипоксантин под влиянием фермента ксантиноксидазы преобразуется в ксантин и мочевую кислоту. С точки зрения биохимии нарушения пуринового обмена представляют собой различные варианты дисбаланса между ферментными системами, отвечающими за синтез и транспортировку мочевой кислоты и ее предшественников. Существенное значение также имеет поступление значительного количества пуринов с продуктами питания.
Считается, что в организме взрослого здорового человека содержится около 1000 мг мочевой кислоты. При нарушениях обмена пуринов этот показатель может возрастать в несколько раз. Содержание мочевой кислоты в организме не является жестким параметром и не имеет какой-либо диагностической ценности. Даже основной показатель состояния пуринового обмена — концентрация мочевой кислоты в сыворотке крови особой жесткостью не отличается. Минимальное и максимальное значения нормы отличаются примерно в 2,5 раза — 200–450 мкмоль/л у мужчин и 160–400 мкмоль/сут у женщин. У здоровых людей за сутки выводится и вновь синтезируется примерно 750 мг или 2/3 от общего объема мочевой кислоты. Из этого количества около 80% или 600 мг экскретируется почками. Оставшиеся 20% выводятся через желудочно-кишечный тракт. По оценке П. М. Клименко и соавт. (2010) клиренс мочевой кислоты в норме составляет 5,4–9,0 мл/мин [1].
Почечная экскреция уратов представляет собой сложный и многоступенчатый процесс. В клубочках происходит фильтрация уратов плазмы. Попавшие в ультрафильтрат ураты практически полностью реабсорбируются в проксимальном канальце, а затем секретируются в просвет нефрона. Некоторая часть секретированных уратов повторно реабсорбируется. Процесс активной секреции уратов очень чувствителен к различным химическим агентам. Считается, что почечную секрецию уратов повышают оротовая кислота, лозартан, эстрогены, продукты распада тетрациклина (просроченные тетрациклины обладают высокой токсичностью!); почечную экскрецию уратов понижают этамбутол, тиазиды и тиазидоподобные диуретики, в меньшей степени фуросемид и ацетазоламид [2]. Вполне очевидно, что выраженность отмеченных эффектов сильно изменяется от препарата к препарату и далеко не всегда имеет клиническое применение. В частности, урикозурические свойства эстрогенов существенного значения не имеют. Лозартан в последнее время стал фигурировать в схемах лечения подагрического тубулоинтерстициального нефрита у пациентов, не имеющих нефролитиаза [3]. Склонность тиазидов и индапамида уменьшать почечную экскрецию уратов и повышать их сывороточную концентрацию выражена достаточно ярко, что делает эти препараты как минимум нежелательными при суставной подагре и, особенно, при подагрической нефропатии.
Клинические варианты поражения почек вследствие нарушения пуринового обмена
Заболевания, связанные с нарушениями пуринового обмена, встречаются сравнительно часто, что делает актуальными вопросы, связанные с их лечением. Специалисты-урологи, а также большинство врачей общей практики хорошо знакомы с особенностями уратного нефролитиаза. В то же время эти специалисты нередко вовсе не имеют представления о существовании других, подчас более тяжелых заболеваний, обусловленных нарушениями пуринового обмена. Между тем все они встречаются с разной частотой в стационарах, а также при оказании амбулаторной медицинской помощи.
Наиболее значимым следствием нарушений пуринового обмена является повышение уровня мочевой кислоты в крови — гиперурикемия, которая и является основным этиологическим фактором различных патологических состояний. В зависимости от этиологии гиперурикемия подразделяется на первичную (не имеющую явной причины) и вторичную по отношению к какому-либо заболеванию.
Клиническим следствием первичной гиперурикемии является подагра в широком понимании этого термина. Сюда входит и классический острый микрокристаллический артрит, и различные варианты подагрической нефропатии, одним из которых является уратный нефролитиаз, и тофусы различной локализации, и осложнения всех этих состояний.
В группе заболеваний, связанных с первичной гиперурикемией, несколько особняком стоят генетически обусловленные нарушения пуринового обмена. Среди них синдром Леша–Нихена, болезнь Гирке, различные варианты наследственных дефектов транспортных систем почечных канальцев и другие. Отличительными признаками гиперурикемий, наследуемых по моногенному типу (то есть связанных с дефектом конкретного гена, определяющего развитие всего симптомокомплекса), являются манифестация в раннем детском возрасте, высокая гиперпродукция мочевой кислоты, быстрое, иногда даже «злокачественное» прогрессирование заболевания вплоть до формирования терминальной почечной недостаточности, часто весьма умеренная эффективность лечебных мероприятий, несмотря на максимально активную терапию [4].
Клиническая диагностика нарушений пуринового обмена, наследуемых по полигенному типу, в настоящее время затруднена. Проявления и характер течения заболевания в этом случае сильно варьируют в зависимости от внешних факторов, а биологический эффект значительной части генов все еще не до конца ясен [3, 4].
В нефрологической и общетерапевтической практике для определения поражения почек вследствие гиперурикемии несколько десятилетий назад было введено понятие «подагрическая почка», которое в современной медицине трансформировалось в «подагрическую нефропатию». Учитывая экспериментально доказанное повреждающее действие солей мочевой кислоты на почечные структуры, также предлагался термин «уратная нефропатия». Все эти понятия являются обобщающими и объединяют несколько достаточно сильно различающихся по своему патогенезу процессов: острую мочекислую нефропатию, уратный нефролитиаз и хронический тубулоинтерстициальный нефрит. Отдельные авторы также отмечают возможность иммунокомплексного гломерулонефрита, пусковым фактором которого служит гиперпродукция мочевой кислоты [5].
В урологической практике наиболее часто встречаются пациенты с уратным нефролитиазом. До 80% таких пациентов хотя бы один раз в жизни имели эпизод острого артрита, причем совершенно необязательно классической локализации — I плюснефалангового сустава. В последнее время все чаше встречаются атипичные варианты подагрического артрита, например, гонит. Кроме того, широкое и бесконтрольное применение нестероидных противовоспалительных средств зачастую смазывает клиническую картину, увеличивая удельный вес артритов с меньшей активностью воспалительного процесса. Можно отметить, что сочетание артрита и уратного нефролитиаза является не обязательным, а, скорее, характерным [5, 6].
Клиническая картина конкремента почки, мочеточника общеизвестна, поэтому еще раз ее подробно описывать смысла нет. Единственно, стоит отметить, что при наиболее тяжелом, «злокачественном» течении, наряду с образованием уратных камней в просвете мочевых путей, возможно и отложение кристаллов урата в почечном интерстиции, что носит название «нефрокальциноз». В отличие от нефролитиаза, нефрокальциноз при подагре всегда двухсторонний. Нефрокальциноз не имеет каких-либо специфических симптомов. Клинические проявления сводятся к прогрессированию почечной недостаточности за счет нефросклероза. Нефрокальциноз в большинстве случаев выявляется при ультразвуковом сканировании и требует специфической терапии.
Хронический тубулоинтерстициальный нефрит является характерным и частым вариантом подагрической нефропатии. Однако, ввиду меньшей яркости клинической картины, он известен главным образом специалистам-нефрологам и ревматологам.
На начальных стадиях тубулоинтерстициального нефрита патологический процесс затрагивает в основном канальцы и почечный интерстиций, поэтому ведущим симптомом является нарушение концентрационной функции почек — полиурия с низкой плотностью мочи (гипостенурией). Протеинурия не превышает 1 г/сут или вовсе отсутствует — она связана с нарушением реабсорбции белка канальцами. Для подагрического интерстициального нефрита характерна стойкая уратурия, а также стойкая или эпизодическая микрогематурия, особенно после перенесенной респираторной вирусной инфекции.
Уровень урата крови также закономерно повышен, однако необходимо помнить, что сам по себе факт наличия хронической почечной недостаточности также является причиной гиперурикемии. При явной клинической картине хронического тубулоинтерстициального нефрита его связь с нарушениями пуринового обмена не вызывает сомнений при следующих соотношениях уровней урата и креатинина крови: соответственно > 536 мкмоль/л и 595 мкмоль/л и 132–176 мкмоль/л; > 714 мкмоль/л и > 176 мкмоль/л [7].
При иммуногистохимическом исследовании почечных биоптатов у части пациентов с клинической картиной подагрического тубулоинтерстициального нефрита было отмечено свечение С3-фракции комплемента и IgG, что характерно для иммунокомплексных гломерулонефритов. Это позволило выделить хронический гломерулонефрит как отдельный вариант подагрической нефропатии [6].
При прогрессировании подагрического тубулоинтерстициального нефрита закономерно развитие артериальной гипертензии и нефросклероза.
Острая мочекислая нефропатия (острая подагрическая почка) в своей основе имеет обструкцию почечных канальцев кристаллами уратов, что приводит к острой почечной недостаточности. Заболевание начинается с олигурии. Часть пациентов одновременно предъявляет жалобы на болевой синдром по типу почечной колики, макрогематурию, что может объясняться миграцией крупных кристаллов уратов по мочеточнику. Патогномоничной является высокая уратурия, не характерная для острой почечной недостаточности другой этиологии, а также значительное повышение уровня мочевой кислоты в крови (выше 850–900 мкмоль/л). В современной нефрологической практике считается, что диагноз острой мочекислой нефропатии не вызывает сомнений при соотношении уровней урата и креатинина крови (в мг) > 1 [8].
Предположение об острой мочекислой нефропатии основывается на сочетании трех клинических признаков — высокоактивного артрита с характерной локализацией, резкого уменьшения диуреза и кирпично-бурого цвета мочи. Диагноз тем более вероятен, если пациент указывает на имевшую место гипогидратацию любого генеза — от посещения бани и физической работы при высокой температуре воздуха до неадекватной инфузионной терапии и передозировки мочегонных, а также на употребление значительного количества мясных продуктов и/или алкоголя. При естественном течении заболевания олигурия практически всегда прогрессирует до анурии с развернутой клинической картиной острой почечной недостаточности.
Проблема острой мочекислой нефропатии тесно прилежит к вторичным гиперурикемиям. Причины повышения уровня мочевой кислоты в сыворотке крови довольно многочисленны и разнообразны. Среди них: хроническая почечная недостаточность, независимо от этиологии, ожирение, особенно высоких степеней, плохо компенсированный сахарный диабет, акромегалия, гипотиреоз, гипопаратиреоз, токсикоз беременности, миелопролиферативные заболевания, саркоидоз, хроническая интоксикация свинцом, хронический алкоголизм. Прослеживается четкая связь между повышенным риском уратного нефролитиаза и наличием у пациента тяжелого псориаза, особенно суставного. В большинстве случаев выраженность гиперурикемии при этих заболевания небольшая, реже умеренная. Таким образом, нарушения пуринового обмена довольно редко значимо отражаются на клинической картине заболевания.
Самым ярким и клинически значимым вариантом вторичной гиперурикемии является «синдром лизиса опухоли» («синдром распада опухоли»), развивающийся при химиотерапии и радиотерапии лимфопролиферативных заболеваний, реже опухолей другой локализации. Ключевым компонентом этого синдрома, наряду с гиперфосфатемией и гиперкалиемией, является гиперпродукция мочевой кислоты, приводящая к развитию острой мочекислой нефропатии, причем нередко на неизмененных почках [11]. Однако тяжелая гиперурикемия, обусловленная генетическими нарушениями, крайне редко приводит к острой мочекислой нефропатии [3, 4].
Медикаментозная терапия заболеваний почек, обусловленных нарушениями пуринового обмена
Консервативная терапия любого варианта подагрической нефропатии в основе своей имеет снижение уровня гиперурикемии, а следовательно, и гиперурикурии, а также повышение растворимости урата в моче.
Всем пациентам в обязательном порядке назначается диета, цель которой уменьшить поступление пуринов в организм с пищей. Это достигается полным исключением из рациона мяса молодых животных, субпродуктов, мясные бульоны, колбас и т. д., ограниченно разрешается мясо полновозрастных животных, рыба. Пациентам рекомендуется преимущественно растительный стол, обильное щелочное питье, цитрусовые и напитки на их основе, а также полное воздержание от алкоголя.
При наличии почечной недостаточности, артериальной гипертензии, недостаточности кровообращения, ожирения вводятся дополнительные ограничения. Прежде всего, рекомендуют снизить потребление поваренной соли, так как эффективность ингибиторов АПФ, особо показанных при нефропатиях, осложненных артериальной гипертензией, да и вообще всей гипотензивной терапии напрямую зависит от объема поступающего в организм натрия. При выраженном дефиците фильтрации появляется необходимость в ограничении потреблении белка. При ожирении уменьшают общую калорийность рациона.
У ряда пациентов, например, при редко рецидивирующем уратном нефролитиазе без почечной недостаточности, при достаточной мотивации со стороны больного, вообще удается ограничиться коррекцией диеты и питьевого режима, не прибегая к назначению лекарственных препаратов.
Лекарственные средства, применяемые для патогенетического лечения подагрической нефропатии, подразделяются на:
Базовым препаратом, влияющим на метаболизм пуринов, является аллопуринол, являющийся ингибитором фермента ксантиноксидазы. Под действием этого фермента происходит последний этап синтеза мочевой кислоты. Предшественники урата ксантин и гипоксантин имеют практически в 10 раз более высокую растворимость в воде по сравнению с мочевой кислотой. Остановка метаболизма пуринов на этом этапе сводит практически до нуля риск кристаллообразования, а значит, и микрокристаллического артрита, и нефропатии.
Аллопуринол показан при подагрическом тубулоинтерстициальном нефрите, острой мочекислой нефропатии, уратном нефролитиазе в сочетании с гиперурикемией, а также при химиотерапии злокачественных новообразований для профилактики развития вторичной гиперурикемии и острой почечной недостаточности. Минимально эффективная дозировка — 200 мг/сут, среднетерапевтическая — 300–400 мг/сут. При химиотерапии злокачественных новообразований требуются высокие, близкие к максимальным, дозировки аллопуринола — 600–900 мг/сут [2].
Аллопуринол склонен вызывать диспептические расстройства и кожную сыпь, которые отмечаются практически у каждого пятого больного. Побочные действия этого препарата чаще носят характер неприятных, но не опасных, и ввиду практически полной (вплоть по последнего времени) безальтернативности этого препарата большая часть пациентов все-таки продолжает лечение.
В последнее время на отечественном рынке появился новый ингибитор ксантиноксидазы фебуксостат, который отличается от аллопуринола более высокой селективностью [3]. Отечественный опыт применения фебуксостата пока крайне ограничен, однако зарубежные исследователи отмечают его более высокую эффективность в отношении гиперурикемии [9]. Однако уже сейчас можно отметить, что этот препарат является полноценной заменой аллопуринола в условиях его непереносимости, аллергии и т. д.
В заключение необходимо отметить, что ингибиторы ксантиноксидазы противопоказаны пациентам, получающим азатиоприн и 6-меркаптопурин, так как этот фермент принимает участие в их метаболизме. При совместном назначении резко возрастает риск токсичности, прежде всего костномозговой.
За рубежом также применяется рекомбинантная уратоксидаза — расбуриказа. Препарат существенно эффективнее аллопуринола снижает гиперурикемию и применяется, главным образом, в гематологической практике для профилактики острой уратной нефропатии [3].
Лекарственные средства, увеличивающие почечное выведение пуринов, — урикозурические препараты — угнетают процесс реабсорбции урата из просвета почечных канальцев. В современной клинической практике эта группа лекарственных средств применяется очень ограниченно. Далеко не у всех пациентов они демонстрируют достаточную эффективность. Кроме того, результатом прямого фармакологического эффекта — увеличения почечной экскреции урата — является рост риска нефролитиаза. Самый известный урикозурический препарат — пробенецид в настоящее время практически отсутствует на отечественном рынке. Бензбромарон зарегистрирован в России, но имеется лишь в очень небольшом количестве. Все урикозурические средства в организме подвергаются печеночному метаболизму и обладают некоторой гепатотоксичностью. Еще одной особенностью этих препаратов является огромное число лекарственных взаимодействий, что затрудняет их применение в составе многокомпонентных схем.
Цитратная терапия является неотъемлемой составляющей медикаментозного лечения подагрической нефропатии. Действие солей лимонной кислоты на процесс кристаллобразования в моче многогранно. Растворимость мочевой кислоты значительно меняется в зависимости от реакции среды. В кислой среде ураты имеют очень плохую растворимость и легко переходят в твердую фазу — кристаллизуются. При нейтральной или щелочной реакции растворимость этих солей увеличивается. Основным эффектом цитратов является способность защелачивать мочу, что предотвращает кристаллизацию уратов и создает условия для растворения уже сформированных кристаллов. На этом основана литолитическая терапия. Однако при щелочной реакции среды уменьшается растворимость фосфатов. Наслоение пленки фосфата на уратный камень делает практически бесперспективным процесс дальнейшего литолиза. Это диктует необходимость тщательного контроля за реакцией мочи на протяжении всего курса лечения. В современных условиях на смену эмпирическому применению растительного сырья, богатого лимонной кислотой и ее солями, пришли лекарственные средства, включающие в себя химически чистый цитрат и набор тест-полосок для мониторирования реакции мочи.
Исследования 1980–90-х гг. продемонстрировали эффективность литолиза уратных камней с применением цитратных смесей в режиме монотерапии порядка 75–80% [10, 11]. В настоящее время в результате совершенствования методики эффективность литолиза удалось повысить до 85–90% в зависимости от особенностей химического состава конкрементов [1, 12, 13].
В последние годы появились работы, свидетельствующие о целесообразности включения препаратов цитрата в многокомпонентные схемы терапии. В частности, при уратных камнях мочеточника, особенно его дистальной трети, комбинированная терапия, включающая цитрат и тамсулозин, привела к самостоятельному отхождению 84,8% конкрементов, что достоверно отличается от групп пациентов, получавших монотерапию этими препаратами (68,8% и 58,8% соответственно), а также от пациентов, получавших плацебо (26,1%) [14].
Имеются убедительные доказательства эффективности комбинации аллопуринола и цитрата при подагрическом интерстициальном нефрите. Двенадцатинедельный курс комбинированной терапии, включающей цитрат 3 г/сут и аллопуринол 100–200 мг/сут, привел к росту скорости клубочковой фильтрации в среднем на 15 мл/мин по сравнению с контрольной группой. Также существенно повысился и клиренс мочевой кислоты. Отметим низкую дозировку аллопуринола. Минимально эффективной считается 200 мг/сут, а 100 мг/сут — вообще субклиническая дозировка, тем не менее, она оказалась эффективной. Можно сделать предположение о возможном потенцировании эффектов аллопуринола и цитрата. Дополнительным позитивным следствием должно быть снижение частоты побочных действий аллопуринола, что является существенным лимитирующим фактором при медикаментозном лечении подагрической нефропатии. К сожалению, авторы не акцентировали на этом внимание [15].
Более яркий эффект цитрата в отношении функции почек отмечен при лечении хронического интерстициального нефрита, обусловленного гиперурикемией, у пациентов, страдающих ожирением [16].
Механизм действия цитрата не ограничивается защелачиванием мочи. Цитрат является одним из физиологических ингибиторов кристаллообразования. Так как моча в норме представляет собой пересыщенный солевой раствор, присутствие в ней ингибиторов кристаллообразования служит необходимым условием адекватного функционирования всей системы мочевыделения. Гипоцитратурия является одним из факторов, способствующих камнеобразованию. Этим может объясняться эффективность цитратных смесей не только при уратном, но и при кальций-оксалатном нефролитиазе [17–19].
Наряду с вышеописанными механизмами действия, соли лимонной кислоты дополнительно обладают антисептическим, цитопротективным и метаболическим эффектами, которые также могут находить применение в клинической практике. В частности, C. Strassner и A. Friesen сообщают об исчезновении кандидурии у 16 пациентов из 18 на фоне терапии цитратными смесями, что, вероятно, связано с изменением реакции мочи [20]. Заключение о цитопротективном эффекте цитрата сделано на основании успешных попыток P. Bruhl и соавт. предотвращать с его помощью химическую травму слизистой мочевого пузыря при терапии препаратами из группы оксазафосфоринов — циклофосфамидом и ифосфамидом [21] (в современной онкологической и нефрологической практике с этой целью применяется препарат из группы муколитиков — месна, практически не влияющий на кислотно-щелочное состояние). Кроме того, сообщается об использовании цитрата для коррекции ацидоза вследствие уретеросигмостомии [22].
Основная сложность при цитратной терапии уратного нефролитиаза заключается в подборе адекватной дозировки препарата. Н. К. Дзеранов, на протяжении многих лет изучавший и разрабатывавший этот аспект, рекомендует начинать с назначения диеты и оценки реакции мочи в течение 5 дней в строго определенное время суток. На основании полученных средних значений уровня рН мочи определяется начальная доза препарата и, главное, ее распределение в течение суток. Через 5 дней лечения снова определяются средние показатели реакции мочи в строго аналогичное время суток и, при необходимости, проводится коррекция дозировки препарата [23]. «Интерактивное», то есть в реальном времени, изменение дозировки цитрата неэффективно и даже небезопасно, так как приводит к скачкам уровня рН, что может вызвать кристаллизацию фосфата.
Ввиду того, что цитрат в норме присутствует в организме, лекарственные средства на его основе практически лишены токсичности. Тем не менее, существуют клинические ситуации, когда применение этих препаратов требует осмотрительности. Применение цитратных смесей нежелательно при острой мочекислой нефропатии и вообще при острой почечной недостаточности любой этиологии. Лимитирующим фактором здесь выступает не цитрат-ион, а калий, выведение которого в этой клинической ситуации затруднено. При острой мочекислой нефропатии целесообразно введение 4% раствора гидрокарбоната натрия, физиологического раствора и т. д. в сочетании с петлевыми диуретиками. Необходимо поддерживать диурез на уровне не менее 100–150 мл/час, рН мочи не ниже 6,5. При возможности назначаются ингибиторы ксантиоксидазы. Цитратные смеси целесообразны при восстановлении диуреза и достижении скорости клубочковой фильтрации 25–30 мл/мин, когда риск гиперкалиемии практически отсутствует [5, 6].
При тяжелой недостаточности кровообращения лимитирующим фактором является повышенное поступление в организм натрия, также содержащегося в цитратных смесях. Иногда в этой ситуации предпочтительнее оказывается ацетазоламид. Данный препарат из группы диуретиков — ингибиторов карбоангидразы сильно, а главное, неконтролируемо защелачивает мочу, что делает его неконкурентоспособным по сравнению с цитратом при медикаментозной терапии уратного нефролитиаза. Однако ацетазоламид — практически единственная возможность повысить уровень рН мочи, не прибегая к введению солей, что в условиях тяжелой сердечной недостаточности крайне нежелательно.
Таким образом, медикаментозное лечение пациентов с заболеваниями почек, обусловленными нарушениями обмена пуринов, несмотря на весьма ограниченный выбор лекарственных препаратов и кажущуюся простоту их выбора, представляет собой сложную и многогранную проблему, требующую междисциплинарного подхода.
Литература
ФГБУ НИИ урологии МЗ РФ, Москва